Типы связей.
В химии различают следующие типы связей: ковалентная, ионная, металлическая, водородная связь, связь Ван-дер-Ваальса, донорно-акцепторная связь, дативная связь.
Ковалентная связь
При образовании ковалентной связи атомы делятся друг с другом электронами. Примером ковалентной связи является химическая связь в молекуле Cl 2 . Впервые Льюис (1916 г.) предположил, что в такой связи каждый из двух атомов хлора делится одним из своих внешних электронов с другим атомом хлора. Для перекрывания атомных орбиталей два атома должны подойти друг к другу как можно ближе. Общая пара электронов образует ковалентную связь. Эти электроны занимают одну и туже орбиталь, а их спины направлены в противоположные стороны.
Таким образом, ковалентная связь осуществляется обобществлением электронов от разных атомов в результате спаривания электронов с противоположными спинами.
Ковалентная связь является широко распространенным типом связи. Ковалентная связь может возникать не только в молекулах, но и кристаллах. Она возникает между одинаковыми атомами (в молекулах Н 2 , Cl 2 , алмазе) и между разными атомами (в молекулах Н 2 О, NH 3 …)
Механизм возникновения ковалентной связи
Механизм рассмотрим на примере образования молекулы Н 2 .
Н+Н=Н 2 , ∆Н=-436 кДж/моль
Ядро свободного атома водорода окружено сферически симметричным электронным облаком, образованным 1s-электроном. При сближении атомов до определенного расстояния, происходит частичное перекрывание их электронных облаков (орбиталей) (рис. 4).
Рис. 4. Механизм образования связи в молекуле водорода.
Если у сблизившихся до касания атомов водорода расстояние между ядрами 0,106 нм, то после перекрывания электронных облаков, это расстояние составляет 0,074 нм.
В результате между центрами ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами. Увеличение плотности отрицательного заряда между ядрами благоприятствует сильному возрастанию сил притяжения между ядрами, что приводит к выделению энергии. Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей. В результате возникновения химической связи между двумя атомами водорода каждый из них достигает электронной конфигурации атома благородного газа - гелия.
Существует два метода, объясняющих с квантово-механических позиций образование области перекрытия электронных облаков, и образования соответственно ковалентной связи. Один из них называется метод ВС (валентных связей), другой МО (молекулярных орбиталей).
В методе валентных связей рассматривается перекрывание атомных орбиталей выделенной пары атомов. В методе МО молекулу рассматривают как целое и распределение электронной плотности (от одного электрона) размазано по всей молекуле. С позиции МО 2Н в Н 2 связаны за счет притяжения ядер к электронному облаку, расположенному между этими ядрами.
Изображение ковалентной связи
Связи изображают по-разному:
1). С помощью электронов в виде точек
В этом случае образование молекулы водорода показывают схемой
Н∙ + Н∙ → Н: Н
2). С помощью квадратных ячеек (орбиталей), как размещение двух электронов с противоположными спинами в одной молекулярной квантовой ячейке

Эта схема показывает, что молекулярный энергетический уровень ниже исходных атомных уровней, а значит молекулярное состояние вещества более устойчивое, чем атомное.
3). Ковалентную связь изображают чертой
Например, Н – Н. эта черта символизирует пару электронов.
Если между атомами возникла одна ковалентная связь (одна общая электронная пара), то она называется одинарной , если больше, то кратной двойной (две общие электронные пары), тройной (три общие электронные пары). Одинарная связь изображается одной чертой, двойная – двумя, тройная – тремя.
Черточка между атомами показывает, что у них пара электронов обобщена.
Классификация ковалентных связей
В зависимости от направления перекрывания электронных облаков различают σ-, π-, δ-связи. σ-связь возникает при перекрывании электронных облаков вдоль оси, соединяющей ядра взаимодействующих атомов.
Примеры σ-связи:

Рис. 5. Образование σ-связи между s-, p-, d- электронами.
Пример образования σ-связи при перекрывании s-s-облаков наблюдается в молекуле водорода.
π-связь осуществляется при перекрывании электронных облаков по обе стороны от оси, соединяющий ядра атомов.

Рис. 6. Образование π-связи между p-, d- электронами.
δ- связь возникает при перекрывании двух d-электронных облаков, расположенных в параллельных плоскостях. δ-связь менее прочная, чем π-связь, а π-связь менее прочная чем σ-связь.
Свойства ковалентной связи
а). Полярность.
Различают две разновидности ковалентной связи: неполярную и полярную.
В случае неполярной ковалентной связи электронное облако, образованное общей парой электронов, распределяется в пространстве симметрично относительно ядер атомов. Примером являются двухатомные молекулы, состоящие из атомов одного элемента: Н 2 , Cl 2 , О 2 , N 2 , F 2 . У них электронная пара в одинаковой мере принадлежит обоим атомам.
В случае полярной связи электронное облако, образующее связь, смещено к атому с большей относительной электроотрицательностью.
Примерами являются молекулы: НCl, Н 2 О, Н 2 S, N 2 S, NH 3 и др. Рассмотрим образование молекулы HCl, которое можно представить следующей схемой
![]()
Электронная пара смещена к атому хлора, т.к. относительная электроотрицательность атома хлора (2,83) больше, чем атома водорода (2,1).
б). Насыщаемость.
Способность атомов участвовать в образовании ограниченного числа ковалентных связей называется насыщаемостью ковалентной связи. Насыщаемость ковалентных связей обусловлена тем, что в химическом взаимодействии участвуют электрона только внешних энергетических уровней, то есть ограниченное число электронов.
в). Направленность и гибридизация ковалентной связи.
Ковалентная связь характеризуется направленностью в пространстве. Это объясняется тем, что электронные облака имеют определенную форму и их максимальное перекрывание возможно при определенной пространственной ориентации.
Направленность ковалентной связи определяет геометрическое строение молекул.
Например, для воды она имеет треугольный вид.

Рис. 7. Пространственная структура молекулы воды.
Экспериментально установлено, что в молекуле воды H 2 O расстояние между ядрами водорода и кислорода составляет 0,096 нм (96 пм). Угол между линиями, проходящими через ядра, составляет 104,5 0 . Таким образом, молекула воды имеет угловую форму и ее строение можно выразить в виде представленного рисунка.
Гибридизация
Как показывают экспериментальные и теоретические исследования (Слейтер, Полинг) при образовании некоторых соединений, таких как BeCl 2 , BeF 2 , BeBr 2 состояние валентных электронов атома в молекуле описываются не чистыми s-, p-, d- волновыми функциями, а их линейными комбинациями. Такие смешанные структуры называются гибридными орбиталями, а процесс смешивания гибридизацией.
Как показывают квантово-химические расчеты смешивание s- и p- орбиталей атома – процесс благоприятный для образования молекулы. В этом случае выделяется больше энергии, чем при образовании связей с участием чистых s- и p- орбиталей. Поэтому гибридизация электронных орбиталей атома приводит к большому понижению энергии системы и соответственно повышению устойчивости молекулы. Гибридизированная орбиталь отличается большей вытянутостью по одну сторону от ядра, чем по другую. Поэтому электронная плотность в области перекрывания гибридного облака будет больше электронной плотности в области перекрывания отдельно s- и p- орбиталей, вследствие чего связь, образованная электронами гибридной орбитали, характеризуется большей прочностью.
Имеют место несколько типов гибридных состояний. При гибридизации s- и p- орбиталей (называется sp-гибридизация), возникают две гибридные орбитали, расположенные относительно друг друга под углом 180 0 . В этом случае образуется линейная структура. Такая конфигурация (структура) известна для большинства галогенидов щелочноземельных металлов (например, ВеX 2 , где X=Cl, F, Br), т.е. угол связи равен 180 0 С.

Рис. 8. sp-гибридизация
Другой тип гибридизации, называемый sp 2 -гибридизацией (образуется из одной s и двух p-орбиталей), приводит к образованию трех гибридных орбиталей, которые располагаются друг к другу под углом 120 0 . При этом в пространстве образуется тригональная структура молекулы (или правильного треугольника). Такие структуры известны для соединений ВX 3 (X=Cl, F, Br).



Рис. 9. sp 2 -гибридизация.
Не менее часто встречается sp 3 -гибридизация, которая образуется из одного s- и трех p- орбиталей. При этом образуется четыре гибридные орбитали ориентированные в пространстве симметрично четырем вершинам тетраэдра, то есть они расположены под углом 109 0 28 " . Такое пространственное положение называется тетраэдрическим. Такая структура известна для молекул NH 3 , Н 2 О и вообще для элементов II периода. Схематично её вид в пространстве можно отобразить следующим рисунком

Рис. 10. Пространственное расположение связей в молекуле аммиака,
спроецированное на плоскость.
Образование тетраэдрических связей за счет sp 3 -гибридизации можно представить в виде следующего (рис. 11):

Рис. 11. Образование тетраэдрических связей при sp 3 -гибридизации.
Образование тетраэдрических связей при sp 3 – гибридизации на примере молекулы CCl 4 представлено на рис. 12.

Рис.12. Образование тетраэдрических связей при sp 3 – гибридизации в молекулы CCl 4
Гибридизация касается не только s- и p-орбиталей. Для объяснения стереохимических элементов III и последующих периодов возникает необходимость в построении гибридных орбиталей одновременно включающих s-, p-, d- орбитали.
К веществам с ковалентной связью относятся:
1. органические соединения;
2. твердые и жидкие вещества, у которых связи образуются между парами атомов галогенов, а также между парами атомов водорода, азота и кислорода, например, Н 2 ;
3. элементы VI группы (например, спиральные цепочки теллура), элементы V группы (например, мышьяк), элементы IV группы (алмаз, кремний, германий);
4. соединения, подчиняющиеся правилу 8-N (такие как InSb, CdS, GaAs, CdTe), когда образующие их элементы расположены в периодической таблице Менделеева в II-VI, III-V группах.
В твердых телах с ковалентной связью могут для одного и того же вещества образовываться различные кристаллические структуры, энергия связи которых практически одинакова. Например, структура ZnS может быть кубической (цинковая обманка) или гексагональной (вюрцит). Расположение ближайших соседей в цинковой обманке и вюрците одинаково, а единственное и небольшое отличие в энергиях этих двух структур определяется расположением атомов, следующих за ближайшими. Подобная способность некоторых веществ называется аллотропией или полиморфизмом. Другим примером аллотропии является карбид кремния, который имеет целый ряд полититпов различной структуры от чисто кубической до гексагональной. Эти многочисленные кристаллические модификации ZnS, SiC существуют при комнатной температуре.
Ионная связь
Ионная связь представляет собой электростатическую силу притяжения между ионами с зарядами противоположного знака (т.е. + и −).
Представление об ионной связи сформировалось на основе идей В.Косселя. Он предположил (1916 г.), что при взаимодействии двух атомов один их них отдает, а другой принимает электроны. Таким образом, ионная связь образуется в результате переноса одного или нескольких электронов от одного атома к другому. Например, в хлориде натрия ионная связь образуется в результате переноса электрона от атома натрия к атому хлора. Вследствие такого переноса образуется ион натрия с зарядом +1 и ион хлора с зарядом -1. Они притягиваются друг к другу электростатическими силами, образуя устойчивую молекулу. Модель электронного переноса, предложенная Косселем, позволяет объяснить образование таких соединений как фторид лития, оксид кальция, оксид лития.
Наиболее типичные ионные соединения состоят из катионов металлов, принадлежащих к I и II группам периодической системы, и анионов неметаллических элементов, принадлежащих к VI и VII группам.
Легкость образования ионного соединения зависит от легкости образования входящих в него катионов и анионов. Легкость образования тем выше, чем меньшую энергию ионизации имеет атом, отдающий электроны (донор электронов), а атом, присоединяющий электроны (акцептор электронов), обладает большим сродством к электрону. Сродство к электрону – это мера способности атома присоединять электрон. Её количественно определяют как изменение энергии, происходящее при образовании одного моля однозарядных анионов из одного моля атомов. Это так называемое понятие «первое сродство к электрону». Второе сродство к электрону – это изменение энергии, происходящее при образовании одного моля двухзарядных анионов из одного моля однозарядных анионов. Данные понятия, то есть энергия ионизации и сродство к электрону, относятся к газообразным веществам и являются характеристиками атомов и ионов в газообразном состоянии. Но следует иметь в виду, что большинство ионных соединений наиболее устойчивы в твердом состоянии. Данное обстоятельство объясняется существованием у них в твердом состоянии кристаллической решетки. Возникает вопрос. Почему же все-таки ионные соединения более устойчивы в виде кристаллических решеток, а не в газообразном состоянии? Ответом на этот вопрос служит расчет энергии кристаллической решетки, основанный на электростатической модели. В дополнении к этому данный расчет является и проверкой теории ионной связи.
Для расчета энергии кристаллической решетки необходимо определить работу, которую нужно затратить на разрушение кристаллической решетки с образованием газообразных ионов. Для проведения расчета используется представление о силах притяжения и отталкивания. Выражение для потенциальной энергии взаимодействия однозарядных ионов получается суммированием энергии притяжения и энергии отталкивания
Е = Е прит + Е отт (1).
В качестве Е прит берется энергия кулоновского притяжения ионов разноименных знаков, например, Na + и Cl - для соединения NaCl
Е прит = -е 2 /4πε 0 r (2),
поскольку распределение электронного заряда в заполненной электронной оболочке сферически-симметрично. Благодаря отталкиванию, возникающему вследствие принципа Паули при перекрытии заполненных оболочек аниона и катиона, расстояние, на которое могут сблизиться ионы, ограниченно. Энергия отталкивания быстро изменяется с межъядерным расстоянием, и её можно записать в виде следующих двух приближенных выражений:
Е отт = А/r n (n≈12) (3)
Е отт = В∙ехр(-r/ρ) (4),
где А и В – константы, r-расстояние между ионами, ρ - параметр (характерная длина).
Следует заметить, что ни одно из этих выражений не соответствует сложному квантово-механическому процессу, который приводит к отталкиванию.
Несмотря на приближенность данных формул, они позволяют достаточно точно рассчитать и соответственно описать химическую связь в молекулах таких ионных соединений, как NaCl, KCl, CaO.
Так как электрическое поле иона имеет сферическую симметрию (рис. 13), то ионная связь в отличие от ковалентной не обладает направленностью. Взаимодействие двух противоположно заряженных ионов компенсируется силами отталкивания только в направлении, соединяющим центры ядер ионов, в других направлениях компенсация электрических полей ионов не происходит. Поэтому они способны взаимодействовать и с другими ионами. Таким образом, ионная связь не обладает насыщаемостью.

Рис. 13. Сферическая симметрия электростатического поля
разноименнозаряженных зарядов.
Вследствие ненаправленности и ненасыщаемости ионной связи энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Благодаря этому наиболее предпочтительная форма существования ионного соединения – кристалл. Например, в кристалле NaCl каждый катион имеет в качестве ближайших соседей шесть анионов.
Только при высоких температурах в газообразном состоянии ионные соединения существуют в виде неассоциированных молекул.
В ионных соединениях координационное число не зависит от специфики электронной структуры атомов, как в ковалентных соединениях, а определяется соотношением размеров ионов. При соотношении ионных радиусов в пределах 0,41 – 0,73 наблюдается октаэдрическая координация ионов, при соотношении 0,73-1,37 – кубическая координация и т.д..
Таким образом, в обычных условиях ионные соединения представляют собой кристаллические вещества. Понятие двухионных молекул, например, NaCL, CsCl к ним не применимо. Каждый кристалл состоит из большого числа ионов.
Ионную связь можно представить как предельную полярную связь, для которой эффективный заряд атома близок к единице. Для чисто ковалентной неполярной связи эффективный заряд атомов равен нулю. В реальных веществах чисто ионных и чисто ковалентных связей встречается мало. Большинство соединений имеет характер связи промежуточный между неполярной ковалентной и полярной ионной. То есть в данных соединениях ковалентная связь имеет частично ионный характер. Характер ионной и ковалентной связи в реальных веществах представлен на рисунке 14.

Рис. 14. Ионный и ковалентный характер связи.
Долю ионного характера связи называют степенью ионности. Она характеризуется эффективными зарядами атомов в молекуле. Степень ионности возрастает с увеличением разности электроотрицательностей образующих её атомов.
Металлическая связь
В атомах металлов внешние валентные электроны удерживаются значительно слабее, чем в атомах неметаллов. Это обуславливает потерю связи электронов с отдельными атомами на достаточно большой промежуток времени и их обобществление. Образуется обобществленный ансамбль из внешних электронов. Существование подобной электронной системы приводит к возникновению сил, которые удерживают положительные ионы металла в сближенном состоянии, несмотря на их одноименную заряженность. Такая связь называется металлической. Подобная связь характерна только для металла и существует в твердом и жидком состоянии вещества. Металлическая связь является одним из видов химической связи. Она основана на обобществлении внешних электронов, которые теряют связь с атомом и поэтому называются свободными электронами (рис. 15).

Рис. 15. Металлическая связь.
Подтверждением существования металлической связи являются следующие факты. Все металлы имеют высокую теплопроводность и высокую электропроводность, которая обеспечивается за счет наличия свободных электронов. Кроме того, это же обстоятельство определяет хорошую отражательную способность металлов к световому облучению, их блеск и непрозрачность, высокую пластичность, положительный температурный коэффициент электросопротивления.
Стабильность кристаллической решетки металлов невозможно объяснить такими видами связи как ионная и ковалентная. Ионная связь между атомами металла, находящихся в узлах кристаллической решетки, невозможна, так как они имеют один и тот же заряд. Ковалентная связь между атомами металла также маловероятна, поскольку каждый атом имеет от 8 до 12 ближайших соседей, а образование ковалентных связей с таким количеством обобществленных пар электронов неизвестно.
Металлические структуры характеризуются тем, что они имеют довольно редкое расположение атомов (межъядерные расстояния большие) и большое число ближайших соседей у каждого атома в кристаллической решетке. В таблице 1 указаны три типичные металлические структуры.
Таблица 1
Характеристики структур трех наиболее распространенных металлов
Видим, что каждый атом участвует в образовании большого числа связей (например, с 8 атомами). Столь большое число связей (с 8 или с 12 атомами) не может быть одновременно локализованы в пространстве. Связь должна осуществляться за счет резонанса колебательного движения внешних электронов каждого атома, в результате которого происходит коллективизация всех внешних электронов кристалла с образованием электронного газа. Во многих металлах для образования металлической связи достаточно взять по одному электрону от каждого атома. Именно это наблюдается для лития, у которого на внешней оболочке имеется всего один электрон. Кристалл лития представляет собой решетку ионов Li + (шаров радиусом 0,068 нм), окруженных электронным газом.

Рис. 16. Различные типы кристаллической упаковки: а-гексагональная плотная упаковка; б- гранецентрированная кубическая упаковка; в-объёмноцентрированная кубическая упаковка.
Между металлической и ковалентной связью имеется сходство. Оно заключается в том, что оба типа связи основаны на обобществлении валентных электронов. Однако ковалентная связь соединяет только два соседних атома, и общие электроны находятся в непосредственной близости от соединенных атомов. В металлической связи несколько атомов участвуют в обобществлении валентных электронов.
Таким образом, понятие металлической связи неразрывно связано с представлением о металлах как совокупности положительно заряженных ионных остовов с большими промежутками между ионами, заполненными электронным газом, при этом на макроскопическом уровне система остается электрически нейтральной.
Кроме вышерассмотренных типов химической связи существуют и другие типы связи, которые являются межмолекулярными: водородная связь, вандерваальсово взаимодействие, донорно-акцепторное взаимодействие.
Донорно-акцепторное взаимодействие молекул
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома и свободной орбитали другого называется донорно-акцепторным. Атом или частица, предоставляющие для связи двухэлектронное облако называется донором. Атом или частица со свободной орбиталью, принимающие эту электронную пару называется акцептором.
Основные виды межмолекулярного взаимодействия. Водородная связь
Между молекулами, валентно-насыщенными, на расстояниях, превышающих размеры частиц, могут проявляться электростатические силы межмолекулярного притяжения. Их называют силы Ван-дер-Ваальса. Вандерваальсово взаимодействие всегда существует между близко расположенными атомами, но играет важную роль лишь в отсутствие более сильных механизмов связи. Это слабое взаимодействие с характерной энергией 0,2 эВ/атом имеет место между нейтральными атомами и между молекулами. Название взаимодействия связывается с именем Ван-дер-Ваальса, поскольку именно он впервые предположил, что уравнение состояния с учетом слабого взаимодействия между молекулами газа описывает свойства реальных газов много лучше, чем уравнение состояния идеального газа. Однако природа этой силы притяжения была объяснена лишь в 1930 году Лондоном. В настоящее время к Ван-дер-Ваальсову притяжению относят следующие три типа взаимодействий: ориентационное, индукционное, дисперсион-ное(эффект Лондона). Энергия Ван-дер-Ваальсова притяжения определяется суммой ориентационного, индукционного и дисперсионного взаимодействий.
Е прит = Е ор +Е инд + Е дисп (5).
Ориентационное взаимодействие (или диполь-дипольное взаимодействие) проявляется между полярными молекулами, которые при приближении поворачиваются (ориентируются) друг к другу разноименными полюсами так, чтобы потенциальная энергия системы молекул стала минимальной. Энергия ориентационного взаимодействия тем существеннее, чем больше дипольный момент молекул μ и меньше расстояние l между ними:
Е ор = -(μ 1 μ 2) 2 / (8π 2 ∙ε 0 ∙l 6) (6),
где ε 0 – электрическая постоянная.
Индукционное взаимодействие связано с процессами поляризации молекул окружающими диполями. Оно тем значительнее, чем выше поляризуемость α неполярной молекулы и больше дипольный момент μ полярной молекулы
Е инд = -(αμ 2)/ (8π 2 ∙ε 0 ∙l 6) (7).
Поляризуемость α неполярной молекулы называется деформационной, так как она связана с деформацией частицы, при этом μ характеризует смещение электронного облака и ядер относительно прежних положений.
Дисперсионное взаимодействие (эффект Лондона) возникает у любых молекул независимо от их строения и полярности. Вследствие мгновенного несовпадения центров тяжести зарядов электронного облака и ядер образуется мгновенный диполь, который индуцирует мгновенные диполи в других частицах. Движение мгновенных диполей становится согласованным. В результате соседние частицы испытывают взаимное притяжение. Энергия дисперсионного взаимодействия зависит от энергии ионизации Е I и поляризуемости молекул α
Е дисп = - (Е I 1 ∙Е I 2)∙ α 1 α 2 /(Е I 1 +Е I 2) l 6 (8).
Промежуточный характер между валентным и межмолекулярным взаимодействием имеет водородная связь. Энергия водородной связи невелика 8 – 80 кДж/моль, но больше энергии взаимодействия Ван-дерВаальса. Водородная связь характерна для таких жидкостей как вода, спирты, кислоты и обусловлена положительно поляризованным атомом водорода. Малые размеры и отсутствие внутренних электронов позволяют атому водорода, присутствующему в жидкости в каком-либо соединении, вступать в дополнительное взаимодействие с ковалентно с ним не связанным отрицательно поляризованным атомом другой или той же самой молекулы
А δ- - Н δ+ …. А δ- - Н δ+ .
То есть происходит ассоциация молекул. Ассоциация молекул приводит к уменьшению летучести, повышению температуры кипения и теплоты испарения, увеличению вязкости и диэлектрической проницаемости жидкостей.
Вода особенно подходящее вещество для образования водородной связи, так как её молекула имеет два атома водорода и две неподелённые пары у атома кислорода. Это обуславливает высокий дипольный момент молекулы (μ D = 1,86 D) и способность образовывать четыре водородные связи: две – как донор протонов и две – как акцептор протонов
(Н 2 О….Н – О…Н 2 О) 2 раза.
Из экспериментов известно, что с изменением молекулярной массы в ряду водородных соединений элементов третьего и последующего периодов температура кипения растет. Если данную закономерность применить к воде, то температура кипения у неё должна быть не 100 0 С, а 280 0 С. Данное противоречие подтверждает существование водородной связи в воде.
Эксперименты показали, что в воде формируются молекулярные ассоциаты в жидкой и особенно в твердой воде. Лед имеет тетраэдрическую кристаллическую решетку. В центре тетраэдра расположен атом кислорода одной молекулы воды, в четырех вершинах находятся атомы кислорода соседних молекул, которые соединены водородными связями с ближайшими соседями. В жидкой воде водородные связи частично разрушены, в её структуре наблюдается динамическое равновесие между ассоциатами молекул и свободными молекулами.
СВЯЗЬ
СВЯЗЬ, -и, о связи, в связи и в связи, ж.
1. (в связи). Отношение взаимной зависимости, обусловленности, общности между чем-н. С. теории и практики. Причинная с.
2. (в связи). Тесное общение между кем-чем-н. Дружеская с. Укреплять международные связи.
3. (в связи и в связи). Любовные отношения, сожительство. Любовная с. Быть в связи с кем-н.
4. мн. ч. Близкое знакомство с кем-н., обеспечивающее поддержку, покровительство, выгоду. Иметь связи во влиятельных кругах. Большие связи.
5. (в связи). Сообщение с кем-чем-н., а также средства, к-рые дают возможность сноситься, сообщаться. Космическая с. Живая с. (через связных). Воздушная с. Междугородная телефонная с.
6. (в связи). Отрасль народного хозяйства, относящаяся к средствам такого сообщения (почта, телеграф, телефон, радио), а также совокупности таких средств, сосредоточенные в соответствующих учреждениях. Служба связи. Работники связи.
7. (в связи), обычно мн. ч. Часть строительной конструкции, соединяющая её основные элементы (спец. ).
В связи с чем , предлог с тв. п. вследствие чего-н., из-за чего-н., будучи обусловлено чем-н. Опоздание в связи с заносами.
В связи с тем что , союз по той причине что, на основании того что. Осведомился, в связи с тем что нужны точные сведения.
СВЯЗЬ это, что такое СВЯЗЬ , значение слова СВЯЗЬ , синонимы к СВЯЗЬ , происхождение (этимология) СВЯЗЬ , СВЯЗЬ ударение, формы слова в других словарях
+ СВЯЗЬ - Т.Ф. Ефремова Новый словарь русского языка. Толково- словообразовательный
СВЯЗЬ это
связь
ж.
а) Взаимные отношения между кем-л., чем-л.
б) Общность, взаимопонимание, внутреннее единство.
а) Общение с кем-л.
б) Любовные отношения, сожительство.
3) Отношения между кем-л., создающие взаимную зависимость, обусловленность.
4) Последовательность, согласованность, стройность (в мыслях, изложении и т.п.).
5) Возможность общения с кем-л., чем-л. на расстоянии.
6) Средства, с помощью которых осуществляется общение на расстоянии.
7) Совокупность учреждений, обеспечивающих средствами общения на расстоянии (телеграф, почта, телефон, радио).
а) Соединение, скрепление чего-л.
б) Сцепление, взаимное притяжение (молекул, атомов, электронов и т.п.).
+ СВЯЗЬ - Современный толковый словарь изд. «Большая Советская Энциклопедия»
СВЯЗЬ это
СВЯЗЬ
1) передача и прием информации с помощью различных технических средств. В соответствии с характером применяемых средств связи разделяется на почтовую (см. Почта) и электрическую (см. Электросвязь).2) Отрасль народного хозяйства, обеспечивающая передачу и прием почтовых, телефонных, телеграфных, радио- и др. сообщений. В СССР в 1986 насчитывалось 92 тыс. предприятий связи; отправлено 8,5 млрд. писем, 50,3 млрд. газет и журналов, 248 млн. посылок, 449 млн. телеграмм; количество телефонных аппаратов на общей телефонной сети составило 33,0 млн. С сер. 60-х гг. в СССР внедряется Единая автоматизированная сеть связи (ЕАСС).3) Связь военная обеспечивается Войсками связи.---в философии - взаимообусловленность существования явлений, разделенных в пространстве и во времени. Связи классифицируют по объектам познания, по формам детерминизма (однозначные, вероятностные и корреляционные), по их силе (жесткие и корпускулярные), по характеру результата, который дает связь (связь порождения, связь преобразования), по направлению действия (прямые и обратные), по типу процессов, которые определяет данная связь (связь функционирования, связь развития, связь управления), по содержанию, которое является предметом связи (связь, обеспечивающая перенос вещества, энергии или информации).
+ СВЯЗЬ - Малый академический словарь русского языка
СВЯЗЬ это
связь
И, предл. о связи, в связи и в связи, ж.
Взаимные отношения между кем-, чем-л.
Связь между промышленностью и сельским хозяйством. Связь науки и производства. Торговые связи. Хозяйственная связь районов. Родственные связи.
Взаимная зависимость, обусловленность.
Причинная связь.
Мы хотим только сказать, --- что все науки находятся между собою в тесной связи и что прочные приобретения одной науки должны не оставаться бесплодны для других. Чернышевский, Грамматические заметки. В. Классовского.
Связь творчества Петрова-Водкина с традициями древнерусской живописи очевидна.
Л. Мочалов, Неповторимость таланта.
Согласованность, стройность, последовательность (в соединении мыслей, в изложении, речи).
Мысли мешались в его голове, и слова не имели никакой связи. Пушкин, Дубровский.
В мыслях недостаточно последовательности, и, когда я излагаю их на бумаге, мне всякий раз кажется, что я утратил чутье к их органической связи. Чехов, Скучная история.
Близость с кем-л., внутреннее единство.
Между ними выросла та невидимая связь, которая не высказывалась словами, а только чувствовалась. Мамин-Сибиряк, Приваловские миллионы.
Когда писатель глубоко чувствует свою кровную связь с народом - это дает красоту и силу ему. М. Горький, Письмо Д. Н. Мамину-Сибиряку, 18 окт. 1912.
Общение (дружеское или деловое), сношения с кем-, чем-л.
Поддерживать связь с кем-л. Завязать связи в литературном мире.
{Иван Иванович и Иван Никифорович} прервали все связи, между тем как прежде были известны за самых неразлучных друзей! Гоголь, Повесть о том, как поссорился Иван Иванович с Иваном Никифоровичем.
Были установлены связи Дроздова с одною из революционных организаций, произведены аресты. М. Горький, Рассказ о герое.
Любовные отношения; сожительство.
{Матвей} вступил в связь с одной мещанкой и имел от нее ребенка. Чехов, Убийство.
{Софья:} Какое ты имеешь право говорить о моей неверности?.. У тебя были десятки связей. М. Горький, Последние.
|| мн. ч. (связи, -ей).
Близкое знакомство с влиятельными лицами, могущее обеспечить поддержку, покровительство.
Добрый Б. решился пристроить отчима. Он уже тогда имел большие связи и немедленно стал просить и рекомендовать своего бедного товарища. Достоевский, Неточка Незванова.
Благодаря связям покойного отца-инженера я был зачислен в Михайловское училище. Перцов, Из автобиографии.
Сообщение, сношение с кем-, чем-л. с помощью различных средств.
В каюте при помощи переговорной трубы командир мог держать связь с мостиком, а по телефону - с любым отделением корабля. Новиков-Прибой, Капитан 1-го ранга.
Морозка был в числе конных, выделенных для связи со взводами во время боя. Фадеев, Разгром.
Теперь оставался только один путь связи - через Волгу. Симонов, Дни и ночи.
|| Тех.
Передача и прием информации при помощи специальных средств.
5. обычно с определением.
Средства, с помощью которых осуществляются сношения и передача информации.
Радиотелефонная связь. Телеграфная связь. Диспетчерская связь.
Ночью связисты артиллерийского полка сумели провести к танку телефонную связь. В. Кожевников, Семь дней.
Совокупность учреждений, обслуживающих техническими средствами общение на расстоянии (телеграф, почта, телефон, радио ).
Работники связи.
|| Воен.
Служба, обеспечивающая общение между воинскими подразделениями (с помощью телефона, радио , посыльных и т. п.).
Начальником разведки и связи стал Архип Хромков. Марков, Строговы.
Из штаба армии прибыл офицер связи со срочным пакетом. Поповкин, Семья Рубанюк.
Соединение, скрепление чего-л.
Связь камней и кирпича с помощью глины.
В Троицком соборе для связи углов он вводит в кладку здания железо. Пилявский, Работы В. П. Стасова в Ленинграде.
Сцепление, взаимное притяжение (молекул, атомов, электронов и т. п.).
Связь электронов с ядром.
Приспособление, связывающее, скрепляющее части какого-л. здания или сооружения; скрепа.
Это была огромная декоративная мастерская - купол, переплетенный наверху железными стропилами и связями. А. Н. Толстой, Егор Абозов.логичность, связность, непрерывность, складность, последовательность, стройность, взаимодействие, соединение, сочленение, конкатенация, сцепление, коммуникация, средство сообщения, сношение, общение, контакт, ассоциация, касательство, отношение, зависимость, привязка, узы, роман, соединительное звено, союз, причинность, паблик рилейшнз, томба, интимные отношения, интрига, соотношение, дуплекс, пуповина, сношения, бондинг, религия, сожительство, паратаксис, связующая нить, преемственность, спайка, взаимосвязанность, корреляция, обусловленность, связишка, родство, замазка, скрепа, амуры, интрижка, синапс, контекст, любовь, нить, почта, сообщение, квадруплекс. Ant. разрозненность
Водородная связь (Н-связь) – это связь, образуемая протонированным атомом водорода с сильноэлектроотцательным атомом той же или другой молекулы. В обычных условиях валентность водорода равна 1, и он способен обобществлять с другими атомами одну электронную пару, образуя ковалентную связь: атом водорода может присоединять электрон, образуя гидрид-ион Н + .
Атом водорода обладает особенностью, отличающей его от всех остальных атомов: отдавая свой электрон, он остается в виде ядра без электронов, т.е. в виде частицы, диаметр, которой в тысячи раз меньше диаметра остальных атомов. При отсутствии электронов ион Н + не отталкивается электронными оболочками других атомов или ионов, а наоборот, притягивается; он может близко подходить к другим атомам, взаимодействовать с их электронами и даже внедряться в их электронные оболочки. В жидкостях Н + -ионы большей частью не сохраняется в виде самостоятельной частицы, а связываются с молекулами двух веществ: в воде с молекулами воды, образуя ион Н 3 О + -ион гидроксония; с молекулой аммиака – NH 4 + -ион аммония.
Будучи связанным с атомом одного из наиболее электроотрицательных элементов: с атомом фтора, кислорода, хлора и азота, атом водорода приобретает относительно высокий положительный заряд, не превышающий единицу. Так как этот заряд сосредоточен на чрезвычайно малом атомном остове, он сильно приближается к другому атому, несущему отрицательный заряд. Это вызывает образование довольно сильной диполь-дипольной связи с энергией 20-30 кДж/моль и больше. Водородная связь возникает в результате междипольного взаимодействия двух сильно полярных связей, принадлежащих различным молекулам или одной и той же молекуле. Она слабее обычной ковалентной связи, энергия которой составляет приблизительно 125-420 кДж/моль и может усиливаться вследствие взаимной поляризации связей, обусловленной указанными особенностями водородного атома. Водородная связь (Н-связь) обозначается Х-Н××××Х.
Атом водорода, участвующий в водородной связи, может располагаться точно посередине между двумя сильноотрицательными атомами – симметричное расположение или же смещаться ближе к тому из них, который имеет большую электроотрицательность – несимметричное расположение.
Энергии водородной связи достаточно, чтобы при обычных и пониженных температурах вызывать заметную диссоциацию молекул. Фтористый водород даже вблизи температуры кипения имеет средний состав (HF) 4 . Ассоциация приводит к аномально высоким температурам плавления и кипения фтороводорода. Существование димера H 2 F 2 объясняет образование кислых солей типа KHF 2 ×NaHF 2 . Тот факт, что фтористоводородная кислота, в отличие от хлористоводородной, бромистоводородной и иодистоводородной, представляет собой слабую кислоту (К д = 7×10 -4) – тоже является следствием ассоциации молекул HF из-за водородных связей.
При наличии несимметричной водородной связи, которая возникает в соединениях кислорода и азота, водород располагается немного ближе к одному из двух соседствующих атомов, здесь межмолекулярная Н-связь . Каждая молекула Н 2 О участвует в образовании двух Н-связей, так что атом кислорода оказывается связанным с четырьмя атомами водорода. Ассоциированные молекулы воды образуют ажурную пространственную структуру, где каждый атом кислорода располагается в центре тетраэдра, а в углах находятся атомы водорода.
Ажурная пространственная структура воды
Ажурной структурой льда объясняется его меньшая плотность, чем воды. При плавлении часть Н-связей рвется и увеличивается плотность воды, т.к. молекулы располагаются более плотно. Рентгеновское исследование показало, что для большей части молекул в жидкой воде сохраняется также тетраэдрическое окружение: расположение соседних молекул почти такое же, как и в кристалле льда, а в последующем слое повторяется
некоторое отклонение от указанной упорядоченности; отклонение увеличивается по мере удаления от взятой молекулы. Для воды характерно наличие «ближнего порядка» как и для других жидкостей, и в меньшей степени, по сравнению с другими жидкостями, наличие «дальнего порядка». Этим объясняется наличие кристаллической структуры в воде.
Свойства воды такие как, большие значения теплоемкости и теплоты испарения, аномально высокие температуры плавления и кипения, высокая диэлектрическая проницаемость – из-за связанности молекул воды водородными связями. Без Н-связей t пл.воды = -100 о С, t кип.воды = -80 о С.
Водородные связи присутствуют в жидком аммиаке. Водородный атом, связанный с углеродом, может приобрести способность образовывать водородную связь, если остальные валентности углерода насыщаются сильно электроотрицательными атомами или соответствующими атомными группами, например, хлороформ (СНСl 3), пентахлорэтан (CCl 3 -CHCl 2), т.е. соседство электроотрицательных атомов может активировать образование водородной связи у атомов СН-групп, хотя электроотрицательность атомов С и Н почти одинакова. Этим объясняется возникновение Н-связей между молекулами в жидких HCN, CHF 3 и др.
Водородная связь свойственна любым агрегатным состояниям вещества. Она образуется между одинаковыми и между различными молекулами, между различными частями одной и той же молекулы – внутримолекулярная водородная связь . Наиболее распространенной является Н-связь между молекулами, содержащими гидроксильные группы ОН - .
Простые эфиры даже с большей молярной массой более летучи, чем спирты, так как в эфирах все атомы водорода связаны с атомами углерода и не способны образовывать Н-связи.
Велика роль Н-связи в биохимических системах. Свойства белков и нуклеиновых кислот в значительной степени обусловлены наличием водородной связи. Н-связь играет большую роль в процессах растворения. Особенно распространены водородные связи в молекулах белков, нуклеиновых кислот и других биологически важных соединений, поэтому эти связи играют важную роль в химии процессов жизнедеятельности.
Исключительно большое значение в биологических системах имеет особый тип межмолекулярного взаимодействия, водородная связь, которая осуществляется между атомами водорода, химически соединенными в одной молекуле, и электроотрицательными атомами F, О, N, Cl, S, принадлежащими другой молекуле. Понятие «водородная связь» было введено впервые в 1920 г. Латимером и Родебушем для объяснения свойств воды и других ассоциированных веществ. Рассмотрим отдельные примеры такой связи.
В п. 5.2 речь шла о молекуле пиридина и было отмечено, что атом азота в ней имеет два внешних электрона с антипараллельными спинами, не участвующих в образовании химической связи. Эта «свободная» или «неподеленная» пара электронов будет притягивать протон и образовывать с ним химическую связь. При этом молекула пиридина перейдет в ионное состояние . Если имеются две пиридиновые молекулы, то они будут соревноваться в захвате протона, в результате образуется соединение

в котором тремя точками обозначен новый тип межмолекулярного взаимодействия, называемый водородной связью. В этом соединении протон находится ближе к левому атому азота. С таким же успехом протон может оказаться ближе к правому атому азота. Следовательно, потенциальная энергия протона как функция расстояния до правого или левого атома азота при фиксированном расстоянии между ними (примерно ) должна изображаться кривой с двумя минимумами. Квантовомеханический расчет такой кривой, проведенный Рейном и Харрисом , приведен на рис. 4.
Квантовомеханическую теорию водородной связи А-Н...В на основе донорно-акцепторных взаимодействий одним из первых развивал Н. Д. Соколов . Причиной связи является вызываемое протоном перераспределение электронной плотности между атомами А и В. Кратко говорят, что происходит обобществление «неподеленной пары» электронов. В действительности же в

Рис. 4. Потенциальная кривая энергии протона в зависимости от расстояния между атомами азота двух пиридиновых молекул.
образовании потенциальных кривых водородной связи участвуют и другие электроны молекул, хотя и в меньшей степени (см. ниже).
Энергия типичных водородных связей варьирует в пределах от 0,13 до 0,31 эВ. Она на порядок меньше энергии химических ковалентных связей, но на порядок больше энергии вандерваальсовых взаимодействий.
Наиболее простым межмолекулярным комплексом, образованным водородной связью, является комплекс Этот комплекс имеет линейную структуру. Расстояние между атомами фтора 2,79 А. Расртояние между атомами в полярной молекуле равно 0,92 А. При образовании комплекса выделяется энергия около 0,26 эВ.
С помощью водородной связи образуется димер воды с энергией связи около 0,2 эВ. Эта энергия равна примерно двадцатой части энергии ковалентной связи ОН. Расстояние меж двумя атомами кислорода в комплексе равно примерно 2,76 А. Оно меньше сумш вандерваальсовых радиусов атомов кислорода, равной 3,06 А. На рис. 5 указано рассчитанное в работе изменение электронной плотности атомов воды при образовании комплекса. Эти расчеты подтверждают, что при образовании комплекса изменяется распределение электронной плотности вокруг всех атомов реагирующих молекул.
О роли всех атомов в установлении водородных связей в комплексе можно судить также по взаимному влиянию двух водородных связей между азотистыми основаниями, тимином и аденином, входящими в состав двойной спирали молекулы ДНК . Расположение минимумов потенциальных кривых протонов в двух связях отражает их взаимную корреляцию (рис. 6).
Наряду с обычной или слабой водородной связью, образованной водородом с выделением энергии, меньшей 1 эВ, и характеризуемой потенциальной энергией с двумя минимумами, водород образует некоторые комплексы с большим энерговыделением. Например, при создании комплекса выделяется энергия, равная 2,17 эВ. Такой тип взаимодействия называют сильной

Рис. 5. Изменение электронной плотности около атомов в комплексе, образованном водородными связями из двух молекул воды.
Заряд электрона принят равным единице. В свободной молекула воды заряд 10 электронов распределен так, что около атома кислорода находится заряд 8,64, а у атомов водорода

Рис. 6. Водородные связи междк азотистыми основаниями: а - тимином (Т) и аденипом (А), входящими в состав молекул ДНН (стрелками указаны места присоединения оснований к цепям молекул сахара и фоофорной кислоты); - потенциальные кривые водородных связей; О - кислород; - водород; - углерод; - азот.
водородной связью. При образовании комплексов с сильной водородной связью значительно изменяется конфигурация молекул. Потенциальная энергия протона имеет один сравнительно плоский минимум, расположенный примерно в центре связи. Поэтому протон легко смещается. Легкая смещаемость протона под влиянием внешнего поля обусловливает большое значение поляризуемости комплекса.
Сильная водородная свягь не проявляется в биологических системах. Что же касается слабой водородной связи, то она имеет решающее значение во всех живых организмах.
Исключительно большая роль водородной связи в биологических системах обусловлена прежде всего тем, что она определяет вторичную структуру белков, имеющую основное значение для всех жизненных процессов; с помощью водородных свявей удерживаются пары оснований в молекулах ДНК и обеспечивается их устойчивая структура в виде двойных спиралей, и, наконец, водородная связь ответственна за весьма необычные свойвтва воды, важные для существования живых систем.
Вода является одним из основных компонентов всего живого. Организмы животных почти на две трети состоят из воды. Человеческий эмбрион в течение первого месяца содержит около 93% воды. Бег воды не было бы жигни. Вода служит основной средой, в которой происходят биохимические реакции в клетке. Она образует жидкую часть крови и лимфы. Вода необходима для пищеварения, так как расщепление углеводов, белков и жиров происходит с присоединением молекул воды. Вода выделяется в клетке при построении белков из аминокислот. Физиологические

Рис. 7. Структура льда. Каждая молекула воды соединена водородными связями (три точки) с четырьмя молекулами воды, находящимися в вершинах тетраэдра.

Рис. 8. Водородная связь в димере и «линейная» водородная связь
свойства биополимеров и многих надмолекулярных структур (в частности, клеточных мембран) весьма существенно зависят от их взаимодействия с водой.
Рассмотрим некоторые свойства воды. Каждая молекула воды обладает большим электрическим моментом. Вследствие высокой электроотрицательности атомов кислорода молекула воды может образовывать водородные связи с одной, двумя, тремя и четырьмя другими молекулами воды. В результате получаются сравнительно устойчивые димеры и другие полимерные комплексы. В среднем каждая молекула в жидкой воде имеет четыре соседа. Состав и структура межмолекулярных комплексов зависят от температуры воды.
Наиболее упорядоченную структуру имеет кристаллическая вода (лед) при нормальном давлении и температуре ниже нуля градусов Цельсия. Кристаллы ее имеют гексагональную структуру. В элементарную ячейку входят четыре молекулы воды. Структура ячейки изображена на рис. 7. Вокруг центрального атома кислорода располдженьг в вершинах правильного тетраэдра на расстояниях 2,76 А четыре других атома кислорода. Каждая молекула воды соединена с соседними четырьмя водородными связями. При этом угол между ОН-связями в молекуле приближается к «тетраэдрическому» значению 109,1°. В свободной молекуле он равен приблизительно 105°.
Структура льда напоминает структуру алмаза. Однако в алмазе между атомами углерода действуют химические силы. Кристалл алмаза - это большая молекула. Кристаллы льда относятся к молекулярным кристаллам. Молекулы в кристалле сохраняют в основном свою индивидуальность и удерживают друг друга водородными связями.

Рис. 9. Экспериментальное значение смещения инфракрасной частоты колебаний в воде при образовании водородной связи под углом .
Решетка льда весьма рыхлая и содержит много «пустот», так как число ближайших молекул воды у каждой молекулы (координационное число) равно только четырем. При расплавлении решетка льда частично разрушается, одновременно заполняются некоторые пустоты и плотность воды становится больше плотности льда. Это одна из основных аномалий воды. При дальнейшем нагревании до 4° С процесс уплотнения продолжается. При нагревании выше 4° С возрастает амплитуда ангармонических колебаний, уменьшается число ассоциированных молекул в комплексах (роях) и плотность воды уменьшается. По грубым оценкам в состав роев при комнатной температуре входит около 240 молекул, при 37° С - около 150, при 45 и 100° С соответственно 120 и 40.
Вклад водородной связи в полную энергию межмолекулярных взаимодействий (11,6 ккал/моль) составляет около 69%. Вследствие водородных связей температуры плавления (0° С) и кипения (100° С) воды существенно отличаются от температур плавления и кипения других молекулярных жидкостей, между молекулами которых действуют только вандерваальсовы силы. Например, для метана эти значения соответственно равны-186 и -161° С.
В жидкой воде наряду с остатками тетраэдрической структуры льда имеются линейные и циклические димеры и другие комплексы, содержащие 3, 4, 5, 6 и более молекул. Существенно, что в зависимости от числа молекул в цикле меняется угол Р, образованный между связью ОН и водородной связью (рис. 8). В димере этот угол равен 110°, в пятичленном кольце 10°, а в шестичленном кольце и гексагональной структуре льда он близок к пулю («линейная» водородная связь).
Оказывается, что наибольшая энергия одной водородной связи соответствует углу Энергия водородной связи пропорциональна (правило Бадгера - Бауера) смещению частоты валентных инфракрасных колебаний группы ОН в молекуле воды но сравнению с частотой колебаний свободной молекулы. Максимальное смещение наблюдается в случае «линейной» водородной связи. В молекуле воды в этом случае частота уменьшается на , а частота - на . На рис. 9 приведен график зависимости отношения смещения
частоты к максимальному смещению от угла . Следовательно, этот график характеризует также зависимость энергии водородной связи от угла . Такая зависимость является проявлением кооперативного характера водородной связи.
Предпринимались многократные попытки теоретического вычисления структуры и свойств воды при учете водородных связей и других межмолекулярных взаимодействий. Согласно статистической физике термодинамические свойства системы взаимодействующих молекул, находящейся в объеме V при постоянном давлении Р в статистическом равновесии с термостатом, определяются через статистическую сумму состояний
![]()
Здесь V - объем системы; к - постоянная Больцмана; Т - абсолютная температура; означает, что надо взять след от статистического оператора, стоящего в фигурных скобках, где Н - квантовый оператор энергии всей системы. Этот оператор равен сумме операторов кинетической энергии поступательного и вращательного движений молекул и оператора потенциальной энергии взаимодействия всех молекул.
Если известны все собственные функции и полный спектр энергий Е, оператора Н, то (6.2) принимает вид

Тогда свободная энергия Гиббса G системы при давлении Р и температуре Т определяется простым выражением
Зная гиббсовскую свободную энергию, находим полную энергию энтропию объем .
К сожалению, вследствие сложного характера взаимодействий между молекулами в воде (анизотропные дипольные молекулы, водородные связи, приводящие к комплексам переменного состава, в которых энергия водородных связей сама зависит от состава и структуры комплекса и т. д.) мы не можем записать оператор Н в явном виде. Поэтому приходится прибегать к очень большим упрощениям. Так, Намети и Шерага вычислили статистическую сумму, исходя того, что можно учесть только пять энергетических состояний молекул в комплексах соответствии
с числом образуемых ими водородных связей (0, 1, 2, 3, 4) с соседними молекулами. С помощью этой модели им даже удалось показать, что плотность воды максимальна при 4° С. Однако в дальнейшем сами авторы подвергли критике развитую ими теорию, так как она не описывала многие экспериментальные факты. С другими попытками теоретических расчетов структуры воды можно познакомиться в обзоре Бен-Наима и Стиллингера .
Вследствие дипольного характера молекул воды и большой роли водородных связей исключительно важную роль играют и взаимодействия молекул воды с ионами и нейтральными молекулами в живых организмах. Взаимодействия, приводящие к гидратации ионов и особому типу взаимодействий, получивших название гидрофобных и гидрофильных, будут рассмотрены в следующих разделах этой главы»
Говоря о роли воды в биологических явлениях, следует отметить, что все живые организмы весьма успешно приспособились к определенной величине водородной связи между молекулами . Об этом свидетельствует тот факт, что замена молекулами тяжелой воды оказывает весьма существенное влияние на биологические системы . Уменьшается растворимость полярных молекул, уменьшается скорость прохождения нервного импульса, нарушается работа ферментов, замедляется рост бактерий и грибов и т. д. Возможно, все эти явления связаны с тем, что водородное взаимодействие между молекулами сильнее, чем взаимодействие между молекулами На большее значение водородной связи между молекулами тяжелой воды указывает бояее высокая температура ее плавления (3,8° С) и большая теплота плавления (1,51 ккал/моль). Для обычной воды теплота плавления 1,43 ккал/моль.
|
В результате изучения данной темы вы узнаете:
В результате изучения данной темы вы научитесь:
Учебные вопросы: |
5.1. Ковалентная связь
Химическая связь образуется при сближении двух или большего числа атомов, если в результате их взаимодействия происходит понижение полной энергии системы. Наиболее устойчивыми электронными конфигурациями внешних электронных оболочек атомов являются конфигурации атомов благородных газов, состоящие из двух или восьми электронов. Внешние электронные оболочки атомов других элементов содержат от одного до семи электронов, т.е. являются незавершенными. При образовании молекулы атомы стремятся приобрести устойчивую двухэлектронную или восьмиэлектронную оболочки. В образовании химической связи принимают участие валентные электроны атомов.
Ковалентной называется химическая связь между двумя атомами, которая образуется за счет электронных пар, принадлежащих одновременно этим двум атомам.
Существует два механизма образования ковалентной связи: обменный и донорно – акцепторный.
5.1.1. Обменный механизм образования ковалентной связи
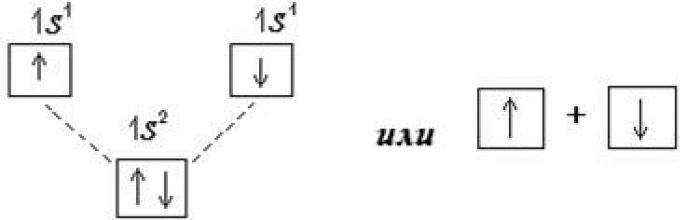
Обменный механизм образования ковалентной связи реализуется за счет перекрывания электронных облаков электронов, принадлежащих различным атомам. Например, при сближении двух атомов водорода происходит перекрывание 1s электронных орбиталей. В результате возникает общая пара электронов, одновременно принадлежащая обоим атомам. При этом химическая связь образуется электронами, имеющими антипараллельные спины, рис. 5.1.
Рис. 5.1. Образование молекулы водорода из двух атомов Н
5.1.2. Донорно – акцепторный механизм образования ковалентной связи
При донорно – акцепторном механизме образования ковалентной связи связь также образуется с помощью электронных пар. Однако в этом случае однин атом (донор) предоставляет свою электронную пару, а другой атом (акцептор) участвует в образовании связи своей свободной орбиталью. Примером реализации донорно-акцепторной связи является образование иона аммония NH 4 + при взаимодействии аммиака NH 3 с катионом водорода H + .
В молекуле NH 3 три электронные пары образуют три связи N – H, четвертая, принадлежащая атому азота электронная пара является неподеленной. Эта электронная пара может дать связь с ионом водорода, который имеет свободную орбиталь. В результате получается ион аммония NH 4 + , рис. 5.2.

Рис. 5.2. Возникновение донорно-акцепторной связи при образовании иона аммония
Необходимо отметить, что существующие в ионе NH 4 + четыре ковалентных связи N – H равноценны. В ионе аммония невозможно выделить связь, образованную по донорно-акцепторному механизму.
5.1.3. Полярная и неполярная ковалентная связь
Если ковалентная связь образуется одинаковыми атомами, то электронная пара располагается на одинаковом расстоянии между ядрами этих атомов. Такая ковалентная связь называется неполярной. Примером молекул с неполярной ковалентной связью являются Н 2 , Cl 2 , О 2 , N 2 и др.
В случае полярной ковалентной связи общая электронная пара смещена к атому с большей электроотрицательностью. Этот тип связи реализуется в молекулах, образованных различными атомами. Ковалентная полярная связь имеет место в молекулах HCl, HBr, CO, NO и др. Например, образование полярной ковалентной связи в молекуле HCl можно представить схемой, рис. 5.3:

Рис. 5.3. Образование ковалентной полярной связи в молекуле НС1
В рассматриваемой молекуле электронная пара смещена к атому хлора, поскольку его электроотрицательность (2,83) больше, чем электроотрицательность атома водорода (2,1).
5.1.4. Дипольный момент и строение молекул
Мерой полярности связи является ее дипольный момент μ:
μ = е l ,
где е – заряд электрона, l – расстояние между центрами положительного и отрицательного зарядов.
Дипольный момент – это векторная величина. Понятия «дипольный момент связи» и «дипольный момент молекулы» совпадают только для двухатомных молекул. Дипольный момент молекулы равен векторной сумме дипольных моментов всех связей. Таким образом, дипольный момент многоатомной молекулы зависит от ее строения.
В линейной молекуле СО 2 , например, каждая из связей С–О полярна. Однако молекула СО 2 в целом неполярна, так как дипольные моменты связей компенсируют друг друга (рис. 5.4). Дипольный момент молекулы углекислого газа m = 0.
В угловой молекуле Н 2 О полярные связи Н–О расположены под углом 104,5 o . Векторная сумма дипольных моментов двух связей Н–О выражается диагональю параллелограмма (рис. 5.4). В результате дипольный момент молекулы воды m не равен нулю.

Рис. 5.4. Дипольные моменты молекул СО 2 и Н 2 О
5.1.5. Валентность элементов в соединениях с ковалентной связью
Валентность атомов определяется числом неспаренных электронов, участвующих в образовании общих электронных пар с электронами других атомов. Имеющие один неспаренный электрон на внешнем электронном слое атомы галогенов в молекулах F 2 , НCl, PBr 3 и CCl 4 одновалентны. Элементы подгруппы кислорода содержат два неспаренных электрона на внешнем слое, поэтому в таких соединениях как O 2 , Н 2 О, Н 2 S и SCl 2 они двухвалентны.
Поскольку помимо обычных ковалентных связей в молекулах может образовываться связь по донорно-акцепторному механизму, валентность атомов зависит также от наличия у них неподеленных электронных пар и свободных электронных орбиталей. Количественной мерой валентности является число химических связей, с помощью которых данный атом соединен с другими атомами.
Максимальная валентность элементов как правило не может превышать номер группы, в которой они находятся. Исключение составляют элементы побочной подгруппы первой группы Cu, Ag, Au, валентность которых в соединениях больше единицы. К валентным относятся прежде всего электроны внешних слоев, однако для элементов побочных подгрупп в образовании химической связи принимают участие и электроны предпоследних (предвнешних) слоев.
5.1.6. Валентность элементов в нормальном и возбужденном состояниях
Валентность большинства химических элементов зависит от того, находятся эти элементы в нормальном или возбужденном состоянии. Электронная конфигурация атома Li: 1s 2 2s 1 . Атом лития на внешнем уровне имеет один неспаренный электрон, т.е. литий одновалентен. Необходима очень большая затрата энергии, связанная с переходом 1s-электрона на 2р-орбиталь, чтобы получить трехвалентный литий. Эта затрата энергии настолько велика, что не компенсируется энергией, которая выделится при образовании химических связей. В связи с этим не существует соединений трехвалентного лития.
Конфигурация внешнего электронного слоя элементов подгруппы бериллия ns 2 . Это означает, что на внешнем электронном слое у этих элементов на орбитали ns ячейке находится два электрона с противоположными спинами. Элементы подгруппы бериллия не содержат неспаренных электронов, поэтому их валентность в нормальном состоянии равна нулю. В возбужденном состоянии электронная конфигурация элементов подгруппы бериллия ns 1 nр 1 , т.е. элементы образуют соединения, в которых они двухвалентны.
Валентные возможности атома бора
Рассмотрим электронную конфигурацию атома бора в основном состоянии: 1s 2 2s 2 2р 1 . Атом бора в основном состоянии содержит один неспаренный электрон (рис. 5.5), т.е. он одновалентен. Однако для бора не характерно образование соединений в которых он одновалентен. При возбуждении атома бора происходит переход одного 2s-электрона на 2р-орбиталь (рис. 5.5). Атом бора в возбужденном состоянии имеет 3 неспаренных электрона и может образовывать соединения, в которых его валентность равна трем.

Рис. 5.5. Валентные состояния атома бора в нормальном и возбужденном состояниях
Энергия, затраченная на переход атома в возбужденное состояние в пределах одного энергетического уровня, как правило, с избытком компенсируется энергией, выделяющейся при образовании дополнительных связей.
Благодаря наличию в атоме бора одной свободной 2р-орбитали, бор в соединениях может образовывать четвертую ковалентную связь, выступая в роли акцептора электронной пары. На рис.5.6 показано как происходит взаимодействие молекулы BF с ионом F – , в результате которого образуется ион – , в котором бор образует четыре ковалентных связи.

Рис. 5.6. Донорно-акцепторный механизм образования четвертой ковалентной связи у атома бора
Валентные возможности атома азота
Рассмотрим электронное строение атома азота (рис. 5.7).

Рис. 5.7. Распределение электронов на орбиталях атома азота
Из представленной схемы видно, что азот имеет три неспаренных электрона, он может образовывать три химические связи и его валентность равна трем. Переход атома азота в возбужденное состояние невозможен, поскольку второй энергетический уровень не содержит d–орбиталей. Вместе с тем атом азота может предоставить неподеленную электронную пару внешних электронов 2s 2 атому, имеющему свободную орбиталь (акцептору). В результате возникает четвертая химическая связь атома азота, как это имеет место, например, в ионе аммония (рис. 5.2). Таким образом, максимальная ковалентность (число образованных ковалентных связей) атома азота равна четырем. В своих соединениях азот, в отличие от других элементов пятой группы, не может быть пятивалентным.
Валентные возможности атомов фосфора, серы и галогенов
В отличие от атомов азота, кислорода и фтора, находящиеся в третьем периоде атомы фосфора, серы и хлора имеют свободные 3d-ячейки, на которые могут переходить электроны. При возбуждении атома фосфора (рис. 5.8), у него на внешнем электронном слое оказываются 5 неспаренных электронов. В результате в соединениях атом фосфора может быть не только трех-, но и пятивалентным.

Рис. 5.8. Распределение валентных электронов на орбиталях для атома фосфора, находящегося в возбужденном состоянии
В возбужденном состоянии сера помимо валентности, равной двум, проявляет также валентность, равную четырем и шести. При этом последовательно происходит распаривание 3р и 3s-электронов (рис. 5.9).


Рис. 5.9. Валентные возможности атома серы в возбужденном состоянии
В возбужденном состоянии для всех элементов главной подгруппы V группы, кроме фтора, возможно последовательное распаривание сначала р-, а затем и s-электронных пар. В результате эти элементы становятся трех-, пяти- и семивалентными (рис. 5.10).



Рис. 5.10. Валентные возможности атомов хлора, брома и иода в возбужденном состоянии
5.1.7. Длина, энергия и направленность ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия и направленность.
Длина ковалентной связи
Длина связи – это расстояние между ядрами атомов, образующими эту связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А 2 и В 2:
 .
.
Сверху вниз по подгруппам периодической системы элементов длина химической связи возрастает, поскольку в этом направлении увеличивается радиусы атомов (табл. 5.1). С увеличением кратности связи ее длина уменьшается.
Таблица 5.1.
Длина некоторых химических связей
Химическая связь |
Длина связи, пм |
Химическая связь |
Длина связи, пм |
С – С |
|||
Энергия связи
Мерой прочности связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга. Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Для молекулы IСl 3 , например, Есвязи ≈40 , а для молекул N 2 и CO Есвязи ≈1000 кДж/моль.
Сверху вниз по подгруппам периодической системы элементов энергия химической связи уменьшается, поскольку в этом направлении увеличивается длина связи (табл. 5.1). С увеличением кратности связи ее энергия возрастает (табл. 5.2).
Таблица 5.2.
Энергий некоторых химических связей
Химическая связь |
Энергия связи, |
Химическая связь |
Энергия связи, |
С – С |
|||
Насыщаемость и направленность ковалентной связи
Важнейшими свойствами ковалентной связи является ее насыщаемость и направленность. Насыщаемость можно определить как способность атомов образовывать ограниченное число ковалентных связей. Так атом углерода может образовывать только четыре ковалентных связи, а атом кислорода – две. Максимальное число обычных ковалентных связей, которые может образовывать атом (без учета связей, образованных по донорно-акцепторному механизму) равно числу неспаренных электронов.
Ковалентные связи имеют пространственную направленность, поскольку перекрывание орбиталей при образовании одинарной связи происходит по линии, связывающей ядра атомов. Пространственное расположение электронных орбиталей молекулы обуславливают ее геометрию. Углы между химическими связями называют валентными углами.
Насыщаемость и направленность ковалентной связи отличает эту связь от ионной, которая в отличие от ковалентной связи является ненасыщенной и ненаправленной.
Пространственное строение молекул Н 2 O и NH 3
Направленность ковалентной связи рассмотрим на примере молекул Н 2 O и NH 3 .
Молекула H 2 O образуется из атома кислорода и двух атомов водорода. Атом кислорода имеет два неспаренных p-электрона, которые занимают две орбитали, расположенные под прямым углом друг к другу. Атомы водорода имеют неспаренные 1s-электроны. Угол между связями, образованными р-электронами, должен быть близок к углу между орбиталями р-электронов. Экспериментально, однако, найдено, что угол между связями О–Н в молекуле воды равен 104,50. Увеличение угла по сравнению с углом 90 o можно объяснить силами отталкивания, которые действует между атомами водорода, рис. 5.11. Таким образом, молекула Н 2 О имеет угловую форму.
В образовании молекулы NH 3 участвуют три неспаренных p-электрона атома азота, орбитали которых расположены в трех взаимно перпендикулярных направлениях. Следовательно, три связи N–H должны располагаться под углами друг к другу, близкими к 90° (рис. 5.11). Экспериментальное значение угла между связями в молекуле NH 3 равно 107,3°. Отличие значения углов между связями от теоретических обусловлено, как и в случае молекулы воды, взаимным отталкиванием атомов водорода. Кроме того, представленные схемы не учитывают возможность участия двух электронов на орбиталях 2s в образовании химических связей.

Рис. 5.11. Перекрывание электронных орбиталей при образовании химических связей в молекулах Н 2 O (а) и NH 3 (б)
Рассмотрим образование молекулы ВеС1 2 . Атом бериллия в возбужденном состоянии имеет два неспаренных электрона: 2s и 2p. Можно предположить, что атом бериллия должен образовывать две связи: одну связь, образованную s-электроном и одну связь, образованную р-электроном. Эти связи должны иметь различную энергию и различную длину. Молекула ВеС1 2 в таком случае должна быть не линейной, а уголковой. Опыт, однако, показывает, что молекула ВеС1 2 имеет линейное строение и обе химические связи в ней равноценны. Аналогичная ситуация наблюдается при рассмотрении строения молекул BCl 3 и CCl 4 – все связи в этих молекулах равноценны. Молекула ВС1 3 имеет плоское строение, СС1 4 – тетраэдрическое.
Для объяснения строения таких молекул, как ВеС1 2 , BCl 3 и CCl 4 , Полинг и Слейтер (США) ввели представление о гибридизации атомных орбиталей. Они предложили заменить несколько атомных орбиталей, не очень сильно отличающихся своей энергией, таким же числом равноценных орбиталей, называемых гибридными. Эти гибридные орбитали составляются из атомных в результате их линейной комбинации.
Согласно Л. Полингу при образовании химических связей атомом, имеющим электроны различного типа в одном слое и, следовательно, не очень сильно отличающиеся своей энергией (например, s и p) возможно изменение конфигурации орбиталей различных типов, при которой происходит их выравнивание по форме и энергии. В результате образуются гибридные орбитали, имеющие асимметричную форму и сильно вытянутые по одну сторону от ядра. Важно подчеркнуть, что модель гибридизации используется в том случае, когда в образовании связей участвуют электроны различного типа, например s и р.
5.1.8.2. Различные типы гибридизации атомных орбиталей
sp- гибридизация
Гибридизация одной s - и одной р - орбитали (sp - гибридизация) реализуется, например, при образовании хлорида бериллия. Как было показано выше, в возбужденном состоянии атом Be имеет два неспаренных электрона, один из которых занимает 2s-орбиталь, а другой – 2p-орбиталь. При образовании химической связи эти две различные орбитали трансформируются в две одинаковые гибридные орбитали, направленные под углом 180° друг к другу (рис. 5.12). Линейное расположение двух гибридных орбиталей отвечает минимальному их отталкиванию друг от друга. В результате молекула BeCl 2 имеет линейное строение – все три атома расположены на одной линии.

Рис. 5.12. Схема перекрывания электронных орбиталей при образовании молекулы BeCl 2
Строение молекулы ацетилена; сигма- и пи-связи
Рассмотрим схему перекрывания электронных орбиталей при образовании молекулы ацетилена . В молекуле ацетилена каждый атом углерода находится в sp–гибридном состоянии. Две sp–гибридные орбитали расположены под углом 1800 друг к другу; они образуют одну σ -связь между атомами углерода и две σ -связи с атомами водорода (рис. 5.13).

Рис. 5.13. Схема образования s -связей в молекуле ацетилена
σ -связью называют связь, образованную в результате перекрывания электронных орбиталей по линии, соединяющей ядра атомов.
Каждый атом углерода в молекуле ацетилена содержит еще по два р-электрона, которые не принимают участия в образовании σ -связей. Электронные облака этих электронов располагаются во взаимно перпендикулярных плоскостях и, перекрываясь друг с другом, образуют еще две π -связи между атомами углерода за счет бокового перекрывания негибридных р –облаков (рис. 5.14).
π -связь – это ковалентная химическая связь, образованная в результате увеличения электронной плотности по обе стороны от линии, соединяющей ядра атомов.

Рис. 5.14. Схема образования σ - и π -связей в молекуле ацетилена.
Таким образом, в молекуле ацетилена между атомами углерода образуется тройная связь, которая состоит из одной σ - связи и двух π -связей; σ -связи являются более прочными, чем π - связи.
sp2- гибридизация
Строение молекулы BCl 3 можно объяснить с позиций sp 2 - гибридизации . Находящийся в возбужденном состоянии атом бора на внешнем электронном слое содержит один s-электрон и два p-электрона, т.е. три неспаренных электрона. Эти три электронных облака можно преобразовать в три равноценных гибридных орбитали. Минимальному отталкиванию трех гибридных орбиталей друг от друга соответствует их расположение в одной плоскости под углом 120 o друг к другу (рис. 5.15). Таким образом, молекула BCl 3 имеет плоскую форму.

Рис. 5.15. Плоское строение молекулы BCl 3
sp 3 - гибридизация
Валентные орбитали атома углерода (s, р x , р y , р z) можно преобразовать в четыре равноценных гибридные орбитали, которые расположены в пространстве под углом 109,5 o друг к другу и направлены к вершинам тетраэдра, в центре которого находится ядро атома углерода (рис. 5.16).
Рис. 5.16. Тетраэдрическое строение молекулы метана
5.1.8.3. Гибридизация с участием неподеленных электронных пар
Модель гибридизации может использоваться для объяснения строения молекул, в которых помимо связывающих, имеются также и неподеленные электронные пары. В молекулах воды и аммиака общее число электронных пар центрального атома (О и N) равно четырем. При этом в молекуле воды имеются две, а в молекуле аммиака – одна неподеленная электронная пара. Образование химических связей в данных молекулах можно объяснить, предполагая, что неподеленные электронные пары также могут заполнять гибридные орбитали. Неподеленные электронные пары занимают в пространстве значительно больше места, чем связывающие. В результате отталкивания, которое возникает между неподеленными и связывающими электронными парами происходит уменьшение валентных углов в молекулах воды и аммиака, которые оказываются меньше, чем 109,5 o .

Рис. 5.17. sp 3 – гибридизация с участием неподеленных электронных пар в молекулах H 2 O (А) и NH 3 (Б)
5.1.8.4. Установление типа гибридизации и определение строения молекул
Для установления типа гибридизации, а, следовательно, и структуры молекул необходимо использовать следующие правила.
1. Тип гибридизации центрального атома, не содержащего неподеленных электронных пар, определяется числом сигма связей. Если таких связей две имеет место sp-гибридизация, три - sp 2 -гибридизация, четыре - sp 3 -гибридизация. Неподеленные электронные пары (в отсутствии связей, образованных по донорно-акцепторному механизму) отсутствуют в молекулах, образованных атомами бериллия, бора, углерода, кремния, т.е. у элементов главных подгрупп II - IV групп.
2. Если центральный атом содержит неподеленные электронные пары, то число гибридных орбиталей и тип гибридизации определяются суммой числа сигма-связей и числа неподеленных электронных пар. Гибридизация с участием неподеленных электронных пар имеет место в молекулах, образованных атомами азота, фосфора, кислорода, серы, т.е. элементов главных подгрупп V и VI групп.
3. Геометрическая форма молекул определяется типом гибридизации центрального атома (табл. 5.3).
Таблица 5.3.
Валентные углы, геометрическая форма молекул в зависимости от числа гибридных орбиталей и типа гибридизации центрального атома
5.2. Ионная связь
Ионная связь осуществляется путем электростатического притяжения между противоположно заряженными ионами. Эти ионы образуются в результате перехода электронов от одного атома к другому. Ионная связь образуется между атомами, имеющими большие различия электроотрицательностей (обычно больше 1,7 по шкале Полинга), например, между атомами щелочных металлов и галогенов.
Рассмотрим возникновение ионной связи на примере образования NaCl. Из электронных формул атомов Na 1s 2 2s 2 2p 6 3s 1 и Cl 1s 2 2s 2 2p 6 3s 2 3p 5 видно, что для завершения внешнего уровня атому натрия легче отдать один электрон, чем присоединить семь, а атому хлора легче присоединить один, чем отдать семь. В химических реакциях атом натрия отдает один электрон, а атом хлора принимает его. В результате электронные оболочки атомов натрия и хлора превращаются в устойчивые электронные оболочки благородных газов (электронная конфигурация катиона натрия Na + 1s 2 2s 2 2p 6 , а электронная конфигурация аниона хлора Cl – - 1s 2 2s 2 2p 6 3s 2 3p 6). Электростатическое взаимодействие ионов приводит к образованию молекулы NaCl.
Основные характеристики ионной связи и свойства ионных соединений
1. Ионная связь является прочной химической связью. Энергия этой связи составляет величины порядка 300 – 700 кДж/моль.
2. В отличие от ковалентной связи, ионная связь является ненаправленной , поскольку ион может притягивать к себе ионы противоположного знака в любом направлении.
3. В отличие от ковалентной связи, ионная связь является ненасыщенной , так как взаимодействие ионов противоположного знака не приводит к полной взаимной компенсации их силовых полей.
4. В процессе образования молекул с ионной связью не происходит полной передачи электронов, поэтому стопроцентной ионной связи в природе не существует. В молекуле NaCl химическая связь лишь на 80% ионная.
5. Соединения с ионной связью – это твердые кристаллические вещества, имеющие высокие температуры плавления и кипения.
6. Большинство ионных соединений растворяются в воде. Растворы и расплавы ионных соединений проводят электрический ток.
5.3. Металлическая связь
Атомы металлов на внешнем энергетическом уровне содержат небольшое число валентных электронов. Поскольку энергия ионизации атомов металлов невелика, валентные электроны слабо удерживаются в этих атомах. В результате в кристаллической решетке металлов появляются положительно заряженные ионы и свободные электроны. При этом катионы металла находятся в узлах кристаллической их решетки, а электроны свободно перемещаются в поле положительных центров образуя так называемый «электронный газ». Наличие между двумя катионами отрицательно заряженного электрона приводит тому, что каждый катион взаимодействует с этим электроном. Таким образом, металлическая связь – это связь между положительными ионами в кристаллах металлов, которая осуществляется путем притяжения электронов, свободно перемещающихся по всему кристаллу.
Поскольку валентные электроны в металле равномерно распределены по всему кристаллу металлическая связь, как и ионная, является ненаправленной связью. В отличие от ковалентной связи, металлическая связь является ненасыщенной связью. От ковалентной связи металлическая связь отличается также и прочностью. Энергия металлической связи примерно в три – четыре раза меньше энергии ковалентной связи.
Вследствие большой подвижности электронного газа металлы характеризуются высокой электро- и теплопроводностью.
5.4. Водородная связь
В молекулах соединениях HF, H 2 O, NH 3 существуют связи водорода с сильно электроотрицательным элементом (Н–F, Н–O, Н–N). Между молекулами таких соединений могут образовываться межмолекулярные водородные связи . В некоторых органических молекулах, содержащих связи Н–O, Н–N, могут возникать внутримолекулярные водородные связи .
Механизм образования водородной связи имеет частично электростатический, частично донорно – акцепторный характер. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором - атомы водорода, соединенные с этими атомами. Как и для ковалентной связи, для водородной связи характерны направленность в пространстве и насыщаемость .
Водородную связь принято обозначать точками: Н ··· F. Водородная связь проявляется тем сильнее, чем больше электроотрицательность атома-партнера и чем меньше его размеры. Она характерна прежде всего для соединений фтора, а также кислорода, в меньшей степени азота, в еще меньшей степени для хлора и серы. Соответственно меняется и энергия водородной связи (табл. 5.4).
Таблица 5.4.
Средние значения энергий водородных связей
Межмолекулярная и внутримолекулярная водородная связь
Благодаря водородным связям молекулы объединяются в димеры и более сложные ассоциаты. Например, образование димера муравьиной кислоты можно представить следующей схемой (рис. 5.18).

Рис. 5.18. Образование межмолекулярных водородных связей в муравьиной кислоте
В воде могут возникать длинные цепи ассоциатов (Н 2 О) n (рис. 5.19).

Рис. 5.19. Образование цепи ассоциатов в жидкой воде за счет межмолекулярных водородных связей
Каждая молекула Н 2 О может образовать четыре водородных связи, а молекула HF – только две.
Водородные связи могут возникать как между различными молекулами (межмолекулярная водородная связь), так и внутри молекулы (внутримолекулярная водородная связь). Примеры образования внутримолекулярной связи для некоторых органических веществ представлены на рис. 5.20.

Рис. 5.20. Образование внутримолекулярной водородной связи в молекулах различных органических соединений
Влияние водородной связи на свойства веществ
Наиболее удобным индикатором существования межмолекулярной водородной связи является температура кипения вещества. Более высокая температура кипения воды (100 o C по сравнению с водородными соединениями элементов подгруппы кислорода (H 2 S, H 2 Se, H 2 Te) объясняется наличием водородных связей: на разрушение межмолекулярных водородных связей в воде необходимо затратить дополнительную энергию.
Водородная связь существенным образом может влиять на структуру и свойства веществ. Существование межмолекулярной водородной связи повышает температуры плавления и кипения веществ. Наличие внутримолекулярной водородной связи приводит к тому, что молекула дезоксирибонуклеиновой кислоты (ДНК) оказывается свернутой в воде двойной спирали.
Водородная связь также играет важную роль в процессах растворения, поскольку растворимость зависит и от способности соединения давать водородные связи с растворителем. В результате содержащие ОН-группы такие вещества, как сахар, глюкоза, спирты, карбоновые кислоты, как правило, хорошо растворимы в воде.
5.5. Типы кристаллических решеток
Твердые вещества, как правило, имеют кристаллическое строение. Частицы, из которых состоят кристаллы (атомы, ионы или молекулы) располагаются в строго определенных точках пространства, образуя кристаллическую решетку. Кристаллическая решетка состоит из элементарных ячеек, которые сохраняют особенности структуры, характерные для данной решетки. Точки, в которых находятся частицы, называются узлами кристаллической решетки . В зависимости от вида частиц, находящихся в узлах решетки и от характера связи между ними различают 4 типа кристаллических решеток.
5.5.1. Атомная кристаллическая решетка
В узлах атомных кристаллических решеток находятся атомы, соединенные между собой ковалентными связями. К веществам, имеющим атомную решетку, относятся алмаз, кремний, карбиды, силициды и т.д. В структуре атомного кристалла невозможно выделить отдельные молекулы, весь кристалл рассматривается как одна гигантская молекула. Структура алмаза показана на рис. 5.21. Алмаз состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами. Вследствие того, что ковалентные связи прочные, все вещества, имеющие атомные решетки, являются тугоплавкими, твердыми и малолетучими. Они мало растворимы в воде.

Рис. 5.21. Кристаллическая решетка алмаза
5.5.2. Молекулярная кристаллическая решетка
В узлах молекулярных кристаллических решеток находятся молекулы, связанные между собой слабыми межмолекуляриыми силами. Поэтому вещества с молекулярной решеткой имеют малую твердость, они легкоплавки, характеризуются значительной летучестью, мало растворимы в воде, их растворы, как правило, не проводят электрический ток. Веществ c молекулярной кристаллической решеткой известно очень много. Это твердые водород, хлор, оксид углерода(IV) и другие вещества, которые при обычной температуре находятся в газообразном состоянии. Большинство кристаллических органических соединений имеют молекулярную решетку.
5.5.3. Ионная кристаллическая решетка
Кристаллические решетки, в узлах которых находятся ионы, называются ионными . Их образуют вещества с ионной связью, например, галогениды щелочных металлов. В ионных кристаллах нельзя выделить отдельные молекулы, весь кристалл можно рассматривать как одну макромолекулу. Связи между ионами прочные, поэтому вещества с ионной решеткой обладают малой летучестью, высокими температурами плавления и кипения. Кристаллическая решетка хлорида натрия представлена на рис. 5.22.

Рис. 5.22. Кристаллическая решетка хлорида натрия
На этом рисунке светлые шары – ионы Na + , темные – ионы Сl – . Слева на рис. 5.22 показана элементарная ячейка NaCI.
5.5.4. Металлическая кристаллическая решетка
Металлы в твердом состоянии образуют металлические кристаллические решетки. В узлах таких решеток находятся положительные ионы металлов, а валентные электроны свободно перемещаются между ними. Электроны электростатически притягивают катионы, тем самым придавая устойчивость металлической решетке. Такое строение решетки обусловливает высокую теплопроводность, электропроводность и пластичность металлов - при механическом деформировании не происходит разрыва связей и разрушения кристалла, поскольку составляющие его ионы как бы плавают в облаке электронного газа. На рис. 5.23 представлена кристаллическая решетка натрия.

Рис. 5.23. Кристаллическая решетка натрия