К опасным грузам класса 2 относятся чистые газы, смеси газов, смеси одного или нескольких газов с одним или несколькими другими веществами, а также изделия, содержащие такие вещества. Вещества и изделия класса 2 подразделяются на сжатый газ; сжиженный газ; охлажденный сжиженный газ; растворенный газ; аэрозольные распылители и малые емкости, содержащие газ (газовые баллончики); другие изделия, содержащие газ под давлением; газы не под давлением, подпадающие под действие специальных требований (образцы газов). Перевозка опасных грузов класса 2 сопряжена с риском взрыва, пожара, удушения, обморожения или отравления.
Воздух - естественная смесь газов, состоящая по объему из 78% азота, 21% кислорода, 0,93% аргона, 0,3% диоксида углерода и очень небольшого количества благородных газов, водорода, озона, оксида углерода, аммиака, метана, сернистого газа и других. Плотность жидкого воздуха 0,96 г/куб. см (при -192°C и нормальном давлении). Воздух необходим для протекания множества процессов: горения топлива, выплавки металлов из руд, промышленного получения различных химических соединений. Воздух также используется для получения кислорода, азота и благородных газов; в качестве хладагента, тепло- и звукоизоляционного материала, рабочего тела в электроизоляционных устройствах, пневматических шинах, струйных и распылительных аппаратах, пневматических машинах и т.п.
Кислород - химический элемент, обладающий ярко выраженными окислительными свойствами. В основном, кислород применяется в медицине. Помимо медицины кислород используется в металлургии и других отраслях, а жидкий кислород служит окислителем ракетного топлива.
Пропан – бесцветный горючий взрывоопасный газ без запаха, содержащийся в природных и попутных нефтяных газах, в газах, получаемых из CO и H2, а также при переработке нефти. Пропан отрицательно влияет на ЦНС, при попадании на кожу жидкого пропана возможно обморожение.
Азот - бесцветный газ, без вкуса и запаха. Азот применяют во многих отраслях промышленности: как инертную среду при различных химических и металлургических процессах, для заполнения свободного пространства в ртутных термометрах, при перекачке горючих жидкостей и т. д. Жидкий азот используется в различных холодильных установках. Азот используется для промышленного производства аммиака, который затем перерабатывается на азотную кислоту, удобрения, взрывчатые вещества и т. д.
Хлор - ядовитый газ желто-зеленого цвета. Основные количества хлора перерабатываются на месте его производства в хлорсодержащие соединения. Также хлор используется для отбелки целлюлозы и тканей, для санитарных нужд и хлорирвания воды, а также для хлорирования некоторых руд с целью извлечения титана, ниобия, циркония и др. Отравления хлором возможны в химической, целлюлозно-бумажной, текстильной, фармацевтической промышленности и т.д. Хлор раздражает слизистые оболочки глаз и дыхательных путей, зачастую, к первичным воспалительным изменениям присоединяется вторичная инфекция. Концентрация хлора в воздухе 500 мг/куб. м. при пятнадцатиминутном воздействии смертельна. В целях профилактики отравлений необходимы: герметизация производственного оборудования, эффективная вентиляция, при необходимости использование противогаза.
Аммиак - бесцветный газ с резким характерным запахом. Аммиак используется для производства азотных удобрений, взрывчатых веществ и полимеров, азотной кислоты, соды и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя. В холодильной технике аммиак используется в качестве хладагента (717). Также широкое применение 10% раствор аммиака (нашатырный спирт) получил в медицине. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Аммиак обладает как местным, так и резорбтивным действием. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы, вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями. Кроме того, сжиженный аммиак при испарении поглощает тепло, и при соприкосновении с кожей возникает обморожение различной степени.
Н2О - вода, Жидкий металл - ртуть! Жидкое состояние обычно считают промежуточным между твёрдым телом и газом: газ не сохраняет ни объём, ни форму, а твёрдое тело сохраняет и то, и другое .
Форма жидких тел может полностью или отчасти определяться тем, что их поверхность ведёт себя как упругая мембрана. Так, вода может собираться в капли. Но жидкость способна течь даже под своей неподвижной поверхностью, и это тоже означает несохранение формы (внутренних частей жидкого тела) .
Молекулы жидкости не имеют определённого положения, но в то же время им недоступна полная свобода перемещений. Между ними существует притяжение, достаточно сильное, чтобы удержать их на близком расстоянии.
Вещество в жидком состоянии существует в определённом интервале температур, ниже которого переходит в твердое состояние (происходит кристаллизация либо превращение в твердотельное аморфное состояние - стекло) , выше - в газообразное (происходит испарение) . Границы этого интервала зависят от давления.
Как правило, вещество в жидком состоянии имеет только одну модификацию. (Наиболее важные исключения - это квантовые жидкости и жидкие кристаллы.) Поэтому в большинстве случаев жидкость является не только агрегатным состоянием, но и термодинамической фазой (жидкая фаза) .
Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь, морская вода и др. Жидкости могут выполнять функцию растворителей.
[править]
Физические свойства жидкостей
Текучесть
Основным свойством жидкостей является текучесть. Если к участку жидкости, находящейся в равновесии, приложить внешнюю силу, то возникает поток частиц жидкости в том направлении, в котором эта сила приложена: жидкость течёт. Таким образом, под действием неуравновешенных внешних сил жидкость не сохраняет форму и относительное расположение частей, и поэтому принимает форму сосуда, в котором находится.
В отличие от пластичных твёрдых тел, жидкость не имеет предела текучести: достаточно приложить сколь угодно малую внешнюю силу, чтобы жидкость потекла.
Сохранение объёма
Одним из характерных свойств жидкости является то, что она имеет определённый объём (при неизменных внешних условиях) . Жидкость чрезвычайно трудно сжать механически, поскольку, в отличие от газа, между молекулами очень мало свободного пространства. Давление, производимое на жидкость, заключенную в сосуд, передаётся без изменения в каждую точку объёма этой жидкости (закон Паскаля, справедлив также и для газов) . Эта особенность, наряду с очень малой сжимаемостью, используется в гидравлических машинах.
Жидкости обычно увеличивают объём (расширяются) при нагревании и уменьшают объём (сжимаются) при охлаждении. Впрочем, встречаются и исключения, например, вода сжимается при нагревании, при нормальном давлении и температуре от 0 °C до приблизительно 4 °C.
Вязкость
Кроме того, жидкости (как и газы) характеризуются вязкостью. Она определяется как способность оказывать сопротивление перемещению одной из частей относительно другой - то есть как внутреннее трение.
Когда соседние слои жидкости движутся относительно друг друга, неизбежно происходит столкновение молекул дополнительно к тому, которое обусловлено тепловым движением. Возникают силы, затормаживающие упорядоченное движение. При этом кинетическая энергия упорядоченного движения переходит в тепловую - энергию хаотического движения молекул.
Жидкость в сосуде, приведённая в движение и предоставленная самой себе, постепенно остановится, но её температура повысится.
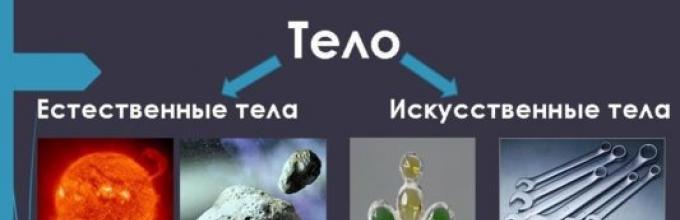
Окружающий мир – это разнообразие предметов и форм. Но все многообразие нашего мира можно условно разделить на три группы: тела, вещества и частицы. О том, как их отличить, и что характеризует каждое из этих понятий, речь пойдет на уроке окружающего мира в 3 классе.
Тела
С точки зрения науки, любой предмет – это тело. Все, что вас окружает, дома, в классе, на улице – это тела. Например, кружка, стол, телефон, камень, стул, мяч.
По происхождению тела могут быть:
- естественными – созданными природой;
- искусственными – созданными человеком;
- живые ;
- неживые .

Рис. 1. Многообразие тел
Тело характеризуется:
- размером;
- формой;
- цветом
- массой;
- температурой.
Любое тело при делении превращается в новый предмет. Например, ручка – тело, но если ее разобрать, получится несколько деталей.
Вещества
Вещество – это то, из чего состоит тело. Предмет может состоять из нескольких веществ. Например, кувшин сделан из глины, шарф связан из шерсти, ложка – из металла.
ТОП-4 статьи которые читают вместе с этой

Рис. 2. Вещества
Вещества бывают трех состояний:
- твердые – те, которые можно пощупать;
- жидкие – например, вода;
- газообразные – воздух.
Одно из удивительных свойств некоторых тел – это возможность переходить из одного состояния в другое под воздействием некоторых факторов. Например, вода при температуре ниже нуля принимает твердую форму льда, а при 100 градусах по Цельсию начинает кипеть и превращается в газообразную форму – пар.
В отличие от тела, вещества при делении не изменяются. Если кусочек сахара разделить еще на несколько частей, то каждый из них все так же будет сахаром. Или разлить воду по чашкам, она так и останется водой, а не станет новым веществом.
Частицы
Вещества состоят из еще меньших единиц. Они настолько маленькие, что их невозможно увидеть без микроскопа. Их называют частицы.
Частицы сохраняют свойства вещества. В качестве опыта можно размешать кусочек сахара в воде. От этого жидкость станет сладкой, но вещества мы не увидим, поскольку частицы сахара смешались с частицами воды.
Между частицами есть свободное пространство. Состояние вещества будет завесить от того, как плотно находятся в нем элементы. В твердых веществах промежутков между частицами почти нет, в жидких – имеется некоторое расстояние между элементами, а в газообразных – частицы свободно перемещаются, поскольку между ними большое расстояние.

Рис. 3. Частицы в разных телах
Что мы узнали?
Тема “Тела, вещества, частицы” по окружающему миру – это очень интересный предмет для обсуждений. Можно делать множество опытов, чтобы изучить их свойства. Тела – это сложные предметы, состоящие из одного или нескольких веществ. В свою очередь, в любом материале есть совокупность наименьших неделимых элементов – частиц.
На сегодняшний день известно о существовании более чем 3 миллионов различных веществ. И цифра эта с каждым годом растет, так как химиками-синтетиками и другими учеными постоянно производятся опыты по получению новых соединений, обладающих какими-либо полезными свойствами.
Часть веществ - это природные обитатели, формирующиеся естественным путем. Другая половина - искусственные и синтетические. Однако и в первом и во втором случае значительную часть составляют газообразные вещества, примеры и характеристики которых мы и рассмотрим в данной статье.
Агрегатные состояния веществ
С XVII века принято было считать, что все известные соединения способны существовать в трех агрегатных состояниях: твердые, жидкие, газообразные вещества. Однако тщательные исследования последних десятилетий в области астрономии, физики, химии, космической биологии и прочих наук доказали, что есть еще одна форма. Это плазма.
Что она собой представляет? Это частично или полностью И оказывается, таких веществ во Вселенной подавляющее большинство. Так, именно в состоянии плазмы находятся:
- межзвездное вещество;
- космическая материя;
- высшие слои атмосферы;
- туманности;
- состав многих планет;
- звезды.
Поэтому сегодня говорят, что существуют твердые, жидкие, газообразные вещества и плазма. Кстати, каждый газ можно искусственно перевести в такое состояние, если подвергнуть его ионизации, то есть заставить превратиться в ионы.
Газообразные вещества: примеры
Примеров рассматриваемых веществ можно привести массу. Ведь газы известны еще с XVII века, когда ван Гельмонт, естествоиспытатель, впервые получил углекислый газ и стал исследовать его свойства. Кстати, название этой группе соединений также дал он, так как, по его мнению, газы - это нечто неупорядоченное, хаотичное, связанное с духами и чем-то невидимым, но ощутимым. Такое имя прижилось и в России.
Можно классифицировать все газообразные вещества, примеры тогда привести будет легче. Ведь охватить все многообразие сложно.
По составу различают:
- простые,
- сложные молекулы.
К первой группе относятся те, что состоят из одинаковых атомов в любом их количестве. Пример: кислород - О 2 , озон - О 3 , водород - Н 2 , хлор - CL 2 , фтор - F 2 , азот - N 2 и прочие.
- сероводород - H 2 S;
- хлороводород - HCL;
- метан - CH 4;
- сернистый газ - SO 2 ;
- бурый газ - NO 2 ;
- фреон - CF 2 CL 2 ;
- аммиак - NH 3 и прочие.

Классификация по природе веществ
Также можно классифицировать виды газообразных веществ по принадлежности к органическому и неорганическому миру. То есть по природе входящих в состав атомов. Органическими газами являются:
- первые пять представителей (метан, этан, пропан, бутан, пентан). Общая формула C n H 2n+2 ;
- этилен - С 2 Н 4 ;
- ацетилен или этин - С 2 Н 2 ;
- метиламин - CH 3 NH 2 и другие.
Еще одной классификацией, которой можно подвергнуть рассматриваемые соединения, является деление на основе входящих в состав частиц. Именно из атомов состоят не все газообразные вещества. Примеры структур, в которых присутствуют ионы, молекулы, фотоны, электроны, броуновские частицы, плазма, также относятся к соединениям в таком агрегатном состоянии.
Свойства газов
Характеристики веществ в рассматриваемом состоянии отличаются от таковых для твердых или жидких соединений. Все дело в том, что свойства газообразных веществ особенные. Частицы их легко и быстро подвижны, вещество в целом изотропное, то есть свойства не определяются направлением движения входящих в состав структур.
Можно обозначить самые главные физические свойства газообразных веществ, которые и будут отличать их от всех остальных форм существования материи.
- Это такие соединения, которые нельзя увидеть и проконтролировать, ощутить обычными человеческими способами. Чтобы понять свойства и идентифицировать тот или иной газ, опираются на четыре описывающих их все параметра: давление, температура, количество вещества (моль), объем.
- В отличие от жидкостей газы способны занимать все пространство без остатка, ограничиваясь лишь величиной сосуда или помещения.
- Все газы между собой легко смешиваются, при этом у этих соединений нет поверхности раздела.
- Существуют более легкие и тяжелые представители, поэтому под действием силы тяжести и времени, возможно увидеть их разделение.
- Диффузия - одно из важнейших свойств этих соединений. Способность проникать в другие вещества и насыщать их изнутри, совершая при этом совершенно неупорядоченные движения внутри своей структуры.
- Реальные газы электрический ток проводить не могут, однако если говорить о разреженных и ионизированный субстанциях, то проводимость резко возрастает.
- Теплоемкость и теплопроводность газов невысока и колеблется у разных видов.
- Вязкость возрастает с увеличением давления и температуры.
- Существует два варианта межфазового перехода: испарение - жидкость превращается в пар, сублимация - твердое вещество, минуя жидкое, становится газообразным.
Отличительная особенность паров от истинных газов в том, что первые при определенных условиях способны перейти в жидкость или твердую фазу, а вторые нет. Также следует заметить способность рассматриваемых соединений сопротивляться деформациям и быть текучими.

Подобные свойства газообразных веществ позволяют широко применять их в самых различных областях науки и техники, промышленности и народном хозяйстве. К тому же конкретные характеристики являются для каждого представителя строго индивидуальными. Мы же рассмотрели лишь общие для всех реальных структур особенности.
Сжимаемость
При разных температурах, а также под влиянием давления газы способны сжиматься, увеличивая свою концентрацию и снижая занимаемый объем. При повышенных температурах они расширяются, при низких - сжимаются.
Под действием давления также происходят изменения. Плотность газообразных веществ увеличивается и, при достижении критической точки, которая для каждого представителя своя, может наступить переход в другое агрегатное состояние.

Основные ученые, внесшие вклад в развитие учения о газах
Таких людей можно назвать множество, ведь изучение газов - процесс трудоемкий и исторически долгий. Остановимся на самых известных личностях, сумевших сделать наиболее значимые открытия.
- в 1811 году сделал открытие. Неважно, какие газы, главное, что при одинаковых условиях их в одном объеме их содержится равное количество по числу молекул. Существует рассчитанная величина, имеющая название по фамилии ученого. Она равна 6,03*10 23 молекул для 1 моль любого газа.
- Ферми - создал учение об идеальном квантовом газе.
- Гей-Люссак, Бойль-Мариотт - фамилии ученых, создавших основные кинетические уравнения для расчетов.
- Роберт Бойль.
- Джон Дальтон.
- Жак Шарль и многие другие ученые.
Строение газообразных веществ
Самая главная особенность в построении кристаллической решетки рассматриваемых веществ, это то, что в узлах ее либо атомы, либо молекулы, которые соединяются друг с другом слабыми ковалентными связями. Также присутствуют силы ван-дер-ваальсового взаимодействия, когда речь идет о ионах, электронах и других квантовых системах.
Поэтому основные типы строения решеток для газов, это:
- атомная;
- молекулярная.
Связи внутри легко рвутся, поэтому эти соединения не имеют постоянной формы, а заполняют весь пространственный объем. Это же объясняет отсутствие электропроводности и плохую теплопроводность. А вот теплоизоляция у газов хорошая, ведь, благодаря диффузии, они способны проникать в твердые тела и занимать свободные кластерные пространства внутри них. Воздух при этом не пропускается, тепло удерживается. На этом основано применение газов и твердых тел в совокупности в строительных целях.

Простые вещества среди газов
Какие по строению и структуре газы относятся к данной категории, мы уже оговаривали выше. Это те, что состоят из одинаковых атомов. Примеров можно привести много, ведь значительная часть неметаллов из всей периодической системы при обычных условиях существует именно в таком агрегатном состоянии. Например:
- фосфор белый - одна из данного элемента;
- азот;
- кислород;
- фтор;
- хлор;
- гелий;
- неон;
- аргон;
- криптон;
- ксенон.
Молекулы этих газов могут быть как одноатомными (благородные газы), так и многоатомными (озон - О 3). Тип связи - ковалентная неполярная, в большинстве случаев достаточно слабая, но не у всех. Кристаллическая решетка молекулярного типа, что позволяет этим веществам легко переходить из одного агрегатного состояния в другое. Так, например, йод при обычных условиях - темно-фиолетовые кристаллы с металлическим блеском. Однако при нагревании сублимируются в клубы ярко-фиолетового газа - I 2 .

К слову сказать, любое вещество, в том числе металлы, при определенных условиях могут существовать в газообразном состоянии.
Сложные соединения газообразной природы
Таких газов, конечно, большинство. Различные сочетания атомов в молекулах, объединенные ковалентными связями и ван-дер-ваальсовыми взаимодействиями, позволяют сформироваться сотням различных представителей рассматриваемого агрегатного состояния.
Примерами именно сложных веществ среди газов могут быть все соединения, состоящие из двух и более разных элементов. Сюда можно отнести:
- пропан;
- бутан;
- ацетилен;
- аммиак;
- силан;
- фосфин;
- метан;
- сероуглерод;
- сернистый газ;
- бурый газ;
- фреон;
- этилен и прочие.
Кристаллическая решетка молекулярного типа. Многие из представителей легко растворяются в воде, образуя соответствующие кислоты. Большая часть подобных соединений - важная часть химических синтезов, осуществляемых в промышленности.
Метан и его гомологи
Иногда общим понятием "газ" обозначают природное полезное ископаемое, которое представляет собой целую смесь газообразных продуктов преимущественно органической природы. Именно он содержит такие вещества, как:
- метан;
- этан;
- пропан;
- бутан;
- этилен;
- ацетилен;
- пентан и некоторые другие.
В промышленности они являются очень важными, ведь именно пропан-бутановая смесь - это бытовой газ, на котором люди готовят пищу, который используется в качестве источника энергии и тепла.

Многие из них используются для синтеза спиртов, альдегидов, кислот и прочих органических веществ. Ежегодное потребление природного газа исчисляется триллионами кубометров, и это вполне оправданно.
Кислород и углекислый газ
Какие вещества газообразные можно назвать самыми широко распространенными и известными даже первоклассникам? Ответ очевиден - кислород и углекислый газ. Ведь это они являются непосредственными участниками газообмена, происходящего у всех живых существ на планете.
Известно, что именно благодаря кислороду возможна жизнь, так как без него способны существовать только некоторые виды анаэробных бактерий. А углекислый газ - необходимый продукт "питания" для всех растений, которые поглощают его с целью осуществления процесса фотосинтеза.
С химической точки зрения и кислород, и углекислый газ - важные вещества для проведения синтезов соединений. Первый является сильным окислителем, второй чаще восстановитель.
Галогены
Это такая группа соединений, в которых атомы - это частицы газообразного вещества, соединенные попарно между собой за счет ковалентной неполярной связи. Однако не все галогены - газы. Бром - это жидкость при обычных условиях, а йод - легко возгоняющееся твердое вещество. Фтор и хлор - ядовитые опасные для здоровья живых существ вещества, которые являются сильнейшими окислителями и используются в синтезах очень широко.
Газообразное состояние вещества
Полимеры бывают естественного (растительные и животные ткани) и искусственного (пластмассы, целлюлоза, стекловолокно и др.) происхождения.
Так же, как и в случае обычных молекул, система макромолекул. образующих полимер, стремится к наиболее вероятному состоянию - устойчивому равновесию, соответствующему минимуму свободной энергии. Следовательно, в принципе полимеры также должны иметь структуру в виде кристаллической решетки. Однако ввиду громоздкости и сложности макромолекул лишь в немногих случаях удалось получить совершенные макро- молекулярные кристаллы. В большинстве случаев полимеры состоят из кристаллических и аморфных областей.
Жидкое состояние характерно тем, что потенциальная энергия притяжения молекул несколько превосходит по абсолютному значению их кинетическую энергию. Силы притяжения между молекулами в жидкости обеспечивает удержание молекул в объеме жидкости. Вместе с тем молекулы в жидкости не связаны между собой стационарными устойчивыми связями, как в кристаллах. Они плотно заполняют занимаемое жидкостью пространство, поэтому жидкости практически несжимаемы и обладают достаточно высокой плотностью. Группы молекул могут изменять свое взаимное положение, что обеспечивает текучесть жидкостей. Свойство жидкости сопротивляться течению называется вязкостью. Жидкостям свойственна диффузия и броуновское движение, однако в значительно меньшей степени, чем газам.
Объем, занимаемый жидкостью, ограничен поверхностью. Так как при заданном объеме минимальной поверхностью обладает шар, то жидкость в свободном состоянии (например, в невесомости) принимает форму шара.
Жидкости обладают некоторой структурой, которая, однако, выражена гораздо слабее, чем у твердых тел. Важнейшим свойством жидкостей является изотропия свойств. Простая идеальная модель жидкости пока не создана.
Существует промежуточное состояние между жидкостями и кристаллами, которое называется жидкокристаллическим. Особенностью жидких кристаллов с молекулярной точки зрения является вытянутая, веретенообразная форма их молекул, что приводит к анизотропии их свойств.
Выделяют два типа жидких кристаллов - нематики и смектики. Смектики характерны наличием параллельных слоев молекул, отличающихся друг от друга упорядоченностью структуры. У нематиков упорядоченность обеспечивается ориентацией молекул. Анизотропия свойств жидких кристаллов обусловливает их важные оптические свойства. Жидкие кристаллы могут, например, быть прозрачными в одном направлении и непрозрачными в другом. Важно, что ориентацией молекул жидких кристаллов и их слоев легко можно управлять с помощью внешних воздействий (например, температуры, электрических и магнитных полей).
Газообразное состояние вещества возникает в том случае, когда
кинетическая энергия теплового движения молекул превосходит потенциальную энергию их связи. Молекулы при этом стремятся удалиться друг от друга. Газ не имеет структуры, занимает весь предоставленный ему объем, легко сжимаем; в газах легко происходит диффузия.
Свойства веществ, находящихся в газообразном состоянии, объясняет кинетическая газовая теория. Основные ее постулаты состоят в следующем:
Все газы состоят из молекул;
Размеры молекул пренебрежимо малы по сравнению с расстояниями между ними;
Молекулы постоянно находятся в состоянии хаотического (броуновского) движения;
Между столкновениями молекулы сохраняют постоянную скорость движения; траектории между столкновениями - отрезки прямых линий;
Столкновение между молекулами и молекул со стенками сосуда являются идеально упругими, т.е. полная кинетическая энергия соударяющихся молекул остается неизменной.
Рассмотрим упрощенную модель газа, подчиняющегося приведенным постулатам. Такой газ называется идеальным газом. Пусть идеальный газ в количестве N одинаковых молекул, каждая из которых имеет массу m , находится в сосуде кубической формы с длиной ребра l (рис. 5.14). Молекулы движутся хаотически; средняя скорость их движения <v >. Для упрощения разобьем все молекулы на три равные группы и предположим, что они движутся только в направлениях, перпендикулярных двум противоположным стенкам сосуда (рис. 5.15).
 Рис. 5.14.
Рис. 5.14.
Каждая из молекул газа, движущаяся со скоростью <v
> при абсолютно упругом соударении со стенкой сосуда, изменит направление движения на обратное, не изменив скорость. Импульс молекулы <р
> = m
<v
> становится равным при этом - m
<v
>. Изменение импульса в каждом столкновении, очевидно, равно . Сила, действующая во время этого столкновения, равна F
= -2m
<v
>/Δt
. Полное изменение импульса при столкновении со стенками всех N
/3молекул равно ![]() . Определим интервал времени Δt
, в течение которого произойдут все N/3 столкновения: Д t = 2//< v >. Тогда среднее значение силы, действующей на любую стенку,
. Определим интервал времени Δt
, в течение которого произойдут все N/3 столкновения: Д t = 2//< v >. Тогда среднее значение силы, действующей на любую стенку,

Давление р газа на стенку определим как отношение силы <F > к площади стенки l 2:
где V = l 3 – объем сосуда.
Таким образом, давление газа обратно пропорционально его объему (напомним, что эмпирически этот закон установили Бойль и Мариотт).
Перепишем выражение (5.4) в виде
Здесь - средняя кинетическая энергия молекул газа. она пропорциональна абсолютной температуре Т :
где k – постоянная Больцмана.
Подставив (5.6) в (5.5), получим
Удобно перейти от числа молекул N к числу молей n газа, напомним, что (N А – число Авогадро), и тогда
где R = kN A - - универсальная газовая постоянная.
Выражение (5.8) есть уравнение состояния классического идеального газа для п молей. Данное уравнение, записанное для произвольной массы m газа
где М - молярная масса газа, называется уравнением Клапейрона-Менделеева (см. (5.3)).
Реальные газы подчиняются этому уравнению в ограниченных пределах. Дело в том, что уравнения (5.8) и (5.9) не учитывают межмолекулярное взаимодействие в реальных газах - силы Ван- дер-Ваальса.
Фазовые переходы . Вещество, в зависимости от условий, в которых оно находится, может изменять агрегатное состояние, или, как говорят, переходить из одной фазы в другую. Такой переход называется фазовым переходом.
Как указывалось выше, важнейшим фактором, определяющим состояние вещества, является его температура Т , характеризующая среднюю кинетическую энергию теплового движения молекул и давление р . Поэтому, состояния вещества и фазовые переходы анализируют по диаграмме состояний, где по осям откладываются значения Т и р , а каждая точка на координатной плоскости определяет соответствующее этим параметрам состояние данного вещества. Проанализируем типичную диаграмму (рис. 5.16). Кривые ОА , АВ, АК разделяют состояния вещества. При достаточно низких температурах практически все вещества находятся в твердом кристаллическом состоянии.
 |
На диаграмме выделены две характерные точки: А и К . Точка А называется тройной точкой; при соответствующих температуре (Т т) и давлении (Р т) в ней находится в равновесии одновременно газ, жидкость и твердое тело.
Точка К обозначает критическое состояние. В этой точке (при Т кр и Р кр) исчезает разница между жидкостью и газом, т.е. последние имеют одинаковые физические свойства.
Кривая ОА является кривой сублимации (возгонки); при соответствующих давлении и температуре осуществляется переход газ - твердое тело (твердое тело - газ), минуя жидкое состояние.
При давлении Р т < Р < Р кр переход из газообразного в твердое состояние (и наоборот) может осуществляться только через жидкую фазу.
Кривая АК соответствует испарению (конденсации). При соответствующих давлении и температуре осуществляется переход «жидкость – газ» (и обратно).
Кривая АВ является кривой перехода «жидкость - твердое тело» (плавления и кристаллизации). Данная кривая не имеет конца, так как всегда жидкое состояние отличается от кристаллического по структуре.
Приведем для иллюстрации форму поверхностей состояний вещества в переменных р, V, Т (рис. 5.17), где V - объем вещества
 |
Буквами Г, Ж, Т обозначены участки поверхностей, точки которых, соответствуют газообразному, жидкому или твердому состояниям, а участки поверхностей Т-Г, Ж-Т, Т-Ж - двухфазным состояниям. Очевидно, если спроецировать линии раздела между фазами на координатную плоскость РТ, получим фазовую диаграмму (см. рис. 5.16).
Квантовая жидкость - гелий . При обычных температурах в макроскопических телах из-за выраженного хаотического теплового движения квантовые эффекты неощутимы. Однако с уменьшением температуры эти эффекты могут выходить на первый план и проявляются макроскопически. Так, например, кристаллы характерны наличием тепловых колебаний ионов, находящихся в узлах кристаллической решетки. С уменьшением температуры амплитуда колебаний уменьшается, однако даже при приближении к абсолютному нулю колебания, вопреки классическим представлениям, не прекращаются.
Объяснение этого эффекта следует из соотношения неопределенностей. Уменьшение амплитуды колебаний означает уменьшение области локализации частицы, т. е. неопределенности ее координат. В соответствии с соотношением неопределенностей это приводит к увеличению неопределенности импульса. Таким образом, «остановка» частицы запрещена законами квантовой механики.
Этот сугубо квантовый эффект проявляется в существовании вещества, остающегося в жидком состоянии даже при температурах, близких к абсолютному нулю. Такой «квантовой» жидкостью является гелий. Энергии нулевых колебаний оказывается достаточно, чтобы разрушить кристаллическую решетку. Однако при давлении порядка 2,5 МПа жидкий гелий все-таки кристаллизуется.
Плазма. Сообщение атомам (молекулам) газа извне значительной энергии приводит к ионизации, т. е. распаду атомов на ионы и на свободные электроны. Такое состояние вещества называется плазмой.
Ионизация возникает, например, при сильном нагреве газа, что приводит к значительному увеличению кинетической энергии атомов, при электрическом разряде в газе (ударная ионизация заряженными частицами), при воздействии на газ электромагнитного излучения (автоионизация). Плазма, получаемая при сверхвысоких температурах, называется высокотемпературной.
Поскольку ионы и электроны в плазме несут некомпенсированные электрические заряды, их взаимное влияние существенно. Между заряженными частицами плазмы существует не парное (как в газе), а коллективное взаимодействие. Благодаря этому плазма ведет себя как своеобразная упругая среда, в которой легко возбуждаются и распространяются различные колебания и волны
Плазма активно взаимодействует с электрическими и магнитными полями. Плазма - наиболее распространенное состояние вещества во Вселенной. Звезды состоят из высокотемпературной плазмы, холодные туманности - из низкотемпературной. Слабо ионизированная низкотемпературная плазма имеется в ионосфере Земли.
Литература к главе 5
1. Ахиезер А. И., Рекало Я. П. Элементарные частицы. - М.: Наука, 1986.
2. Азшлов А. Мир углерода. - М.: Химия, 1978.
3. Бронштейн М. П. Атомы и электроны. - М.: Наука, 1980.
4. Бениловский В. Д. Эти удивительные жидкие кристаллы. - М: Просвещение, 1987.
5. Власов Н. А. Антивещество. - М.: Атомиздат, 1966.
6. Кристи Р., Питти А. Строение вещества: введение в современную физику. - М.: Наука, 1969.
7. Крейчи В. Мир глазами современной физики. - М.: Мкр, 1984.
8. Намбу Е. Кварки. - М.: Мир, 1984.
9. Окунь Л. Б. α, β, γ, …,: элементарное введение в физику элементарных частиц. - М.: Наука, 1985.
10. Петров Ю. И. Физика малых частиц. - М.: Наука, 1982.
11. И, Пурмалъ А. П. и др. Как превращаются вещества. - М.: Наука, 1984.
12. Розенталь И. М. Элементарные частицы и структура вселенной. - М.: Наука, 1984.
13. Смородинский Я. А. Элементарные частицы. - М.: Знание, 1968.