Соединения, образованные одинаковыми атомами, называют простыми (He, O 2, O 3, H 2, S 8), а образованные разными атомами – сложными (H 2O, H 2O 2, NH 3, CCl 4, C 2H 5OH).
Атомы в молекуле удерживаются химическими связями, возникающими в результате обобществления или перераспределения внешних (валентных) электронов. Каждая обобществленная пара электронов изображается чертой, соединяющей связываемые атомы.
Ионы – заряженные одно- или многоатомные частицы, образующиеся в результате отрыва (присоединения) электрона (электронов) от атома или молекулы с образованием энергетически устойчивых электронных оболочек:
Образование поваренной соли NaCl из простых веществ сопровождается полным переходом электрона от натрия к хлору с образованием ионов Na + и Cl –. В кристаллическом NaCl нет молекул. Кристалл поваренной соли состоит из катионов Na + и анионов Cl –, которые образуют трехмерную решетку. Каждый из ионов занимает центр октаэдра, вершины которого заняты ионами противоположного знака.
Способность атома присоединять или замещать определенное число других атомов называют валентностью . Мерой валентности считают число атомов водорода или кислорода, присоединенных к элементу (ЭH n , ЭO m ), при условии, что водород одно- , а кислород двухвалентен.
Степень окисления – условный заряд атома элемента, полученный в предположении, что соединение состоит из ионов. Она может быть положительной, отрицательной, нулевой, дробной и обозначается арабской цифрой со знаком «+» или «–» в виде верхнего правого индекса символа элемента: Cl –, Cl 7+, O 2–, H +, Mg 2+, N 3–, N 5+, Cr 6+.
Для определения степени окисления (с. о.) элемента в соединении (ионе) пользуются следующими правилами:
Радикалы – частицы, образующиеся при разрыве химической связи, и (или) содержащие нескомпенсированную валентность:
Электроотрицательность (ЭО) – способность атома оттягивать на себя электрон в химическом соединении.
В основу электроотрицательности положены следущие физические обоснования (шкалы):
Шкала Полинга базируется на энергии связи при образовании сложного вещества из простых.
Шкала Малликена – ЭО пропорциональна полуразности первого потенциала ионизации и сродства к электрону ЭО ~ 0,5 ∙ (I 1 + E ср).
Шкала Олреда–Рохова основана на электростатической силе, действующей на внешний электрон
где Z эф – эффективный заряд ядра атома, e – заряд электрона; r – ковалентный радиус.
Разность электроотрицательностей элементов в соединении пропорциональна ионности связи взаимодействующих атомов; нулевая разность соответствует образованию ковалентной связи.
Эмпирическая формула составляется из атомных символов элементов, записываемых в определенном порядке друг за другом.
Молекулярная формула соответствует истинному молекулярному составу соединения: S 2Cl 2, C 6H 6, а не SCl, CH. При изменении состава молекулы в зависимости от температуры берут самую простую формулу: S, P, NO 2 вместо S 8, P 4, N 2O 4.
В структурной формуле указываются последовательность соединения атомов в молекуле (плоская структурная формула) и пространственное расположение атомов в соединении (проекционная структурная формула).
Катион в формулах солей всегда ставится на первое место: MgCl 2, KMnO 4, (NH 4) 2CO 3.
Если соль содержит более одного катиона или более одного аниона, то в формуле они записываются в алфавитном порядке их символов: KCr(SO 4) 2, PtBr 2Cl 2.
Кислоты рассматриваются как соли протона H +: HCl, H 2SO 4, H 3PO 4.
Основания – соединения, у которых анионом служит гидроксил-ион OH –: KOH, Al(OH) 3.
На рис. 1.4. приведены важнейшие классы неорганических соединений.
Моль – количество вещества, содержащее столько же частиц или структурных единиц (атомов, ионов, молекул, радикалов, электронов, эквивалентов и др.), что и в 12 а. е. м. изотопа углерода-12.
Ключевые слова конспекта: Атомно-молекулярное учение, атомы, молекулы и ионы, элементарные частицы, ядро, электрон, протон, нейтрон.
Древнегреческий философ Демокрит 2500 лет назад предположил, что все тела состоят из мельчайших, невидимых, неделимых, вечно движущихся частиц - атомов . В переводе «атом» означает «неделимый».
Учение о молекулах и атомах в основном было разработано в XVIII- XIX вв. Великий русский учёный М. В. Ломоносов утверждал, что тела в природе состоят из корпускул (молекул), в состав которых входят элементы (атомы). Многообразие веществ учёный объяснял соединением разных атомов в молекулах и различным расположением атомов в них.
Основоположником атомно-молекулярного учения принято считать известного английского учёного Джона Дальтона . Тем не менее некоторые представления об атомах и молекулах, высказанные Ломоносовым за полвека до Дальтона, оказались более достоверными, научными. Например, английский учёный отрицал возможность существования молекул, образованных одинаковыми атомами.
Получило окончательное признание только в 1860 г. на Всемирном съезде химиков в Карлсруэ.
Молекулы
Каждое отдельно взятое вещество состоит из одинаковых молекул. Например, вещество вода состоит из молекул воды. Но размеры молекул воды очень малы, поэтому даже маленькая капелька воды содержит огромное количество молекул, которые имеют одинаковые состав и свойства.
Молекулы - это мельчайшие частицы многих веществ, состав и химические свойства которых такие же, как у данного вещества. При химических реакциях молекулы распадаются, то есть они являются химически делимыми частицами. Молекулы состоят из атомов.

Атомы
Следует иметь в виду, что существуют также вещества, состоящие из отдельных одинаковых атомов. Мельчайшими частицами, сохраняющими характерные химические свойства таких веществ, являются атомы . Так, из отдельных атомов состоят благородные газы - гелий, неон, аргон и др. Атомы в отличие от молекул в ходе химических реакций не делятся на более мелкие части.
Атомы - это мельчайшие химически неделимые частицы вещества.
Элементарные частицы
В конце XIX-начале XX в. было обнаружено, что атомы состоят из ешё более мелких частиц. Эти частицы были названы элементарными частицами . В центре атома находится положительно заряженное ядро , вокруг которого находятся отрицательно заряженные частицы - электроны . Заряд электрона принято считать равным -1.
Ядро атома, в свою очередь, также состоит из элементарных частиц. В состав ядер атомов входят положительно заряженные частицы - протоны и частицы, имеющие почти такую же массу, как протоны, но не имеющие заряда,- нейтроны. Заряд протона численно равен заряду электрона , но имеет противоположный знак (+1).
Например, атом водорода состоит из ядра, в котором находится только один протон и один электрон. Атом гелия состоит из ядра, в котором находятся 2 протона и 2 нейтрона, а также 2 электрона. Атом лития состоит из ядра, в котором находятся 3 протона, 4 нейтрона, а также 3 электрона.
Ионы
Одни атомы, взаимодействуя с другими атомами, могут терять или, наоборот, приобретать один или более электронов. В результате электрически нейтральный атом превращается в заряженную частицу - ион . Если атом теряет один или несколько электронов, его называют положительно заряженным ионом. Атом, дополнительно присоединивший один или несколько электронов, называют отрицательно заряженным ионом. Противоположно заряженные ионы притягиваются друг к другу. Подробнее электронно-ионная теория рассматривается в курсе физики ()

I. Новый материал
Эта лекция будет посвящена следующим понятиям: "атом", "молекула", "вещества молекулярного и немолекулярного строения", "атомно-молекулярное учение".
Возникновение представлений об атомах и молекулах
Посмотрите презентацию:
Атомы и молекулы
Атомы и молекулы
Древнегреческий философ Демокрит 2500 лет назад высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов. Слово “атом” в переводе означает “неделимый”. Позднее, в средние века, учение об атомах преследовалось религией, которая тормозила развитие науки в целом, и химии в частности.
Учение о молекулах и атомах было разработано в середине 18 века великим русским ученым Михаилом Васильевичем Ломоносовым (1711 – 1765 гг.) Он утверждал, что тела в природе состоят из корпускл (молекул), в состав которых входят элементы (атомы). Многообразие веществ ученый прозорливо объяснял соединением разных атомов в молекулах и различным расположением атомов в них. Удивительно верной и смелой для того времени была мысль М. В. Ломоносова о том, что некоторые корпускулы (молекулы) могут состоять из одинаковых элементов (атомов). Учение об атомах получило дальнейшее развитие в трудах известного английского ученого Джона Дальтона (1766 – 1844 гг.).
МОЛЕКУЛЫ И АТОМЫ
Можно ли опытным путем доказать, что молекулы состоят из атомов?
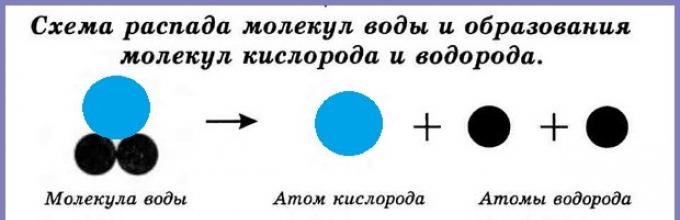
То, что атомы действительно существуют, подтверждают многие химические реакции. Так, например, при пропускании постоянного тока через воду в одной из трубок прибора собирается газ, в котором тлеющая лучинка ярко вспыхивает. Это кислород. В другой трубке собирается вдвое больше газа, который от зажженной лучинки загорается. Это водород.
Схема аппарата для разложения воды (аппарат Гофмана)
Объяснить это явление можно так. Мельчайшая частица воды – молекула состоит из 2 атомов водорода и одного атома кислорода. При пропускании постоянного тока через воду ее молекулы распадаются и образуются химически неделимые частицы – атомы кислорода и водорода. Затем атомы соединяются по два, и из двух молекул воды образуется одна – двухатомная молекула кислорода и две водорода.
Некоторые представления об атомах и молекулах, высказанные М. В. Ломоносовым за полвека до Д. Дальтона, оказались более достоверными и научными. Например, английский ученый категорически отрицал возможность существования молекул, состоящих из одинаковых атомов. Его взгляды отрицательно сказались на развитие химии.Учение о молекулах и атомах окончательно было принято только в 1860 г. на Всемирном съезде химиков в Карлеруэ.
Итак, что такое молекулы и атомы?
Молекулы – мельчайшие частицы вещества, состав которых и химические свойства такие же, как у данного вещества. Молекулы – предельный результат механического дробления вещества.
Атомы – это мельчайшие химически неделимые частицы, из которых состоят молекулы. Молекулы, в отличие от атомов, являются химически делимыми частицами.
Молекулярные вещества
Молекулярные вещества молекулы
Молекулы - наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Например: Вода - жидкость, t пл =0°С; t кип =100°С
Вода – самое известное и весьма
распространенное вещество на нашей планете: поверхность Земли на 3 / 4
покрыта водой, человек на 65 % состоит из воды, без воды невозможна жизнь, так
как в водном растворе протекают все клеточные процессы организма. Вода –
молекулярное вещество. Это одно из немногих веществ, которое в природных
условиях встречается в твердом, жидком и газообразном состояниях, и
единственное вещество, для которого в каждом из этих состояний есть свое
название.
Особенностями строения воды вызваны ее необычные свойства. Например, при
замерзании вода увеличивается в объеме, поэтому лед плавает в своем расплаве –
жидкой воде, а наибольшая плотность воды наблюдается при 4 o С,
поэтому зимой большие водоемы до дна не промерзают. На свойствах воды основана
и сама шкала температур Цельсия (0 o – температура замерзания, 100 o
– температура кипения). С причинами этих явлений и с химическими свойствами
воды вы познакомитесь позже.
Немолекулярные вещества
Немолекулярные вещества - это вещества, мельчайшими структурными частицами которых являются атомы или ионы .
Ион - это атом или группа атомов, обладающих положительным или отрицательным зарядом.
Например: Na + , Cl - .
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.
Например: Поваренная соль - твердое вещество, t пл =801°С; t кип =1465°С; Железо
Железо – серебристо-белый, блестящий, ковкий металл. Это немолекулярное вещество. Среди металлов железо занимает второе место после алюминия по распространенности в природе и первое место по значению для человечества. вместе с другим металлом – никелем – оно образует ядро нашей планеты. Чистое железо не имеет широкого практического применения. Знаменитая Кутубская колонна, расположенная в окрестностях Дели, высотой около семи метров и весом 6,5 т, имеющая возраст почти 2800 лет (она поставлена в IX в. до н. э.) – один из немногих примеров использования чистого железа (99,72 %); возможно, что именно чистотой материала и объясняется долговечность и коррозионная устойчивость этого сооружения.

В виде чугуна, стали и других сплавов железо используется буквально во всех отраслях техники. Его ценные магнитные свойства используются в генераторах электрического тока и электромоторах. Железо является жизненно необходимым элементом для человека и животных, так как оно входит в состав гемоглобина крови. При его недостатке клетки тканей получают недостаточно кислорода, что ведет к очень тяжелым последствиям.
Атомно-молекулярное учение
Атомно-молекулярное
учение развил и впервые применил в химии великий русский ученый Ломоносов.
Сущность учения Ломоносова можно свести к следующим положениям.
1. Все вещества состоят из «корпускул» (так Ломоносов называл молекулы).
2. Молекулы состоят из «элементов» (так Ломоносов называл атомы).
3. Частицы - молекулы и атомы - находятся в непрерывном движении. Тепловое состояние тел есть результат движения их частиц.
4. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ - из различных атомов.
Атомистическое учение в химии применил английский ученый Джон Дальтон. В своей основе учение Дальтона повторяет учение Ломоносова. Вместе с тем оно развивает его дальше, поскольку Дальтон впервые пытался установить атомные массы известных тогда элементов. Однако Дальтон отрицал существование молекул у простых веществ, что по сравнению с учением Ломоносова является шагом назад. По Дальтону, простые вещества состоят только из атомов, и лишь сложные вещества - из «сложных атомов» (в современном понимании - молекул). Отрицание Дальтоном существования молекул простых веществ мешало дальнейшему развитию химии. Атомно-молекулярное учение в химии окончательно утвердилось лишь в- середине XIX в.Молекула - это наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются ее составом и химическим строением. Атом - наименьшая частица химического элемента, входящая в состав молекул простых и сложных веществ. Химические свойства элемента определяются строением его атома. Отсюда следует определение атома, соответствующее современным представлениям: атом - это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Согласно современным представлениям из молекул состоят вещества в газообразном и парообразном состоянии. В твердом состоянии из молекул состоят лишь вещества, кристаллическая решетка которых имеет молекулярную структуру.
Основные положения атомно-молекулярного учения можно сформулировать так:
- Существуют вещества с молекулярным и немолекулярным строением.
- Между молекулами имеются промежутки, размеры которых зависят от агрегатного состояния вещества и температуры. Наибольшие расстояния имеются между молекулами газов. Этим объясняется их легкая сжимаемость. Труднее сжимаются жидкости, где промежутки между молекулами значительно меньше. В твердых веществах промежутки между молекулами еще меньше, поэтому они почти не сжимаются.
- Молекулы находятся в непрерывном движении. Скорость движения молекул зависит от температуры. С повышением температуры скорость движения молекул возрастает.
- Между молекулами существуют силы взаимного притяжения и отталкивания. В наибольшей степени эти силы выражены в твердых веществах, в наименьшей - в газах.
- Молекулы состоят из атомов, которые, как и молекулы, находятся в непрерывном движении.
- Атомы одного вида отличаются от атомов другого вида массой и свойствами.
- При физических явлениях молекулы сохраняются, при химических, как правило, разрушаются.
- У веществ с молекулярным строением в твердом состоянии в узлах кристаллических решето находятся молекулы. Связи между молекулами, расположенными в узлах кристаллической решетки, слабые и при нагревании разрываются. Поэтому вещества с молекулярным строением, как правило, имеют низкие температуры плавления.
- У веществ с немолекулярным строением в узлах кристаллических решеток находятся атомы или другие частицы. Между этими частицами существуют сильные химические связи, для разрушения которых требуется много энергии. Поэтому вещества с немолекулярным строением имеют высокие температуры плавления.
Объяснение
физических и химических явлений с точки зрения атомно-молекулярного учения.
Физические и химические явления получают объяснение с позиций
атомно-молекулярного учения. Так, например, процесс диффузии объясняется
способность молекул (атомов, частиц) одного вещества проникать между молекулами
(атомами, частицами) другого вещества. Это происходит потому, что молекулы
(атомы, частицы) находятся в непрерывном движении и между ними имеются
промежутки. Сущность химических реакций заключается в разрушении химических
связей между атомами одних веществ и в перегруппировке атомов с образованием
других веществ.
II. Закрепление
Дайте ответы на следующие вопросы:
- Назовите имя древнегреческого философа, который высказал мысль о том, что все тела в природе состоят из мельчайших невидимых, непроницаемых, неделимых, вечно движущихся частиц – атомов.
- Назовите имя великого русского учёного, основоположника учения о молекулах и атомах.
- Дайте определение молекуле.
- Дайте определение атому.
- Какие вещества относят к веществам молекулярного строения? Приведите примеры веществ.
- Какие вещества относят к веществам немолекулярного строения? Приведите примеры веществ.
- Какими свойствами характеризуются веществамолекулярного строения?
- Какими свойствами характеризуются веществанемолекулярного строения?
- Как объяснить физические и химические явления с точки зрения атомно-молекулярного учения?
2 вариант
1.Схема электронного строения атома наименее активного металла это
1) 2е, 8е, 1е
2) 2е, 8е, 3е
3) 2е, 8е, 18е, 28е, 3е
4) 2е, 8е,18е, 3е
2.Все металлы обладают высокой
1) пластичностью
2) хрупкостью
3) способностью возгоняться
4)растворимостью в воде
3.В узлах кристаллической решетки металла находятся
1) молекулы
2) атомы
3) ионы
4) ионы-атомы
4.Самым распространённым в земной коре металлом является
1) железо
2) хром
3) никель
4) серебро
5.Число электронов, участвующих в реакции восстановления оксида железа(III) оксидом углерода(II), равно
1) 2
2) 4
3) 6
4) 8
6.Оба вещества могут быть использованы для получения металлов из руд
1) CO и Al
2) Al и Cu
3) Al и CO2
4) CO2 и O2
7.Какое суждение верно:
А. Все металлы обладают высокой тепло- и электропроводностью.
Б. Меньшая химических элементов, известных на сегодняшний день, относится к металлам.
1) верно только А
2) верно только Б
3) оба верны
4) оба неверны
Часть Б
1.Металлы, которые могут существовать в земной коре только в виде соединений - это...(выбранные номера запишите в порядке возрастания)
1) золото
2) натрий
3) алюминий
4) серебро
5) кальций
2. Вычислите содержание железа(% по массе) в образце Fe2O3, содержащем 14,28% примесей. Ответ запишите в виде целого числа.
1.Галогенирование-это процесс взаимодействия ________________ 2.Этилен при обычных условиях находится в ________ агрегатном состоянии.3.Количество атомов Гидрогена в молекуле равняется ___________
4.Гидрогалогенирование-это процесс взаимодействия с __________
5.Процесс присоединения водорода называется ______________
6.В молекуле этилена типом химической связи между атомами является ___________
элементов химическая связь будет иметь ионный характер:1)N и O; 2) Si и Cl; 3) Na и O; 4) P и Br3.Только ковалентная связь наблюдается в соединении с формулой: 1) Ba(OH)2, 2) H2SO4, 3) Li2CO3, 4) NH4NO34.Неполярная ковалентная связь наблюдается в веществе: 1) углекислом газе, 2) аммиаке, 3) алмазе, 4) воде.5.В молекуле какого вещества содержится ковалентная неполярная связь: 1) воде, 2) поваренной соли, 3) водороде, 4) магнии6.В каком веществе наблюдается металлическая связь: 1) мышьяк, 2) галлий, 3) фосфор, 4) йод7.В узлах металлической кристаллической решетки находятся: 1) атомы металла, 2) ионы металла, 3) атомы и ионы металла, 4) верного ответа нет8. Ковалентной неполярной связью характеризуется пара веществ: 1) водород и графит, 2) кислород и алюминий, 3) хлор и аргон, 4) азот и аммиак.9.Какая связь наблюдается в молекуле аммиака: 1) ковалентная неполярная, 2) ковалентная полярная, 3) ионная, 4) металлическая10.Только ионные связи имеют место в веществе: 1) пероксид натрия, 2) гашеная известь, 3) медный купорос, 4) поваренная соль11.Выберите вещества, имеющие только ионную связь: 1) хлорид натрия, 2) сульфат бария, 3) йодид кальция, 4) углекислый газ, 5) фторид калия12.Выберите вещества, имеющие только ковалентную полярную связь: 1) вода, 2) кислород, 3) фтор, 4) углекислый газ, 5) этанол
2) атомы каких элементов могут принимать электроны, превращаясь в отрицательно заряженные ионы: а) Са б) Na в) F г) Br
3) вещества с ионной связью а) SO3 б) КCL в) BaCL2 г) NH3
4) вещества с полярной ковалентной связью а) P2O5 б) СsF в) BaF2 г) H2S
5) вещества с ионной кристаллической решёткой а) KF б) СsCL в) HJ г) CL2
6) вещества с молекулярной кристаллической решёткой а) HF б) Н2 в) LiF г) BaCL2
7) наибольшая температура плавления у а) LiF б) HJ в) J2 г) HCL
8) наибольшая температура плавления у а) KF б) HBr в) Br2 г) Н2О
9) степень окисления углерода +4 имеется в соединении а) Na2CO3 б) CH4 в) CO2 г) SiC
10) в каком соединении степень окилсения углерода -4 а) CO2 б) CCL4 в) СН4 г) H2CO3
11) какой процесс является окислением а) S-2 (сера с двумя отрицательными зарядами)-->S+4 б) Mg0-->Mg+2 в) S+6-->S+4 г) S+4-->S0
12) какой процесс является восстановлением а) N0-->N-3 б) N-1--> N0 в) N-3-->N+2 Г) N+5-->N+2
13)коэффициент перед формулой окислителя в уравнении реакции AL+CuCl2-->ALCL3+Cu а) 1 б) 2 в) 3 г) 6
14) коэффициент перед формулой окислителя в уравнении реакции NO2+O2-->NO2 а) 1 б) 2 в) 3 г) 6
15) выберите правильные утверждения а) наиболее сильными металлическими свойствами обладают те элементы, атомы которых легко отдают электроны
б) ионная связь возникает в результате образования электронных пар
в) ионы - нейтральные частицы в которые прекращаются атомы в результате отдачи или присоединения электронов
г) в соединениях Н2, HF, Н2О ковалентная связь
д) стекло - твёрдое кристаллическое вещество
е) атомы или ионы которые в реакциях присоединяют электроны называются восстановителями
ж) в реакции 4Li+O2-->2Li2O, Li - восстановитель, О- окислитель
з) в соединениях сумма степеней окисления элементов равна 0
На этом уроке вы сможете узнать что-то новое о мельчайших частичках, из которых состоят вещества.
Больше уроков на сайте
Некоторые представления об атомах и молекулах, высказанные М. В. Ломоносовым за полвека до Д. Дальтона, оказались более достоверными и научными. Например, английский ученый категорически отрицал возможность существования молекул, состоящих из одинаковых атомов. Его взгляды отрицательно сказались на развитие химии.Учение о молекулах и атомах окончательно было принято только в 1860 г. на Всемирном съезде химиков в Карлеруэ.
Итак, что такое молекулы и атомы?
Молекулы – мельчайшие частицы вещества, состав которых и химические свойства такие же, как у данного вещества. Молекулы – предельный результат механического дробления вещества.
Атомы – это мельчайшие химически неделимые частицы, из которых состоят молекулы. Молекулы, в отличие от атомов, являются химически делимыми частицами.
Молекулярные вещества
Молекулярные вещества молекулы
Молекулы — наименьшая частица молекулярного вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Молекулярные вещества имеют низкие температуры плавления и кипения и находятся в стандартных условиях в твердом, жидком или газообразном состоянии.
Например: Вода — жидкость, t пл =0°С; t кип =100°С
Вода – самое известное и весьма распространенное вещество на нашей планете: поверхность Земли на 3 / 4 покрыта водой, человек на 65 % состоит из воды, без воды невозможна жизнь, так как в водном растворе протекают все клеточные процессы организма. Вода – молекулярное вещество. Это одно из немногих веществ, которое в природных условиях встречается в твердом, жидком и газообразном состояниях, и единственное вещество, для которого в каждом из этих состояний есть свое название.
Особенностями строения воды вызваны ее необычные свойства. Например, при замерзании вода увеличивается в объеме, поэтому лед плавает в своем расплаве – жидкой воде, а наибольшая плотность воды наблюдается при 4 o С, поэтому зимой большие водоемы до дна не промерзают. На свойствах воды основана и сама шкала температур Цельсия (0 o – температура замерзания, 100 o – температура кипения). С причинами этих явлений и с химическими свойствами воды вы познакомитесь позже.
Немолекулярные вещества
Немолекулярные вещества — это вещества, мельчайшими структурными частицами которых являются атомы или ионы .
Ион — это атом или группа атомов, обладающих положительным или отрицательным зарядом.
Например: Na + , Cl — .
Немолекулярные вещества находятся в стандартных условиях в твердом агрегатном состоянии и имеют высокие температуры плавления и кипения.