Теоретический блок.
Определение понятия «смесь» было дано в XVII в. английским ученым Робертом Бойлем : «Смесь – целостная система, состоящая из разнородных компонентов».
Сравнительная характеристика смеси и чистого вещества
Признаки сравнения | Чистое вещество | Смесь |
Постоянный | Непостоянный |
|
Вещества | Одно и то же | Различные |
Физические свойства | Постоянные | Непостоянные |
Изменение энергии при образовании | Происходит | Не происходит |
Разделение | С помощью химических реакций | Физическими методами |
Смеси отличаются друг от друга по внешнему виду.
Классификация смесей показана в таблице:
Приведём примеры суспензий (речной песок + вода), эмульсий (растительное масло + вода) и растворов (воздух в колбе, поваренная соль + вода, разменная монета: алюминий + медь или никель + медь).
Способы разделения смесей
В природе вещества существуют в виде смесей. Для лабораторных исследований, промышленных производств, для нужд фармакологии и медицины нужны чистые вещества.
Для очистки веществ применяются различные способы разделения смесей
Выпаривание - выделение растворенных в жидкости твердых веществ способом ее превращения в пар.

Дистилляция- перегонка, разделение содержащихся в жидких смесях веществ по температурам кипения с последующим охлаждением пара.
В природе вода в чистом виде (без солей) не встречается. Океаническая, морская, речная, колодезная и родниковая вода – это разновидности растворов солей в воде. Однако часто людям необходима чистая вода, не содержащая солей (используется в двигателях автомобилей; в химическом производстве для получения различных растворов и веществ; при изготовлении фотографий). Такую воду называют дистиллированной, а способ ее получения – дистилляцией.

Фильтрование- процеживание жидкостей (газов) через фильтр с целью их очистки от твердых примесей.

Эти способы основаны на различиях в физических свойствах компонентов смеси.
Рассмотрим способы разделения гетерогенных и гомогенных смесей .
Пример смеси | Способ разделения |
Суспензия – смесь речного песка с водой | Отстаивание Разделение отстаиванием основано на различных плотностях веществ. Более тяжелый песок оседает на дно. Так же можно разделить и эмульсию: отделить нефть или растительное масло от воды. В лаборатории это можно сделать с помощью делительной воронки. Нефть или растительное масло образует верхний, более легкий слой. В результате отстаивания выпадает роса из тумана, осаждается сажа из дыма, отстаиваются сливки в молоке. Разделение смеси воды и растительного масла отстаиванием |
Смесь песка и поваренной соли в воде | Фильтрование На чем основано разделение гетерогенных смесей с помощью фильтрования ?На различной растворимости веществ в воде и на различных размерах частиц. Через поры фильтра проходят лишь соизмеримые с ними частицы веществ, в то время как более крупные частицы задерживаются на фильтре. Так можно разделить гетерогенную смесь поваренной соли и речного песка. В качестве фильтров можно использовать различные пористые вещества: вату, уголь, обожженную глину, прессованное стекло и другие. Способ фильтрования – это основа работы бытовой техники , например пылесосов. Его используют хирурги – марлевые повязки; буровики и рабочие элеваторов – респираторные маски. С помощью чайного ситечка для фильтрования чаинок Остапу Бендеру – герою произведения Ильфа и Петрова – удалось забрать один из стульев у Эллочки Людоедки («Двенадцать стульев»). Разделение смеси крахмала и воды фильтрованием |
Смесь порошка железа и серы | Действие магнитом или водой Порошок железа притягивался магнитом, а порошок серы – нет. Несмачивающийся порошок серы всплывал на поверхность воды, а тяжелый смачивающийся порошок железа оседал на дно. Разделение смеси серы и железа с помощью магнита и воды
|
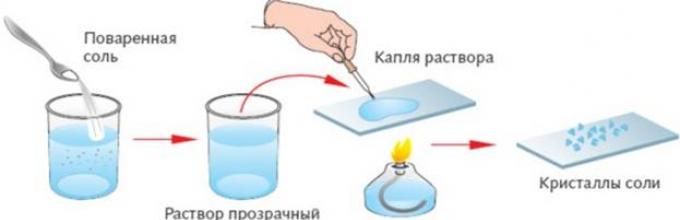
Раствор соли в воде – гомогенная смесь | Выпаривание или кристаллизация Вода испаряется, а в фарфоровой чашке остаются кристаллы соли. При выпаривании воды из озер Эльтон и Баскунчак получают поваренную соль. Этот способ разделения основан на различии в температурах кипения растворителя и растворенного вещества. Если вещество, например сахар, разлагается при нагревании, то воду испаряют неполностью – упаривают раствор, а затем из насыщенного раствора осаждают кристаллы сахара. Иногда требуется очистить от примесей растворители с меньшей температурой кипения, например воду от соли. В этом случае пары вещества необходимо собрать и затем сконденсировать при охлаждении. Такой способ разделения гомогенной смеси называется дистилляцией, или перегонкой . В специальных приборах – дистилляторах получают дистиллированную воду, которую используют для нужд фармакологии, лабораторий, систем охлаждения автомобилей. В домашних условиях можно сконструировать такой дистиллятор: Если же разделять смесь спирта и воды, то первым будет отгоняться (собираться в пробирке-приемнике) спирт с tкип = 78 °С, а в пробирке останется вода. Перегонка используется для получения бензина, керосина, газойля из нефти. Разделение однородных смесей |
Особым методом разделения компонентов, основанным на различной поглощаемости их определенным веществом, является хроматография .
С помощью хроматографии русский ботаник впервые выделил хлорофилл из зеленых частей растений. В промышленности и лабораториях вместо фильтровальной бумаги для хроматографии используют крахмал, уголь, известняк, оксид алюминия. А всегда ли требуются вещества с одинаковой степенью очистки?
Для различных целей необходимы вещества с различной степенью очистки. Воду для приготовления пищи достаточно отстоять для удаления примесей и хлора, используемого для ее обеззараживания. Воду для питья нужно предварительно прокипятить. А в химических лабораториях для приготовления растворов и проведения опытов, в медицине необходима дистиллированная вода, максимально очищенная от растворенных в ней веществ. Особо чистые вещества, содержание примесей в которых не превышает одной миллионной процента, применяются в электронике, в полупроводниковой, ядерной технике и других точных отраслях промышленности.
Способы выражения состава смесей.
· Массовая доля компонента в смеси - отношение массы компонента к массе всей смеси. Обычно массовую долю выражают в %, но не обязательно.
ω [«омега»] = mкомпонента / mсмеси
· Мольная доля компонента в смеси - отношение числа моль (количества вещества) компонента к суммарному числу моль всех веществ в смеси. Например, если в смесь входят вещества А, В и С, то:
χ [«хи»] компонента А = nкомпонента А / (n(A) + n(B) + n(С))
· Мольное соотношение компонентов. Иногда в задачах для смеси указывается мольное соотношение её составляющих. Например:
nкомпонента А: nкомпонента В = 2: 3
· Объёмная доля компонента в смеси (только для газов) - отношение объёма вещества А к общему объёму всей газовой смеси.
φ [«фи»] = Vкомпонента / Vсмеси
Практический блок.
Рассмотрим три примера задач, в которых смеси металлов реагируют с соляной кислотой:
Пример 1. При действии на смесь меди и железа массой 20 г избытком соляной кислоты выделилось 5,6 л газа (н. у.). Определить массовые доли металлов в смеси.
В первом примере медь не реагирует с соляной кислотой, то есть водород выделяется при реакции кислоты с железом. Таким образом, зная объём водорода, мы сразу сможем найти количество и массу железа. И, соответственно, массовые доли веществ в смеси.
Решение примера 1.
n = V / Vm = 5,6 / 22,4 = 0,25 моль.
2. По уравнению реакции:
3. Количество железа тоже 0,25 моль. Можно найти его массу:
mFe = 0,25 56 = 14 г.
Ответ: 70% железа, 30% меди.
Пример 2. При действии на смесь алюминия и железа массой 11 г избытком соляной кислоты выделилось 8,96 л газа (н. у.). Определить массовые доли металлов в смеси.
Во втором примере в реакцию вступают оба металла. Здесь уже водород из кислоты выделяется в обеих реакциях. Поэтому прямым расчётом здесь нельзя воспользоваться. В таких случаях удобно решать с помощью очень простой системы уравнений, приняв за х - число моль одного из металлов, а за у - количество вещества второго.
Решение примера 2.
1. Находим количество водорода:
n = V / Vm = 8,96 / 22,4 = 0,4 моль.
2. Пусть количество алюминия - х моль, а железа у моль. Тогда можно выразить через х и у количество выделившегося водорода:
2HCl = FeCl2 + |
4. Нам известно общее количество водорода: 0,4 моль. Значит,
1,5х + у = 0,4 (это первое уравнение в системе).
5. Для смеси металлов нужно выразить массы
через количества веществ.
m = M n
Значит, масса алюминия
mAl = 27x,
масса железа
mFe = 56у,
а масса всей смеси
27х + 56у = 11 (это второе уравнение в системе).
6. Итак, мы имеем систему из двух уравнений:
7. Решать такие системы гораздо удобнее методом вычитания, домножив первое уравнение на 18:
27х + 18у = 7,2
и вычитая первое уравнение из второго:
8. (56 − 18)у = 11 − 7,2
у = 3,8 / 38 = 0,1 моль (Fe)
х = 0,2 моль (Al)
mFe = n M = 0,1 56 = 5,6 г
mAl = 0,2 27 = 5,4 г
ωFe = mFe / mсмеси = 5,6 / 11 = 0,50,91%),
соответственно,
ωAl = 100% − 50,91% = 49,09%
Ответ: 50,91% железа, 49,09% алюминия.
Пример 3. 16 г смеси цинка, алюминия и меди обработали избытком раствора соляной кислоты. При этом выделилось 5,6 л газа (н. у.) и не растворилось 5 г вещества. Определить массовые доли металлов в смеси.
В третьем примере два металла реагируют, а третий металл (медь) не вступает в реакцию. Поэтому остаток 5 г - это масса меди. Количества остальных двух металлов - цинка и алюминия (учтите, что их общая масса 16 − 5 = 11 г) можно найти с помощью системы уравнений, как в примере №2.
Ответ к Примеру 3: 56,25% цинка, 12,5% алюминия, 31,25% меди.
Пример 4. На смесь железа, алюминия и меди подействовали избытком холодной концентрированной серной кислоты. При этом часть смеси растворилась, и выделилось 5,6 л газа (н. у.). Оставшуюся смесь обработали избытком раствора едкого натра. Выделилось 3,36 л газа и осталось 3 г не растворившегося остатка. Определить массу и состав исходной смеси металлов.
В этом примере надо помнить, что холодная концентрированная
серная кислота не реагирует с железом и алюминием (пассивация), но реагирует с медью. При этом выделяется оксид серы (IV).
Со щелочью
реагирует только алюминий
- амфотерный металл (кроме алюминия, в щелочах растворяются ещё цинк и олово, в горячей концентрированной щелочи - ещё можно растворить бериллий).
Решение примера 4.
1. С концентрированной серной кислотой реагирует только медь, число моль газа:
nSO2 = V / Vm = 5,6 / 22,4 = 0,25 моль
2H2SO4 (конц.) = CuSO4 + |
2. (не забудьте, что такие реакции надо обязательно уравнивать с помощью электронного баланса)
3. Так как мольное соотношение меди и сернистого газа 1:1, то меди тоже 0,25 моль. Можно найти массу меди:
mCu = n M = 0,25 64 = 16 г.
4. В реакцию с раствором щелочи вступает алюминий, при этом образуется гидроксокомплекс алюминия и водород:
2Al + 2NaOH + 6H2O = 2Na + 3H2
Al0 − 3e = Al3+ | ||
5. Число моль водорода:
nH2 = 3,36 / 22,4 = 0,15 моль,
мольное соотношение алюминия и водорода 2:3 и, следовательно,
nAl = 0,15 / 1,5 = 0,1 моль.
Масса алюминия:
mAl = n M = 0,1 27= 2,7 г
6. Остаток - это железо, массой 3 г. Можно найти массу смеси:
mсмеси = 16 + 2,7 + 3 = 21,7 г.
7. Массовые доли металлов:
ωCu = mCu / mсмеси = 16 / 21,7 = 0,7,73%)
ωAl = 2,7 / 21,7 = 0,1,44%)
ωFe = 13,83%
Ответ: 73,73% меди, 12,44% алюминия, 13,83% железа.
Пример 5. 21,1 г смеси цинка и алюминия растворили в 565 мл раствора азотной кислоты, содержащего 20 мас. % НNО3 и имеющего плотность 1,115 г/мл. Объем выделившегося газа, являющегося простым веществом и единственным продуктом восстановления азотной кислоты, составил 2,912 л (н. у.). Определите состав полученного раствора в массовых процентах. (РХТУ)
В тексте этой задачи чётко указан продукт восстановления азота - «простое вещество». Так как азотная кислота с металлами не даёт водорода, то это - азот. Оба металла растворились в кислоте.
В задаче спрашивается не состав исходной смеси металлов, а состав получившегося после реакций раствора. Это делает задачу более сложной.
Решение примера 5.
1. Определяем количество вещества газа:
nN2 = V / Vm = 2,912 / 22,4 = 0,13 моль.
2. Определяем массу раствора азотной кислоты, массу и количество вещества растворенной HNO3:
mраствора = ρ V = 1,115 565 = 630,3 г
mHNO3 = ω mраствора = 0,2 630,3 = 126,06 г
nHNO3 = m / M = 126,06 / 63 = 2 моль
Обратите внимание, что так как металлы полностью растворились, значит - кислоты точно хватило (с водой эти металлы не реагируют). Соответственно, надо будет проверить, не оказалась ли кислота в избытке , и сколько ее осталось после реакции в полученном растворе.
3. Составляем уравнения реакций (не забудьте про электронный баланс ) и, для удобства расчетов, принимаем за 5х - количество цинка, а за 10у - количество алюминия. Тогда, в соответствии с коэффициентами в уравнениях, азота в первой реакции получится х моль, а во второй - 3у моль:
12HNO3 = 5Zn(NO3)2 + |
Zn0 − 2e = Zn2+ | ||
36HNO3 = 10Al(NO3)3 + |
Al0 − 3e = Al3+ | ||
5. Тогда, учитывая, что масса смеси металлов 21,1 г, их молярные массы - 65 г/моль у цинка и 27 г/моль у алюминия, получим следующую систему уравнений:
6. Решать эту систему удобно, домножив первое уравнение на 90 и вычитая первое уравнение их второго.
7. х = 0,04, значит, nZn = 0,04 5 = 0,2 моль
у = 0,03, значит, nAl = 0,03 10 = 0,3 моль
8. Проверим массу смеси:
0,2 65 + 0,3 27 = 21,1 г.
9. Теперь переходим к составу раствора. Удобно будет переписать реакции ещё раз и записать над реакциями количества всех прореагировавших и образовавшихся веществ (кроме воды):
10. Следующий вопрос: осталась ли в растворе азотная кислота и сколько её осталось?
По уравнениям реакций, количество кислоты, вступившей в реакцию:
nHNO3 = 0,48 + 1,08 = 1,56 моль,
т. е. кислота была в избытке и можно вычислить её остаток в растворе:
nHNO3ост. = 2 − 1,56 = 0,44 моль.
11. Итак, в итоговом растворе содержатся:
нитрат цинка в количестве 0,2 моль:
mZn(NO3)2 = n M = 0,2 189 = 37,8 г
нитрат алюминия в количестве 0,3 моль:
mAl(NO3)3 = n M = 0,3 213 = 63,9 г
избыток азотной кислоты в количестве 0,44 моль:
mHNO3ост. = n M = 0,44 63 = 27,72 г
12. Какова масса итогового раствора?
Вспомним, что масса итогового раствора складывается из тех компонентов, которые мы смешивали (растворы и вещества) минус те продукты реакции, которые ушли из раствора (осадки и газы):
13.
Тогда для нашей задачи:
14. mнов. раствора = масса раствора кислоты + масса сплава металлов - масса азота
mN2 = n M = 28 (0,03 + 0,09) = 3,36 г
mнов. раствора = 630,3 + 21,1 − 3,36 = 648,04 г
ωZn(NO3)2 = mв-ва / mр-ра = 37,8 / 648,04 = 0,0583
ωAl(NO3)3 = mв-ва / mр-ра = 63,9 / 648,04 = 0,0986
ωHNO3ост. = mв-ва / mр-ра = 27,72 / 648,04 = 0,0428
Ответ: 5,83% нитрата цинка, 9,86% нитрата алюминия, 4,28% азотной кислоты.
Пример 6. При обработке 17,4 г смеси меди, железа и алюминия избытком концентрированной азотной кислоты выделилось 4,48 л газа (н. у.), а при действии на эту смесь такой же массы избытка хлороводородной кислоты - 8,96 л газа (н. у.). Определите состав исходной смеси. (РХТУ)
При решении этой задачи надо вспомнить, во-первых, что концентрированная азотная кислота с неактивным металлом (медь) даёт NO2, а железо и алюминий с ней не реагируют. Соляная кислота, напротив, не реагирует с медью.
Ответ к примеру 6: 36,8% меди, 32,2% железа, 31% алюминия.
Задачи для самостоятельного решения.
1. Несложные задачи с двумя компонентами смеси.
1-1. Смесь меди и алюминия массой 20 г обработали 96 %-ным раствором азотной кислоты, при этом выделилось 8,96 л газа (н. у.). Определить массовую долю алюминия в смеси.
1-2. Смесь меди и цинка массой 10 г обработали концентрированным раствором щелочи. При этом выделилось 2,24 л газа (н. y.). Вычислите массовую долю цинка в исходной смеси.
1-3. Смесь магния и оксида магния массой 6,4 г обработали достаточным количеством разбавленной серной кислоты. При этом выделилось 2,24 л газа (н. у.). Найти массовую долю магния в смеси.
1-4. Смесь цинка и оксида цинка массой 3,08 г растворили в разбавленной серной кислоте. Получили сульфат цинка массой 6,44 г. Вычислите массовую долю цинка в исходной смеси.
1-5. При действии смеси порошков железа и цинка массой 9,3 г на избыток раствора хлорида меди (II) образовалось 9,6 г меди. Определите состав исходной смеси.
1-6. Какая масса 20%-ного раствора соляной кислоты потребуется для полного растворения 20 г смеси цинка с оксидом цинка, если при этом выделился водород объемом 4,48 л (н. у.)?
1-7. При растворении в разбавленной азотной кислоте 3,04 г смеси железа и меди выделяется оксид азота (II) объемом 0,896 л (н. у.). Определите состав исходной смеси.
1-8. При растворении 1,11 г смеси железных и алюминиевых опилок в 16%-ном растворе соляной кислоты (ρ = 1,09 г/мл) выделилось 0,672 л водорода (н. у.). Найдите массовые доли металлов в смеси и определите объем израсходованной соляной кислоты.
2. Задачи более сложные.
2-1. Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздуха с избытком порошка графита. Продукт реакции обработали разбавленной соляной кислотой, при этом выделилось 11,2 л газа (н. у.). Определите массовые доли металлов в смеси.
2-2. Для растворения 1,26 г сплава магния с алюминием использовано 35 мл 19,6%-ного раствора серной кислоты (ρ = 1,1 г/мл). Избыток кислоты вступил в реакцию с 28,6 мл раствора гидрокарбоната калия с концентрацией 1,4 моль/л. Определите массовые доли металлов в сплаве и объем газа (н. у.), выделившегося при растворения сплава.