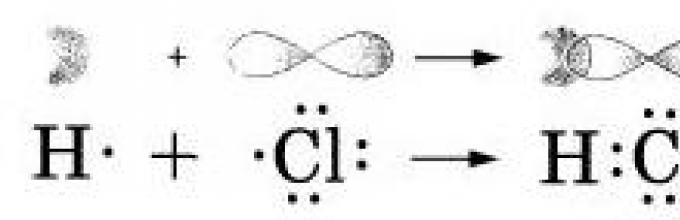При изучении ионной и ковалентной полярной химической связи вы знакомились со сложными веществами, состоящими из двух химических элементов. Такие вещества называют би парными (от лат. би — «два») или двухэлементными.
Вспомним типичные бпнарные соединения, которые мы привели в качестве примера для рассмотрения механизмов образования ионной и ковалентноЙ полярной химической связи : NaHl — хлорид натрия и НСl — хлороводород. В первом случае связь ионная: атом натрия передал свой внешний электрон атому хлора и превратился при этом в ион с зарядом -1. а атом хлора принял электрон и превратился в ион с зарядом -1. Схематически процесс превращения атомов в ионы можно изобразить так:
В молекуле же НСl связь образуется за счет спаривания не-спаренных внешних электронов и образования общей электронной пары атомов водорода и хлора.
Правильнее представлять образование ковалентной связи в молекуле хлороводорода как перекрывание одноэлектронного s-облака атома водорода с одноэлектронным p-облаком атома хлора:

При химическом взаимодействии общая электронная пара смещена в сторону более электроотрицательного атома хлора:

Такие условные заряды называются степенью окисления . При определении этого понятия условно предполагают, что в ковалентных полярных соединениях связующие электроны полностью перешли к более электроотрицательному атому, а потому соединения состоят только из положительно и отрицательно заряженных ионов.
— это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентно-полярные) состоят только из ионов.
Степень окисления может иметь отрицательное, положительное или нулевое значения, которые обычно ставятся над символом элемента сверху, например:![]()
Отрицательное значение степени окисления имеют те атомы, которые приняли электроны от других атомов пли к которым смещены общие электронные пары, то есть атомы более электроотрицательных элементов. Фтор всегда имеет степень окисления -1 во всех соединениях. Кислород , второй после фтора по значению элекгроотрицательности элемент, почти всегда имеет степень окисления -2, кроме соединений со фтором, например:
![]()
Положительное значение степени окисления имеют те атомы, которые отдают свои электроны другим атомам или от которых оттянуты общие электронные пары, то есть атомы менее электроотрицательных элементов. Металлы всегда имеют положительную степень окисления. У металлов главных подгрупп:
I группы во всех соединениях степень окисления равна +1,
II группы равна +2. III группы — +3, например:

В соединениях суммарная степень окисления всегда равна нулю. Зная это и степень окисления одного из элементов, всегда можно найти степень окисления другого элемента по формуле бинарного соединения. Например, найдем степень окисления хлора в соединении Сl2О2. Обозначим степень окисления -2
кислорода: Сl2О2. Следовательно, семь атомов кислорода будут иметь общий отрицательный заряд (-2) 7 =14. Тогда общий заряд двух атомов хлора будет равен +14, а одного атома хлора:
(+14):2 = +7.
Аналогично, зная степени окисления элементов, можно составить формулу соединения, например карбида алюминия (соединения алюминия и углерода). Запишем знаки алюминия н углерода рядом АlС, причем сначала знак алюминия, так как это металл. Определим по таблице элементов Менделеева число внешних электронов: у Аl — 3 электрона, у С — 4. Атом алюминия отдаст свои 3 внешних электрона углероду и получит при этом степень окисления +3, равную заряду иона. Атом углерода, наоборот, примет недостающие до "заветной восьмерки" 4 электрона и получит при этом степень окисления -4.
Запишем эти значения в формулу: АlС, и найдем наименьшее общее кратное для них, оно равно 12. Затем рассчитаем индексы:
![]()
Знать степени окисления элементов необходимо и для того, чтобы уметь правильно называть химическое соединение.
Названия бинарных соединений состоят из двух слов — названий образующих их химических элементов. Первое слово обозначает электроотрицательную часть соединения — неметалл, его латинское название с суффиксом -ид стоит всегда в именительном падеже. Второе слово обозначает электроположительную часть — металл или менее электроотрицательный элемент, его название всегда стоит в родительном падеже. Если же электроположительный элемент проявляет разные степени окисления, то это отражают в названии, обозначив степень окисления римской цифрой, которая ставится в конце.

Чтобы химики разных стран понимали друг друга, потребовалось создание единой терминологии и номенклатуры веществ. Принципы химической номенклатуры были впервые разработаны французскими химиками А. Лавуазье, А.Фурктуа, Л.Гитоном и К.Бертолле в 1785г. В настоящее время Международный союз теоретической и прикладной химии (ИЮПАК) координирует деятельность ученых рядных стран и издает рекомендации по номенклятурс веществ и терминологии, используемой к химии.
Как определить степень окисления? Таблица Менделеева позволяет записывать данную количественную величину для любого химического элемента.
Определение
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.
Связь с таблицей
Как определяется степень окисления? Таблица Менделеева состоит из восьми групп, расположенных вертикально. В каждой из них есть две подгруппы: главная и побочная. Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.

Инструкция
Как рассчитать степени окисления элементов? Таблица позволяет в полной мере справиться с подобной проблемой. Щелочные металлы, которые располагаются в первой группе (главной подгруппе), степень окисления проявляют в соединениях, она соответствует +, равна их высшей валентности. У металлов второй группы (подгруппы А) +2 степень окисления.
Таблица позволяет определить данную величину не только у элементов, проявляющих металлические свойства, но и у неметаллов. Их максимальная величина будет соответствовать высшей валентности. Например, для серы она составит +6, для азота +5. Как вычисляется у них минимальная (низшая) цифра? Таблица отвечает и на этот вопрос. Необходимо вычесть номер группы из восьми. Например, у кислорода она составит -2, у азота -3.
Для простых веществ, которые не вступали в химическое взаимодействие с другими веществами, определяемый показатель считается равным нулю.
Попробуем выявить основные действия, касающиеся расстановки в бинарных соединениях. Как поставить в них степень окисления? Таблица Менделеева помогает решить проблему.
Для примера возьмем оксид кальция СаО. Для кальция, расположенного в главной подгруппе второй группы, величина будет являться постоянной, равной +2. У кислорода, имеющего неметаллические свойства, данный показатель будет являться отрицательной величиной, и он соответствует -2. Для того чтобы проверить правильность определения, суммируем полученные цифры. В итоге мы получим ноль, следовательно, вычисления верны.
Определим подобные показатели еще в одном бинарном соединении CuO. Так как медь располагается в побочной подгруппе (первой группе), следовательно, изучаемый показатель может проявлять разные значения. Поэтому для его определения необходимо сначала выявить показатель для кислорода.
У неметалла, располагающегося в конце бинарной формулы, степень окисления имеет отрицательное значение. Так как этот элемент располагается в шестой группе, при вычитании из восьми шести получаем, что степень окисления у кислорода соответствует -2. Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Как еще используется химическая таблица? Степени окисления элементов в формулах, состоящих из трех элементов, также вычисляются по определенному алгоритму. Сначала расставляют эти показатели у первого и последнего элемента. Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.

Пример определения в серной кислоте
Формула данного соединения имеет вид H 2 SO 4 . У водорода степень окисления составит +1, у кислорода она равна -2. Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.

Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
Для характеристики окислительно-восстановительной способности частиц важное значение имеет такое понятие, как степень окисления. СТЕПЕНЬ ОКИСЛЕНИЯ – это заряд, который мог бы возникнуть у атома в молекуле или ионе, если бы все его связи с другими атомами оказались разорваны, а общие электронные пары ушли с более электроотрицательными элементами.
В отличие от
реально существующих зарядов у ионов,
степень окисления показывает лишь
условный заряд атома в молекуле. Она
может быть отрицательной, положительной
и нулевой. Например, степень окисления
атомов в простых веществах равна «0»
(, ,
, ,
, ).
В химических соединениях атомы могут
иметь постоянную степень окисления или
переменную. У металлов главных подгруппI,
II
и III
групп Периодической системы в химических
соединениях степень окисления, как
правило, постоянна и равна соответственно
Ме +1 ,
Ме +2
и Ме +3
(Li + ,
Ca +2 ,
Al +3).
У атома фтора всегда -1. У хлора в
соединениях с металлами всегда -1. В
подавляющем числе соединений кислород
имеет степень окисления -2 (кроме
пероксидов, где его степень окисления
-1), а водород +1(кроме гидридов металлов,
где его степень окисления -1).
).
В химических соединениях атомы могут
иметь постоянную степень окисления или
переменную. У металлов главных подгруппI,
II
и III
групп Периодической системы в химических
соединениях степень окисления, как
правило, постоянна и равна соответственно
Ме +1 ,
Ме +2
и Ме +3
(Li + ,
Ca +2 ,
Al +3).
У атома фтора всегда -1. У хлора в
соединениях с металлами всегда -1. В
подавляющем числе соединений кислород
имеет степень окисления -2 (кроме
пероксидов, где его степень окисления
-1), а водород +1(кроме гидридов металлов,
где его степень окисления -1).
Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона. Эта взаимосвязь позволяет рассчитывать степени окисления атомов в сложных соединениях.
В молекуле серной
кислоты H 2 SO 4
атом водорода имеет степень окисления
+1, а атом кислорода -2. Так как атомов
водорода два, а атомов кислорода четыре,
то мы имеем два «+» и восемь «-». До
нейтральности не хватает шесть «+».
Именно это число и является степенью
окисления серы -
 .
Молекула дихромата калияK 2 Cr 2 O 7
состоит из двух атомов калия, двух атомов
хрома и семи атомов кислорода. У калия
степень окисления всегда +1, у кислорода
-2. Значит, мы имеем два «+» и четырнадцать
«-». Оставшиеся двенадцать «+» приходятся
на два атома хрома, у каждого из которых
степень окисления равна +6 (
.
Молекула дихромата калияK 2 Cr 2 O 7
состоит из двух атомов калия, двух атомов
хрома и семи атомов кислорода. У калия
степень окисления всегда +1, у кислорода
-2. Значит, мы имеем два «+» и четырнадцать
«-». Оставшиеся двенадцать «+» приходятся
на два атома хрома, у каждого из которых
степень окисления равна +6 ( ).
).
Типичные окислители и восстановители
Из определения процессов восстановления и окисления следует, что, в принципе, в роли окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей степени окисления и поэтому могут понижать свою степень окисления. Аналогично в роли восстановителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в высшей степени окисления и поэтому могут повышать свою степень окисления.
К наиболее сильным окислителям относятся:
1) простые вещества, образуемые атомами, имеющими большую электроотрицательность, т.е. типичные неметаллы, расположенные в главных подгруппах шестой и седьмой групп периодической системы: F, O, Cl, S (соответственно F 2 , O 2 , Cl 2 , S);
2) вещества, содержащие элементы в высших и промежуточных
положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fe 3+), так и кислородосодержащих, оксоанионов (перманганат-ион - MnO 4 -);
3) перекисные соединения.
Конкретными
веществами, применяемыми на практике
в качестве окислителей, являются кислород
и озон, хлор, бром, перманганаты, дихроматы,
кислородные кислоты хлора и их соли
(например,
 ,
, ,
, ),
азотная кислота (
),
азотная кислота ( ),
концентрированная серная кислота
(
),
концентрированная серная кислота
( ),
диоксид марганца (
),
диоксид марганца ( ),
пероксид водорода и пероксиды металлов
(
),
пероксид водорода и пероксиды металлов
( ,
, ).
).
К наиболее сильным восстановителям относятся:
1)простые вещества, атомы которых имеют низкую электроотрицательность («активные металлы»);
2) катионы металлов в низжих степенях окисления (Fe 2+);
3) простые элементарные анионы, например, сульфид-ион S 2- ;
4) кислородосодержащие
анионы (оксоанионы), соответствующие
низшим положительным степеням окисления
элемента (нитрит
 ,
сульфит
,
сульфит ).
).
Конкретными
веществами, применяемыми на практике
в качестве восстановителей, являются,
например, щелочные и щелочноземельные
металлы, сульфиды, сульфиты, галогенводороды
(кроме HF),
органические вещества – спирты,
альдегиды, формальдегид, глюкоза,
щавелевая кислота, а также водород,
углерод, моноксид углерода ( )
и алюминий при высоких температурах.
)
и алюминий при высоких температурах.
В принципе, если в состав вещества входит элемент в промежуточной степени окисления, то эти вещества могут проявлять как окислительные, так и восстановительные свойства. Все зависит от
«партнера» по реакции: с достаточно сильным окислителем оно может реагировать как восстановитель, а с достаточно сильным восстановителем – как окислитель. Так, например, нитрит-ион NO 2 - в кислой среде выступает в роли окислителя по отношению к иону I - :
2 +
2
+
2 + 4HCl→
+ 4HCl→
 +
2
+
2 + 4KCl
+ 2H 2 O
+ 4KCl
+ 2H 2 O
и в роли восстановителя по отношению к перманганат-иону MnO 4 -
5 +
2
+
2 + 3H 2 SO 4
→ 2
+ 3H 2 SO 4
→ 2 +
5
+
5 +K 2 SO 4
+ 3H 2 O
+K 2 SO 4
+ 3H 2 O