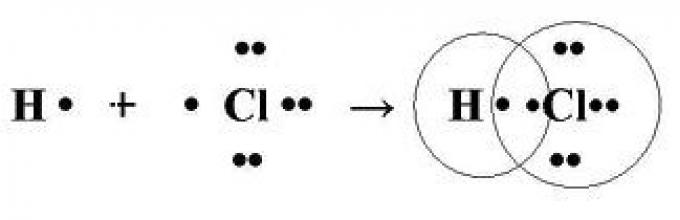И двухэлектронную трёхцентровую связь .
С учётом статистической интерпретации волновой функции М. Борна плотность вероятности нахождения связывающих электронов концентрируется в пространстве между ядрами молекулы (рис.1). В теории отталкивания электронных пар рассматриваются геометрические размеры этих пар. Так, для элементов каждого периода существует некоторый средний радиус электронной пары (Å):
0,6 для элементов вплоть до неона; 0,75 для элементов вплоть до аргона; 0,75 для элементов вплоть до криптона и 0,8 для элементов вплоть до ксенона .
Характерные свойства ковалентной связи
Характерные свойства ковалентной связи - направленность, насыщаемость, полярность, поляризуемость - определяют химические и физические свойства соединений.
- Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы.
Углы между двумя связями называют валентными.
- Насыщаемость - способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
- Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов.
По этому признаку ковалентные связи подразделяются на неполярные и полярные (неполярные - двухатомная молекула состоит из одинаковых атомов (H 2 , Cl 2 , N 2) и электронные облака каждого атома распределяются симметрично относительно этих атомов; полярные - двухатомная молекула состоит из атомов разных химических элементов, и общее электронное облако смещается в сторону одного из атомов, образуя тем самым асимметрию распределения электрического заряда в молекуле, порождая дипольный момент молекулы).
- Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реагирующей частицы. Поляризуемость определяется подвижностью электронов . Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Однако, дважды лауреат Нобелевской премии Л. Полинг указывал, что «в некоторых молекулах имеются ковалентные связи, обусловленные одним или тремя электронами вместо общей пары» . Одноэлектронная химическая связь реализуется в молекулярном ионе водорода H 2 + .
Молекулярный ион водорода H 2 + содержит два протона и один электрон. Единственный электрон молекулярной системы компенсирует электростатическое отталкивание двух протонов и удерживает их на расстоянии 1,06 Å (длина химической связи H 2 +). Центр электронной плотности электронного облака молекулярной системы равноудалён от обоих протонов на боровский радиус α 0 =0,53 А и является центром симметрии молекулярного иона водорода H 2 + .
История термина
Термин "ковалентная связь" был впервые введён лауреатом Нобелевской премии Ирвингом Ленгмюром в 1919 году . Этот термин относился к химической связи , обусловленной совместным обладанием электронами , в отличие от металлической связи , в которой электроны были свободными, или от ионной связи , в которой один из атомов отдавал электрон и становился катионом , а другой атом принимал электрон и становился анионом .
Образование связи
Ковалентная связь образуется парой электронов, поделённой между двумя атомами, причём эти электроны должны занимать две устойчивые орбитали, по одной от каждого атома .
A· + ·В → А: В
В результате обобществления электроны образуют заполненный энергетический уровень. Связь образуется, если их суммарная энергия на этом уровне будет меньше, чем в первоначальном состоянии (а разница в энергии будет ни чем иным, как энергией связи).
Согласно теории молекулярных орбиталей, перекрывание двух атомных орбиталей приводит в простейшем случае к образованию двух молекулярных орбиталей (МО): связывающей МО и антисвязывающей (разрыхляющей) МО . Обобществлённые электроны располагаются на более низкой по энергии связывающей МО.
Образование связи при рекомбинации атомов
Однако, механизм межатомного взаимодействия долгое время оставался неизвестным. Лишь в 1930 г. Ф. Лондон ввёл понятие дисперсионное притяжение - взаимодействие между мгновенным и наведённым (индуцированными) диполями. В настоящее время силы притяжения, обусловленные взаимодействием между флуктуирующими электрическими диполями атомов и молекул носят название «Лондоновские силы ».
Энергия такого взаимодействия прямо пропорциональна квадрату электронной поляризуемости α и обратно пропорциональна расстоянию между двумя атомами или молекулами в шестой степени .
Образование связи по донорно-акцепторному механизму
Кроме изложенного в предыдущем разделе гомогенного механизма образования ковалентной связи, существует гетерогенный механизм - взаимодействие разноименно заряженных ионов - протона H + и отрицательного иона водорода H - , называемого гидрид-ионом :
H + + H - → H 2
При сближении ионов двухэлектронное облако (электронная пара) гидрид-иона притягивается к протону и в конечном счёте становится общим для обоих ядер водорода, то есть превращается в связывающую электронную пару. Частица, поставляющая электронную пару, называется донором, а частица, принимающая эту электронную пару, называется акцептором. Такой механизм образования ковалентной связи называется донорно-акцепторным .
H + + H 2 O → H 3 O +
Протон атакует неподелённую электронную пару молекулы воды и образует устойчивый катион, существующий в водных растворах кислот .
Аналогично происходит присоединение протона к молекуле аммиака с образованием комплексного катиона аммония :
NH 3 + H + → NH 4 +
Таким путём (по донорно-акцепторному механизму образования ковалентной связи) получают большой класс ониевых соединений , в состав которого входят аммониевые , оксониевые, фосфониевые, сульфониевые и другие соединения .
В качестве донора электронной пары может выступать молекула водорода, которая при контакте с протоном приводит к образованию молекулярного иона водорода H 3 + :
H 2 + H + → H 3 +
Связывающая электронная пара молекулярного иона водорода H 3 + принадлежит одновременно трём протонам.
Виды ковалентной связи
Существуют три вида ковалентной химической связи, отличающихся механизмом образования:
1. Простая ковалентная связь . Для её образования каждый из атомов предоставляет по одному неспаренному электрону. При образовании простой ковалентной связи формальные заряды атомов остаются неизменными.
- Если атомы, образующие простую ковалентную связь, одинаковы, то истинные заряды атомов в молекуле также одинаковы, поскольку атомы, образующие связь, в равной степени владеют обобществлённой электронной парой. Такая связь называется неполярной ковалентной связью . Такую связь имеют простые вещества , например: 2 , 2 , 2 . Но не только неметаллы одного типа могут образовывать ковалентную неполярную связь. Ковалентную неполярную связь могут образовывать также элементы-неметаллы, электроотрицательность которых имеет равное значение, например, в молекуле PH 3 связь является ковалентной неполярной, так как ЭО водорода равна ЭО фосфора.
- Если атомы различны, то степень владения обобществлённой парой электронов определяется различием в электроотрицательностях атомов. Атом с большей электроотрицательностью сильнее притягивает к себе пару электронов связи, и его истинный заряд становится отрицательным. Атом с меньшей электроотрицательностью приобретает, соответственно, такой же по величине положительный заряд. Если соединение образуется между двумя различными неметаллами , то такое соединение называется ковалентной полярной связью .
В молекуле этилена С 2 Н 4 имеется двойная связь СН 2 =СН 2 , его электронная формула: Н:С::С:Н. Ядра всех атомов этилена расположены в одной плоскости. Три электронных облака каждого атома углерода образуют три ковалентные связи с другими атомами в одной плоскости (с углами между ними примерно 120°). Облако четвёртого валентного электрона атома углерода располагается над и под плоскостью молекулы. Такие электронные облака обоих атомов углерода, частично перекрываясь выше и ниже плоскости молекулы, образуют вторую связь между атомами углерода. Первую, более прочную ковалентную связь между атомами углерода называют σ-связью; вторую, менее прочную ковалентную связь называют π {\displaystyle \pi } -связью.
Ковалентная химическая связь возникает между атомами с близкими или равными значениями электроотрицательностей. Предположим, что хлор и водород стремятся отнять электроны и принять структуру ближайшего благородного газа, значит ни один из них не отдаст электрон другому. Каким же способом они все таки соединяются? Все просто – они поделятся друг с другом, образуется общая электронная пара.

Теперь рассмотрим отличительные черты ковалентной связи.
В отличие от ионных соединений, молекулы ковалентных соединений удерживаются вместе за счет «межмолекулярных сил», которые намного слабее химических связей. В связи с этим, ковалентной связи характерна насыщаемость – образование ограниченного числа связей.
Известно, что атомные орбитали ориентированы в пространстве определенным образом, поэтому при образовании связи, перекрывание электронных облаков происходит в определенном направлении. Т.е. реализуется такое свойство ковалентной связи как направленность.
Если ковалентная связь в молекуле образована одинаковыми атомами или атомами с равной электроотрицательностью, то такая связь не имеет полярности, т.е электронная плотность распределяется симметрично. Называется она неполярной ковалентной связью (H 2 , Cl 2 , O 2 ). Связи могут быть как одинарными, так и двойными, тройными.
Если электроотрицательности атомов различаются, то при их соединении электронная плотность распределяется между атомами неравномерно и образуется ковалентная полярная связь (HCl, H 2 O, CO), кратность которой также может быть различной. При образовании данного типа связи, более электроотрицательный атом приобретает частичный отрицательный заряд, а атом с меньшей электроотрицательностью – частичный положительный заряд (δ- и δ+). Образуется электрический диполь, в котором заряды, противоположные по знаку, расположены на неком расстоянии друг от друга. В качестве меры полярности связи используют дипольный момент:

Полярность соединения тем более выражена, чем больше дипольный момент. Молекулы будут иметь неполярный характер, если дипольный момент равен нулю.
В связи с вышеперечисленными особенностями, можно заключить, что ковалентные соединения летучи, имеют низкие температуры плавления и кипения. Электрический ток не может проходить через эти соединения, следовательно, они плохие проводники и хорошие изоляторы. При подводе тепла, многие соединения с ковалентной связью, загораются. В большей части это углеводороды, а также оксиды, сульфиды, галогениды неметаллов и переходных металлов.
Категории ,Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Внутримолекулярные химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными .
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов , в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ . Именно она определяет тип химической связи между атомами и свойства этой связи.
– это способность атома притягивать (удерживать) внешние (валентные) электроны . Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4 .
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В) , то общая электронная пара не смещается ни к одному из атомов: А: В . Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2 ), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная .
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2 ), то один из электронов практически полностью переходит к другому атому, с образованием ионов . Такая связь называется ионная .
Основные типы химических связей — ковалентная , ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – этохимическая связь, образованная за счет образования общей электронной пары А:В . При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами ) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность ,
- насыщаемость ,
- полярность ,
- поляризуемость .
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45 о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 108 о 28′.

Насыщаемость — это спосбность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется .
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.

Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ .
Пример . Рассмотрим строение молекулы водорода H 2 . Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Люьиса неплохо помогают при работе с элементами второго периода.
H . + . H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной .

Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Примеры : H 2 (H-H), O 2 (O=O), S 8 .
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами ) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент . Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO 2 , NH 3 .
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А . + . В= А:В
2. образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В

При этом один из атомов предоставляет неподеленную электронную пару (донор ), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор ). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей .
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH 4 + , в ионах органических аминов , например, в ионе метиламмония CH 3 -NH 2 + ;
– в комплексных соединениях , химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO 3 , NaNO 3 , в некоторых других соединениях азота;

– в молекуле озона O 3 .
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении . Кратность связи достаточно легко можно определить из значения атомов, образующих молекулу.
Например , в молекуле водорода H 2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O 2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N 2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи
– это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А 2 и В 2:
Длину химической связи можно примерно оценить по радиусам атомов , образующих связь, или по кратности связи , если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например . В ряду: C–C, C=C, C≡C длина связи уменьшается.
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например , в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается , т.к. увеличивается длина связи.
Ионная химическая связь

Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов .
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.

Пример . Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na + , с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na ) 2 ) 8 ) 1 — 1e = +11Na +) 2 ) 8
Пример . Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl ) 2 ) 8 ) 7 + 1e = +17Cl — ) 2 ) 8 ) 8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы , но и группы атомов . Например: ион аммония NH 4 + , сульфат-ион SO 4 2- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na + Cl — , Na 2 + SO 4 2- .
Наглядно обобщим различие между ковалентными и ионным типами связи :


Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов , образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов . Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями .
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы . Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь , т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе , создавая таким образом достаточно прочную металлическую кристаллическую решетку . При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.

Межмолекулярные взаимо-действия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия . Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляеются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами . Силы Ван-дер-Ваальса делятся на ориентационные , индукционные и дисперсионные . Энергия межмолекулярных взаимодейстий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N . Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения .
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость .
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь . Она характерна прежде всего для соединений фтора с водородом , а также кислорода с водородом , в меньшей степени азота с водородом .

Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H 2 O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H : спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например , как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H 2 O-H 2 S-H 2 Se-H 2 Te мы не наблюдаем линейное изменение температур кипения.

А именно, у воды температура кипения аномально высокая — не меньше -61 о С, как показывает нам прямая линия, а намного больше, +100 о С. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20 о С) вода является жидкостью по фазовому состоянию.
Ковалентная связь — самый распространенный тип химической связи, осуществляемой при взаимодействии с одинаковыми или близкими значениями электроотрицательности.
Ковалентная связь — это связь атомов с помощью общих электронных пар.
После открытия электрона проводилось много попыток разработать электронную теорию химической связи. Наиболее удачными стали работы Льюиса (1916 г.), который предложил рассматривать образование связи как следствие возникновения общих для двух атомов электронных пар. Для этого каждый атом предоставляет одинаковое количество электронов и пытается окружить себя октетом или дублетом электронов, характерным для внешней электронной конфигурации инертных газов. Графически образования ковалентных связей за счет неспаренных электронов по методу Льюиса изображают с помощью точек, обозначающих внешние электроны атома.
Образование ковалентной связи согласно теории Льюиса
Механизм образования ковалентной связи
Основным признаком ковалентной связи является наличие общей электронной пары, принадлежащей обоим химически соединенным атомам, поскольку пребывание двух электронов в поле действия двух ядер энергетически выгоднее, чем нахождение каждого электрона в поле своего ядра. Возникновение общей электронной пары связи может проходить по разным механизмам, чаще — по обменному, а иногда — по донорно-акцепторных.
по принципу обменного механизма образования ковалентной связи каждый из взаимодействующих атомов поставляет на образование связи одинаковое количество электронов с антипараллельными спинами. К примеру:
 Общая схема образования ковалентной связи: а) по обменному механизму; б) по донорно-акцепторному механизму
Общая схема образования ковалентной связи: а) по обменному механизму; б) по донорно-акцепторному механизму
по донорно-акцепторному механизму двухэлектронная связь возникает при взаимодействии различных частиц. Одна из них — донор А: имеет неразделенную пару электронов (то есть такую, что принадлежит только одному атому), а другая — акцептор В — имеет вакантную орбиталь.
Частица, которая предоставляет для связи двухэлектронное (неразделенную пару электронов), называется донором, а частица со свободной орбиталью, которая принимает эту электронную пару, — акцептором.
Механизм образования ковалентной связи за счет двухэлектронного облака одного атома и вакантной орбитали другого называется донорно-акцепторным механизмом.
Донорно-акцепторный связь иначе называется семиполярной, поскольку на атоме-доноре возникает частичный эффективный положительный заряд δ+ (за счет того, что его неразделенная пара электронов отклонилась от него), а на атоме-акцепторе — частичный эффективный отрицательный заряд δ- (благодаря тому, что происходит смещение в его сторону неразделенной электронной пары донора).
В качестве примера простого донора электронной пары можно привести ион Н — , который имеет неразделенную электронную пару. В результате присоединения негативного гидрид-иона к молекуле, центральный атом которой имеет свободную орбиталь (на схеме обозначена как пустая квантовая ячейка), например ВН 3 , образуется сложный комплексный ион ВН 4 — с отрицательным зарядом (Н — + ВН 3 ⟶⟶ [ВН 4 ] —) :

Акцептор электронной пары — ион водорода, или просто протон Н + . Его присоединение к молекуле, центральный атом которой имеет неразделенную электронную пару, например к NH 3 , тоже приводит к образованию комплексного иона NH 4 + , но уже с положительным зарядом:

Метод валентных связей
Первая квантово-механическая теория ковалентной связи была создана Гейтлером и Лондоном (в 1927 г.) для описания молекулы водорода, а затем была применена Полингом к многоатомным молекулам. Эта теория называется методом валентных связей , основные положения которого кратко можно изложить так:
- каждая пара атомов в молекуле содержится вместе с помощью одной или нескольких общих электронных пар, при этом электронные орбитали взаимодействующих атомов перекрываются;
- прочность связи зависит от степени перекрывания электронных орбиталей;
- условием образования ковалентной связи является антинаправленность спинов электронов; благодаря этому возникает обобщенная электронная орбиталь с наибольшей электронной плотностью в межъядерном пространстве, которая обеспечивает притяжение положительно заряженных ядер друг к другу и сопровождается уменьшением общей энергии системы.
Гибридизация атомных орбиталей
Несмотря на то, что в образовании ковалентных связей участвуют электроны s-, p- или d-орбиталей, имеющие различные форму и различную ориентацию в пространстве, во многих соединениях эти связи оказываются равноценными. Для объяснения этого явления было введено понятие «гибридизация».
Гибридизация — это процесс смешивания и выравнивания орбиталей по форме и энергии, при котором происходит перераспределение электронных плотностей близких по энергии орбиталей, в результате чего они становятся равноценными.
Основные положения теории гибридизации:
- При гибридизации начальная форма и орбиталей взаимно меняются, при этом образуются новые, гибридизованные орбитали, но уже с одинаковой энергией и одинаковой формы, напоминающей неправильную восьмерку.
- Число гибридизованных орбиталей равно числу выходных орбиталей, участвующих в гибридизации.
- В гибридизации могут участвовать орбитали с близкими по значениям энергиями (s- и p-орбитали внешнего энергетического уровня и d-орбитали внешнего или предварительного уровней).
- Гибридизованные орбитали более вытянуты в направлении образования химических связей и поэтому обеспечивают лучшее перекрытие с орбиталями соседнего атома, вследствие этого становится более прочным, чем образованный за счет электронов отдельных негибридных орбиталей.
- Благодаря образованию более прочных связей и более симметричном распределения электронной плотности в молекуле получается энергетический выигрыш, который с запасом компенсирует расход энергии, необходимой для процесса гибридизации.
- Гибридизованные орбитали должны ориентироваться в пространстве таким образом, чтобы обеспечить взаимное максимальное отдаление друг от друга; в этом случае энергия отталкивания наименьшая.
- Тип гибридизации определяется типом и количеством выходных орбиталей и меняет размер валентного угла, а также пространственную конфигурацию молекул.
 Форма гибридизованных орбиталей и валентных углы (геометрические углы между осями симметрии орбиталей) в зависимости от типа гибридизации: а) sp-гибридизация; б) sp 2 -гибридизация; в) sp 3 -гибридизация
Форма гибридизованных орбиталей и валентных углы (геометрические углы между осями симметрии орбиталей) в зависимости от типа гибридизации: а) sp-гибридизация; б) sp 2 -гибридизация; в) sp 3 -гибридизация
При образовании молекул (или отдельных фрагментов молекул) чаще всего встречаются такие типы гибридизации:
 Общая схема sp-гибридизации
Общая схема sp-гибридизации
Связи, которые образуются с участием электронов sp-гибридизованнных орбиталей, также размещаются под углом 180 0 , что приводит к линейной форме молекулы. Такой тип гибридизации наблюдается в галогенидах элементов второй группы (Be, Zn, Cd, Hg), атомы которых в валентном состоянии имеют неспаренные s- и р-электроны. Линейная форма характерна и для молекул других элементов (0=C=0,HC≡CH), в которых связи образуются sp-гибридизованными атомами.
 Схема sp 2 -гибридизации атомных орбиталей и плоская треугольная форма молекулы, которая обусловлена sp 2 -гибридизацией атомных орбиталей
Схема sp 2 -гибридизации атомных орбиталей и плоская треугольная форма молекулы, которая обусловлена sp 2 -гибридизацией атомных орбиталей
Этот тип гибридизации наиболее характерен для молекул р-элементов третьей группы, атомы которых в возбужденном состоянии имеют внешнюю электронную структуру ns 1 np 2 , где n — номер периода, в котором находится элемент. Так, в молекулах ВF 3 , BCl 3 , AlF 3 и в других связи образованы за счет sp 2 -гибридизованных орбиталей центрального атома.
 Схема sp 3 -гибридизации атомных орбиталей
Схема sp 3 -гибридизации атомных орбиталей
Размещение гибридизованных орбиталей центрального атома под углом 109 0 28` вызывает тетраэдрическую форму молекул. Это очень характерно для насыщенных соединений четырехвалентного углерода СН 4 , СCl 4 , C 2 H 6 и других алканов. Примерами соединений других элементов с тетраэдрической строением вследствие sp 3 -гибридизации валентных орбиталей центрального атома является ионы: BН 4 — , BF 4 — , PO 4 3- , SO 4 2- , FeCl 4 — .
 Общая схема sp 3d -гибридизации
Общая схема sp 3d -гибридизации
Этот тип гибридизации чаще всего встречается в галогенидах неметаллов. В качестве примера можно привести строение хлорида фосфора PCl 5 , при образовании которого атом фосфора (P … 3s 2 3p 3) сначала переходит в возбужденное состояние (P … 3s 1 3p 3 3d 1), а затем подвергается s 1 p 3 d- гибридизации — пять одноэлектронных орбиталей становятся равноценными и ориентируются вытянутыми концами к углам мысленной тригональной бипирамиды. Это и определяет форму молекулы PCl 5 , которая образуется при перекрытии пяти s 1 p 3 d- гибридизованных орбиталей с 3р-орбиталями пяти атомов хлора.
- sp — Гибридизация. При комбинации одной s- i одной р-орбиталей возникают две sp-гибридизованные орбитали, расположенные симметрично под углом 180 0 .
- sp 2 — Гибридизация. Комбинация одной s- и двух р-орбиталей приводит к образованию sp 2 -гибридизованных связей, расположенных под углом 120 0 , поэтому молекула приобретает форму правильного треугольника.
- sp 3 — Гибридизация. Комбинация четырех орбиталей — одной s- и трех р приводит к sp 3 — гибридизации, при которой четыре гибридизованные орбитали симметрично ориентированы в пространстве к четырем вершинам тетраэдра, то есть под углом 109 0 28 `.
- sp 3 d — Гибридизация. Комбинация одной s-, трех р- и одной d- орбиталей дает sp 3 d- гибридизацию, что определяет пространственную ориентацию пяти sp 3 d-гибридизованных орбиталей к вершинам тригональной бипирамиды.
- Другие типы гибридизации. В случае sp 3 d 2 -гибридизации шесть sp 3 d 2 -гибридизованных орбиталей направлены к вершинам октаэдра. Ориентация семи орбиталей к вершинам пентагональной бипирамиды соответствует sp 3 d 3 -гибридизации (или иногда sp 3 d 2 f) валентных орбиталей центрального атома молекулы или комплекса.
Метод гибридизации атомных орбиталей объясняет геометрическую структуру большого количества молекул, однако согласно опытным данным чаще наблюдаются молекулы с несколько другими значениями валентных углов. Например, в молекулах СН 4 , NH 3 и Н 2 О центральные атомы находятся в sp 3 -гибридизованном состоянии, поэтому можно было бы ожидать, что валентные углы в них равны тетраэдрическим (~ 109,5 0). Экспериментально установлено, что валентный угол в молекуле СН 4 на самом деле составляет 109,5 0 . Однако в молекулах NH 3 и Н 2 O значение валентного угла отклоняется от тетраэдрического: он равен 107,3 0 в молекуле NH 3 и 104,5 0 в молекуле Н 2 О. Такие отклонения объясняется наличием неразделенной электронной пары у атомов азота и кислорода. Двухэлектронная орбиталь, которая содержит неразделенную пару электронов, благодаря повышенной плотности отталкивает одноэлектронные валентные орбитали, что приводит к уменьшению валентного угла. У атома азота в молекуле NH 3 из четырех sp 3 -гибридизованных орбиталей три одноэлектронные орбитали образуют связи с тремя атомами Н, а на четвертой орбитали содержится неразделенная пара электронов.
Несвязанная электронная пара, которая занимает одну из sp 3 -гибридизованных орбиталей, направленных к вершинам тетраэдра, отталкивая одноэлектронные орбитали, вызывает асимметричное распределение электронной плотности, окружающей атом азота, и как следствие сжимает валентный угол до 107,3 0 . Аналогичная картина уменьшения валентного угла от 109,5 0 до 107 0 в результате воздействия неразделенной электронной пары атома N наблюдается и в молекуле NCl 3 .
 Отклонение валентного угла от тетраэдрического (109,5 0) в молекуле: а) NН3 ; б) NCl3
Отклонение валентного угла от тетраэдрического (109,5 0) в молекуле: а) NН3 ; б) NCl3
У атома кислорода в молекуле Н 2 О на четыре sp 3 -гибридизованные орбитали приходится по две одноэлектронные и две двухэлектронные орбитали. Одноэлектронные гибридизованные орбитали участвуют в образовании двух связей с двумя атомами Н, а две двухэлектронные пары остаются неразделенными, то есть принадлежащими только атому H. Это увеличивает асимметричность распределения электронной плотности вокруг атома О и уменьшает валентный угол по сравнению с тетраэдрическим до 104.5 0 .
Следовательно, число несвязанных электронных пар центрального атома и их размещения на гибридизованных орбиталях влияет на геометрическую конфигурацию молекул.
Характеристики ковалентной связи
Ковалентная связь имеет набор определенных свойств, которые определяют ее специфические особенности, или характеристики. К ним, кроме уже рассмотренных характеристик «энергия связи» и «длина связи», относятся: валентный угол, насыщенность, направленность, полярность и тому подобное.
1. Валентный угол — это угол между соседними осями связей (то есть условными линиями, проведенными через ядра химически соединенных атомов в молекуле). Величина валентного угла зависит от природы орбиталей, типа гибридизации центрального атома, влияния неразделенных электронных пар, которые не участвуют в образовании связей.
2. Насыщенность . Атомы имеют возможности для образования ковалентных связей, которые могут формироваться, во-первых, по обменному механизму за счет неспаренных электронов невозбуждённого атома и за счет тех неспаренных электронов, которые возникают в результате его возбуждения, а во-вторых, по донорно акцепторному механизму. Однако общее количество связей, которые может образовывать атом, ограничено.
Насыщенность — это способность атома элемента образовывать с другими атомами определенное, ограниченное количество ковалентных связей.
Так, второго периода, которые имеют на внешнем энергетическом уровне четыре орбитали (одну s- и три р-), образуют связи, число которых не превышает четырех. Атомы элементов других периодов с большим числом орбиталей на внешнем уровне могут формировать больше связей.
3. Направленность . В соответствии с методом, химическая связь между атомами обусловлена перекрытием орбиталей, которые, за исключением s-орбиталей, имеют определенную ориентацию в пространстве, что и приводит к направленности ковалентной связи.
Направленность ковалентной связи — это такое размещение электронной плотности между атомами, которое определяется пространственной ориентацией валентных орбиталей и обеспечивает их максимальное перекрытие.
Поскольку электронные орбитали имеют различные формы и различную ориентацию в пространстве, то их взаимное перекрытие может реализоваться различными способами. В зависимости от этого различают σ-, π- и δ- связи.
Сигма-связь (σ-связь) — это такое перекрытие электронных орбиталей, при котором максимальная электронная плотность концентрируется вдоль воображаемой линии, соединяющей два ядра.
Сигма-связь может образовываться за счет двух s-электронов, одного s- и одного р электрона, двух р-электронов или двух d-электронов. Такая σ-связь характеризуется наличием одной области перекрытия электронных орбиталей, она всегда одинарная, то есть образуется только одной электронной парой.

Разнообразие форм пространственной ориентации «чистых» орбиталей и гибридизованных орбиталей не всегда допускают возможность перекрывания орбиталей на оси связи. Перекрывания валентных орбиталей может происходить по обе стороны от оси связи — так называемое «боковое» перекрывания, которое чаще всего осуществляется при образовании π-связей.
Пи-связь (π-связь) — это перекрытие электронных орбиталей, при котором максимальная электронная плотность концентрируется по обе стороны от линии, соединяющей ядра атомов (т.е. от оси связи).
Пи-связь может образоваться при взаимодействии двух параллельных р-орбиталей, двух d-орбиталей или других комбинаций орбиталей, оси которых не совпадают с осью связи.
 Схемы образования π-связей между условными А и В атомами при боковом перекрытии электронных орбиталей
Схемы образования π-связей между условными А и В атомами при боковом перекрытии электронных орбиталей
4. Кратность. Эта характеристика определяется числом общих электронных пар, связывающих атомы. Ковалентная связь по кратности может быть одинарной (простой), двойной и тройной. Связь между двумя атомами с помощью одной общей электронной пары называется одинарной связью (простой), двух электронных пар — двойной связью, трех электронных пар — тройной связью. Так, в молекуле водорода Н 2 атомы соединены одинарной связью (Н-Н), в молекуле кислорода О 2 — двойным (В = О), в молекуле азота N 2 — тройным (N≡N). Особое значение кратность связей приобретает в органических соединениях — углеводородах и их производных: в этане С 2 Н 6 между атомами С осуществляется одинарная связь (С-С), в этилене С 2 Н 4 — двойная (С = С) в ацетилене С 2 Н 2 — тройная (C ≡ C)(C≡C).
Кратность связи влияет на энергию: с повышением кратности растет ее прочность. Повышение кратности приводит к уменьшению межъядерного расстояния (длины связи) и увеличению энергии связи.
 Кратность связи между атомами углерода: а) одинарная σ-связь в этане Н3С-СН3 ; б) двойная σ+π-связь в этилене Н2С = СН2 ; в) тройная σ+π+π-связь в ацетилене HC≡CH
Кратность связи между атомами углерода: а) одинарная σ-связь в этане Н3С-СН3 ; б) двойная σ+π-связь в этилене Н2С = СН2 ; в) тройная σ+π+π-связь в ацетилене HC≡CH
5. Полярность и поляризуемость . Электронная плотность ковалентной связи может по-разному располагаться в межъядерном пространстве.
Полярность — это свойство ковалентной связи, которое определяется областью расположения электронной плотности в межъядерном пространстве относительно соединенных атомов.
В зависимости от размещения электронной плотности в межъядерном пространстве различают полярная и неполярная ковалентные связи. Неполярной связью называется такая связь, при которой общее электронное облако размещается симметрично относительно ядер соединенных атомов и одинаково принадлежит обоим атомам.
Молекулы с таким типом связи называются неполярными или гомоядерными (то есть такими, в состав которых входят атомы одного элемента). Неполярная связь проявляется как правило в гомоядерных молекулах (Н 2 , Cl 2 , N 2 и т.д.) или — реже — в соединениях, образованных атомами элементов с близкими значениями электроотрицательности, например, карборунд SiC. Полярной, (или гетерополярной) называется связь, при которой общее электронное облако несимметричное и смещено к одному из атомов.
Молекулы с полярной связью называются полярными, или гетероядерными. В молекулах с полярной связью обобщенная электронная пара смещается в сторону атома с большей электроотрицательностью. В результате на этом атоме возникает некоторый частичный отрицательный заряд (δ-), который называется эффективным, а у атома с меньшей электроотрицательностью — одинаковый по величине, но противоположный по знаку частичный положительный заряд (δ+). Например, экспериментально установлено, что эффективный заряд на атоме водорода в молекуле хлорида водорода HCl — δH=+0,17, а на атоме хлора δCl=-0,17 абсолютного заряда электрона.
Чтобы определить, в какую сторону будет смещаться электронная плотность полярной ковалентной связи, необходимо сравнить электроны обоих атомов. По возрастанию электроотрицательности наиболее распространенные химические элементы размещаются в такой последовательности:
Полярные молекулы называются диполями — системами, в которых центры тяжести положительных зарядов ядер и отрицательных зарядов электронов не совпадают.
Диполь — это система, которая представляет собой совокупность двух точечных электрических зарядов, одинаковых по величине и противоположных по знаку, находящихся на некотором расстоянии друг от друга.
Расстояние между центрами притяжения называются длина диполя и обозначаются буквой l. Полярность молекулы (или связи) количественно характеризуется дипольным моментом μ, который в случае двухатомной молекулы равен произведению длины диполя на величину заряда электрона: μ=el.
В единицах СИ дипольный момент измеряется в [Кл × м] (Кулон-метры), но чаще пользуются внесистемной единицей [D] (дебай): 1D = 3,33 · 10 -30 Кл × м. Значение дипольных моментов ковалентных молекул меняется в пределах 0-4 D, а ионных — 4-11D. Чем больше длина диполя, тем более полярной является молекула.
Совместная электронное облако в молекуле может смещаться под действием внешнего электрического поля, в том числе и поля другой молекулы или иона.
Поляризуемость — это изменение полярности связи в результате смещения электронов, образующих связь, под действием внешнего электрического поля, в том числе и силового поля другой частицы.
Поляризуемость молекулы зависит от подвижности электронов, которая является тем сильнее, чем больше расстояние от ядер. Кроме того, поляризуемость зависит от направленности электрического поля и от способности электронных облаков деформироваться. Под действием внешнего поля неполярные молекулы становятся полярными, а полярные — еще более полярными, то есть в молекулах индуцируется диполь, который называется приведенным, или индуцированным диполем.
 Схема образования индуцированного (приведенного) диполя из неполярной молекулы под действием силового поля полярной частицы — диполя
Схема образования индуцированного (приведенного) диполя из неполярной молекулы под действием силового поля полярной частицы — диполя
В отличие от постоянных, индуцированные диполи возникают лишь при действии внешнего электрического поля. Поляризация может вызывать не только поляризуемость связи, но и ее разрыв, при котором происходит переход связующего электронной пары к одному из атомов и образуются отрицательно и положительно заряженные ионы.
Полярность и поляризуемость ковалентных связей определяет реакционную способность молекул по отношению к полярным реагентам.
Свойства соединений с ковалентной связью
Вещества с ковалентными связями делятся на две неравные группы: молекулярные и атомные (или немолекулярные), которых значительно меньше, чем молекулярных.
Молекулярные соединения в обычных условиях могут находиться в различных агрегатных состояниях: в виде газов (CO 2 , NH 3 , CH 4 , Cl 2 , O 2 , NH 3), легколетучих жидкостей (Br 2 , H 2 O, C 2 H 5 OH) или твердых кристаллических веществ, большинство из которых даже при очень незначительном нагревании способны быстро плавиться и легко сублимироваться (S 8 , P 4 , I 2 , сахар С 12 Н 22 О 11 , «сухой лед» СО 2).
Низкие температуры плавления, возгонки и кипения молекулярных веществ объясняются очень слабыми силами межмолекулярного взаимодействия в кристаллах. Именно поэтому для молекулярных кристаллов не присуща большая прочность, твердость и электрическая проводимость (лед или сахар). При этом вещества с полярными молекулами имеют более высокие температуры плавления и кипения, чем с неполярными. Некоторые из них растворимы в или других полярных растворителях. А вещества с неполярными молекулами, наоборот, лучше растворяются в неполярных растворителях (бензол, тетрахлорметан). Так, йод, у которого молекулы неполярные, не растворяется в полярной воде, но растворяется в неполярной CCl 4 и малополярном спирте.
Немолекулярные (атомные) вещества с ковалентными связями (алмаз, графит, кремний Si, кварц SiO 2 , карборунд SiC и другие) образуют чрезвычайно прочные кристаллы, за исключением графита, которого имеет слоистую структуру. Например, кристаллическая решетка алмаза — правильный трехмерный каркас, в котором каждый sр 3 -гибридизованный атом углерода соединен с четырьмя соседними атомами С σ-связями. По сути весь кристалл алмаза — это одна огромная и очень прочная молекула. Аналогичное строение имеют и кристаллы кремния Si, который широко применяется в радиоэлектронике и электронной технике. Если заменить половину атомов С в алмазе атомами Si, не нарушая каркасную структуру кристалла, то получим кристалл карборунда — карбида кремния SiC — очень твердого вещества, используемого в качестве абразивного материала. А если в кристаллической решетке кремния между каждыми двумя атомами Si вставить по атому О, то образуется кристаллическая структура кварца SiO 2 — тоже очень твердого вещества, разновидность которого также используют как абразивный материал.
Кристаллы алмаза, кремния, кварца и подобные им по структуре — это атомные кристаллы, они представляют собой огромные «супермолекулы», поэтому их структурные формулы можно изобразить не полностью, а только в виде отдельного фрагмента, например:
 Кристаллы алмаза, кремния, кварца
Кристаллы алмаза, кремния, кварца
Немолекулярные (атомные) кристаллы, состоящие из соединенных между собой химическими связями атомов одного или двух элементов, относятся к тугоплавким веществам. Высокие температуры плавления обусловлены необходимостью затраты большого количества энергии для разрыва прочных химических связей при плавлении атомных кристаллов, а не слабого межмолекулярного взаимодействия, как в случае молекулярных веществ. По этой же причине многие атомные кристаллов при нагревании не плавятся, а разлагаются или сразу переходят в парообразное состояние (возгонка), например, графит сублимируется при 3700 o С.
Немолекулярные вещества с ковалентными связями нерастворимые в воде и других растворителях, большинство из них не проводит электрический ток (кроме графита, которому присуща электропроводность, и полупроводников — кремния, германия и др.).
Вещества молекулярного строения образуются с помощью особого вида взаимосвязи. Ковалентная связь в молекуле, полярная и неполярная, также называется атомной. Это название происходит от латинского «co» — «совместно» и «vales» — «имеющий силу». При таком способе образования соединений пара электронов делится между двумя атомами.
Что такое ковалентная полярная и неполярная связь? Если новое соединение образуется таким образом, то происходит обобществление электронных пар. Обычно такие вещества имеют молекулярное строение: Н 2 , О 3 , HCl, HF, CH 4 .
Есть и немолекулярные вещества, в которых атомы связаны таким образом. Это так называемые атомные кристаллы: алмаз, диоксид кремния, карбид кремния. В них каждая частица связана с четырьмя другими, в результате получается очень прочный кристалл. Кристаллы с молекулярной структурой обычно не отличаются высокой прочностью.
Свойства такого способа образования соединений:
- кратность;
- направленность;
- степень полярности;
- поляризуемость;
- сопряжение.
Кратность - это количество поделенных электронных пар. Их может быть от одной до трех. У кислорода до заполнения оболочки двух электронов не хватает, поэтому она будет двойной. У азота в молекуле N 2 она тройная.
Поляризуемость - возможность образования ковалентной полярной связи и неполярной. При этом она может быть более или менее полярна, ближе к ионной или наоборот - в этом заключается свойство степени полярности.
Направленность означает, что атомы стремятся соединиться таким образом, чтобы между ними осталась как можно большая электронная плотность. О направленности имеет смысл говорить тогда, когда соединяются p или d-орбитали. S-орбитали сферически симметричны, для них все направления равноценны. У p-орбиталей неполярная или полярная ковалентная связь направлена вдоль их оси, так что две «восьмерки» перекрываются вершинами. Это σ-связь. Существуют и менее прочные π-связи. В случае p-орбиталей «восьмерки» перекрываются боковыми сторонами вне оси молекулы. В двойном или тройном случае p-орбитали образуют одну σ-связь, а остальные будут типа π.
Сопряжение - это чередование простых и кратных, делающее молекулу более стабильной. Такое свойство характерно для сложных органических соединений.

Виды и способы образования химических связей
Полярность
Важно! Как определить, вещества с неполярной ковалентной или полярной связью перед нами? Это очень просто: первая всегда возникает между одинаковыми атомами, а вторая - между разными, имеющими неодинаковую электроотрицательность.
Примеры ковалентной неполярной связи - простые вещества:
- водород Н 2 ;
- азот N 2 ;
- кислород О 2 ;
- хлор Cl 2 .
Схема образования ковалентной неполярной связи показывает, что с помощью объединения электронной пары атомы стремятся дополнить внешнюю оболочку до 8 или 2 электронов. Например, фтору не хватает одного электрона до восьмиэлектронной оболочки. После образования поделенной электронной пары она заполнится. Распространенная формула вещества с ковалентной неполярной связью - двухатомная молекула.

Полярно обычно связываются только :
- Н 2 О;
- CH 4 .
 Но бывают и исключения, такие как AlCl 3 . Алюминий обладает свойством амфотерности, то есть в одних соединениях он ведет себя как металл, а в других - как неметалл. Разница в электроотрицательности в этом соединении небольшая, поэтому алюминий соединяется с хлором именно так, а не по ионному типу.
Но бывают и исключения, такие как AlCl 3 . Алюминий обладает свойством амфотерности, то есть в одних соединениях он ведет себя как металл, а в других - как неметалл. Разница в электроотрицательности в этом соединении небольшая, поэтому алюминий соединяется с хлором именно так, а не по ионному типу.
В этом случае молекулу образуют разные элементы, но разница в электроотрицательности не так велика, чтобы электрон полностью перешел от одного атома к другому, как в веществах ионного строения.
Схемы образования ковалентной структуры этого типа показывают, что электронная плотность смещается к более электроотрицательному атому, то есть поделенная электронная пара находится к одному из них ближе, чем ко второму. Части молекулы приобретают заряд, который обозначается греческой буквой дельта. В хлороводороде, например, хлор становится заряжен более отрицательно, а водород - более положительно. Заряд будет частичный, а не целый, как у ионов.
Важно! Не следует путать полярность связи и полярность молекулы. В метане СН4, например, атомы связаны полярно, а сама молекула неполярна.
Полезное видео: полярная и неполярная ковалентная связь
Механизм образования
Образование новых веществ может проходить по обменному или донорно-акцепторному механизму. При этом объединяются атомные орбитали. Возникает одна или несколько молекулярных орбиталей. Они отличаются тем, что охватывают оба атома. Как и на атомной, на ней может находиться не более двух электронов, причем их спины тоже должны быть разнонаправленными.
Как определить, какой механизм задействован? Это можно сделать по числу электронов на внешних орбиталях.
Обменный
В этом случае электронная пара на молекулярной орбитали образуется из двух неспаренных электронов, каждый из которых принадлежит своему атому. Каждый из них стремится заполнить свою внешнюю электронную оболочку, сделать ее устойчивой восьми- или двухэлектронной. Так обычно образуются вещества с неполярной структурой.
Для примера рассмотрим соляную кислоту HCl. У водорода на внешнем уровне один электрон. У хлора - семь. Нарисовав схемы образования ковалентной структуры для него, увидим, что для заполнения внешней оболочки каждому из них не хватает по одному электрону. Поделив между собой электронную пару, они смогут завершить внешнюю оболочку. По такому же принципу образуются и двухатомные молекулы простых веществ, например, водорода, кислорода, хлора, азота и других неметаллов.

Механизм образования
Донорно-акцепторный
Во втором случае оба электрона представляют собой неподеленную пару и принадлежат одному атому (донору). У другого (акцептора) есть свободная орбиталь.
Формула вещества с ковалентной полярной связью, образованной таким образом, например, ион аммония NH 4 +. Он образуется из иона водорода, в котором есть свободная орбиталь, и аммиака NH3, содержащего один «лишний» электрон. Электронная пара из аммиака обобществляется.
Гибридизация
Когда электронная пара обобществляется между орбиталями различной формы, например, s и р, образуется гибридное электронное облако sp. Такие орбитали сильнее перекрываются, поэтому связываются прочнее.
Так устроены молекулы метана и аммиака. В молекуле метана СН 4 должны были образоваться три связи по p-орбиталям и одна по s. Вместо этого орбиталь гибридизируется с тремя р-орбиталями, получаются три гибридные sp3-орбитали в форме вытянутых капель. Это происходит потому, что электроны 2s и 2p имеют близкую энергию, они взаимодействуют друг с другом при соединении с другим атомом. Тогда можно образовать гибридную орбиталь. Получившаяся молекула имеет форму тетраэдра, водород располагается в его вершинах.
Другие примеры веществ с гибридизацией:
- ацетилен;
- бензол;
- алмаз;
- вода.
Для углерода характерна spЗ-гибридизация, поэтому она часто встречается в органических соединениях.
Полезное видео: ковалентная полярная связь
Вывод
Ковалентная связь, полярная или неполярная, характерна для веществ молекулярного строения. Неполярно связаны атомы одного элемента, а полярно - разных, но с ненамного отличающейся электроотрицательностью. Обычно таким образом соединяются элементы-неметаллы, но бывают и исключения, такие как алюминий.