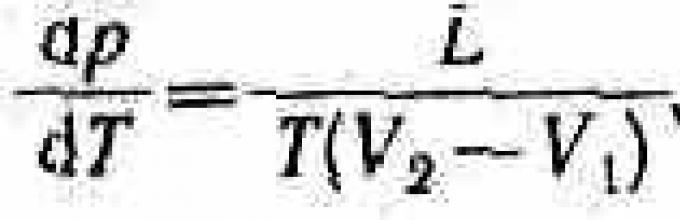Вопрос о методиках реализации реперных точек постоянно обсуждается на международных конференциях и рассматривается в документах ККТ, в частности наиболее полно методики были представлены в обзоре, подготовленном РГ1/ККТ и опубликованном в журнале «Метрология»: B. W. Mangum, P. Bloembergen, M. V. Chattle, B. Fellmuth, P. Marcarino. Metrologia 36 (1999) . В данном разделе рекоммендации по реализации фазовых переходов, которые могут быть полезны поверителям при работе с ампулами реперных точек.
Тройная точка воды (273,16 К)
Тройная точка воды - самая простая в реализации реперная точка. Для ее хранения и воспроизведения может использоваться термостат или сосуд Дьюара, наполненный смесью дробленого льда и воды. Разработаны также специальные термостаты для хранения сосудов тройных точек воды и поддержания их в рабочем состоянии длительное время.
Особенности реализации с наивысшей точностью: Начинать измерения рекомендуется через сутки после приготовления ледяной мантии. Необходимо устранить попадание света от внешних источников на сосуд и термометр (во избежании подвода тепла излучением). Для этого рекомендуется закрыть термометр плотной тканью. Глубина погружения зависит от типа термометра. Для эталонных платиновых термометров диаметром 5-7 мм она составляет не менее 15 см.
Приготовление ледяной мантии может осуществляться несколькими способами. Наиболее распространенный и быстрый способ - с использованием жидкого азота и металлических стержней. Стержень погружается в жидкий азот, затем в канал тройной точки воды, заполненный чистым спиртом. Процедура повторяется, пока на стенках канала не образуется ледяная мантия толщиной не менее 1 см. Другой способ - заполнение канала мелкодробленым сухим льдом. Ледяная мантия может также формироваться путем переохлаждения воды. Сосуд тройной точки погружается в смесь льда и поваренной соли, имеющую температуру около -10 °С. Через 20 мин. сосуд извлекается из смеси и встряхивается. При этом можно наблюдать впечатляющую картину быстрого образования ячеистого льда по всему объему воды, который в последствии формирует нормальную ледяную мантию вокруг канала. Этот способ сейчас реализуется в некоторых специальных термостатах для реализации реперных точек. Перед началом измерений в точке необходимо убедиться, что ледяная мантия может свободно вращаться вокруг канала. Если этого не происходит, то рекомендуется на несколько секунд ввести в канал алюминиевый или стеклянный стержень, имеющий комнатную температуру, затем повторно проверить вращение мантии. Канал, как правило заполняется чистой водой. Если образуется большой зазор между стенками канала и термометром, то рекомендуется использовать заполняющие металлические втулки длиной, равной длине чувствительного элемента термометра.
Реализация реперных точек металлов
Наиболее подробно принципы реализации температур плавления и затвердевания металлов изложены в разделе
Два условия получения качественных площадок плавления и затвердевания металлов: 1. Использовать металл высокой чистоты и не допускать загрязнения металла во время заплавки в тигель; 2. Обеспечить равномерность температурного поля в печи на длине тигля.
Для градуировки ПТС с максимальной точностью необходимо использовать металлы чистотой не менее 99,9999%. В этом случае температура, реализуемая точкой (до 420 °С) будет отличаться от температуры идеально чистого металла не более, чем на 0,1-0,2 мК. Отклонение температуры реперной точки от значения МТШ-90 зависит от вида примеси и ее взаимодействия с конкретным металлом. Оценка показывает, что если используется металл чистотой 99,999%, то для точек Al, Ag, Au, Cu отклонение составит несколько мК. (из документа «Дополнительная информация к шкале МТШ-90»). Подробно влияние примесей на температуру реперных точек исследуется в работе: B. Fellmuth and K. D. Hill, Metrologia 43 (2006). (сайт www.bipm.org)
Рекоммендация ККТ - перепад температуры по длине тигля для эталонных ампул затвердевания металлов при температуре, близкой к реперной точке не должен превышать 10 мК. Чем выше температура, тем сложнее обеспечить равномерность температурного поля в печи. Для точек выше Al в большинстве лабораторий-хранителей первичных эталонов используются тепловые трубы.
Тройная точка ртути
Наиболее надежными и удобными в обращении считаются герметичные ячейки из нержавеющей стали. Для реализации температуры тройной точки рекомендуется использовать жидкостный термостат с хорошим перемешиванием и высокой воспроизводимостью заданной температуры. Наиболее простой способ получения температурной площадки - метод плавления затвердевшей ртути. Затвердевание достигается либо охлаждением ячейки в термостате до температуры примерно -42°С, либо погружением в канал специального охлаждающего стержня (immersion cooler). Выход на плавление осуществляется плавным повышением температуры в термостате и регулированием на уровне значения, близкого к реперной точке. Для улучшения качества площадки и формирования слоя жидкого металла вокруг канала рекомендуется погрузить в канал перед началом измерений теплый стержень. Хороший жидкостный термостат, заполненный спиртом, позволит без труда получить длительность фазового перехода 10 ч и более.
Точка плавления галлия (29,7646 °С)
Точка плавления галлия является одной из самых стабильных и хорошо воспроизводимых температурных точек МТШ-90. Воспроизводимость температуры плавления галлия в хороших термостатах достигает ±0,2 мК и лучше. Иногда в научных публикациях появляются предложения использовать эту точку вместо тройной точки воды для расчета относительных сопротивлений эталонных платиновых термометров сопротивления. Температура плавления галлия может быть реализована в жидкостных или твердотельных термостатах с равномерным температурным полем. Температура термостата устанавливается на значение на 1,5 -2 °С превышающее температуру реперной точки. В момент, когда контрольный термометр в канале зафиксирует начало плавления, в канал вводится стержень, нагретый примерно до 40 °С или специальный тонкий нагреватель мощностью примерно 10 Вт и выдерживается в канале около 20 мин. Это позволяет создать тонкий расплавленный слой металла вокруг канала и получить более плоскую площадку плавления.
Точка затвердевания олова (231,928 °С)
Особенностью точки затвердевания олова является глубокое переохлаждение олова перед началом затвердевания. Поэтому специальные меры должны быть предприняты для реализации переохлаждения и вывода металла из переохлажденного состояния. Наиболее распространенная методика следующая: олово плавится и перегревается до температуры на 5 °С выше реперной точки, выдерживается при этой температуре в течение 10-15 ч, после чего задание регулятора меняется на значение температуры на 0,5 -1 °С ниже реперной точки и начинается охлаждение металла; после того, как температура, регистрируемая контрольным термометров в канале ячейки достигнет температуры затвердевания, ячейка выводится из печи на воздух и по контрольному термометру отслеживается процесс переохлаждения и спонтанного подъема температуры металла (рекалесценция); ячейка погружается обратно в печь; в канал вводятся последовательно на две минуты два стержня, имеющие комнатную температуру. После этого можно начинать измерения. Для уровня рабочих эталонов и образцовых термометров можно применять упрощенные методики затвердевания. Чтобы получить площадку затвердевания в течение одного рабочего дня можно перегревать олово на 10-15 °С выше температуры точки и выдерживать при этой температуре 1 ч. Если требования к расширенной неопределенности градуировки ПТС не выше 2 мК, и печь имеет равномерное температурное поле, то можно также с успехом работать на площадке плавления. В некоторых ячейках переохлаждение достигает лишь 2-3 °С, в этом случае можно для получения площадки затвердевания не выводить ячейку из печи, а снизить температуру печи на 5-7 °С, и после рекалесценции поднять температуру до значения, близкого к температуре реперной точки. Важнейшее, и как правило самое трудное в исполнении, условие качественной реализации точки олова (как и других точек затвердевания металлов) - равномерность температурного поля по длине тигля с металлом.
Подробно поцесс затвердевания олова описан в следующей монографии: G. F. Strouse and N. P. Moiseeva, NIST Special Publication 260-138 (1999) .
Точки затвердевания индия (156,5985 °С), цинка (419,527 °С), алюминия (660,323 °С), серебра (961,78 °С)
Методика реализации данных точек практически идентична, т.к. переохлаждение металлов не велико. Основной принцип получения качественных площадок затвердевания заключается в обеспечении высокой равномерности температурного поля в тигле. (Необходимо отметить, что перепад температуры в тигле в несколько градусов очень опасен, т.к. может привести к разрушению ампулы, поскольку слой расплавленного металла внизу тигля не имеет возможности расшириться вверх, если верхний слой еще находится в твердом состоянии. В результате металл просачивается сквозь графит.) Методика, предлагаемая ККТ следующая: металл медленно расплавляется, перегревается после плавления на 5 К и выдерживается в печи 10 -15 ч.; температура печи устанавливается на значение на 2-3 °С ниже точки затвердевания, и когда по контрольному термометру наблюдается переохлаждение и рекалесценция, термометр выводится из тигля и в канал вставляются поочередно два кварцевых (или керамических) стержня, имеющие первоначально комнатную температуру. Каждый стержень выдерживается в канале 2 мин. Это способствует образованию тонкого слоя затвердевшего металла, т.е. второй границы раздела фаз, что "термостатирует" термометр, стабилизирует ход затвердевания и в какой-то мере "исправляет" неравномерность температурного поля по длине чувствительного элемента термометра. Для получения максимальной длительности процесса затвердевания температура в печи повышается до значения на 0,5 -1 К ниже реперной точки. После этого можно проводить последовательную градуировку эталонных термометров, причем для увеличения длительности площадки термометры рекомендуется подогревать перед вводом в ампулу.
Изложенные выше рекомендации касаются в основном измерений на эталонном уровне точности, там где требуется расширенная неопределенность не хуже 1-2 мК. Ячейки реперных точек в эталонных установках выполнены из кварца, причем, для первичных государственных эталонов - это ячейки "открытого" типа с регулируемым давлением, для рабочих эталонов, это, как правило ячейки "закрытого" типа (герметичные кварцевые ампулы). В настоящее время появляется все больше установок для реализации реперных точек МТШ-90, используемых для градуировки вторичных эталонов и образцовых термометров. В таких установках могут использоваться ячейки наиболее надежной конструкции: графитовый тигель с металлом помещается в герметичный металлический корпус. Стоит отметить также, что для получения расширенной неопределенности на уровне 3-5 мК, для металлов высокой чистоты в печах с равномерным температурным полем можно использовать площадки плавления.
Более подробная информация о реализации реперных точек МТШ-90 изложена в разделе
Если система является однокомпонентной, т. е. состоящей из химически однородного вещества или его соединения, то понятие фазы совпадает с понятием агрегатного состояния. Согласно § 60, одно и то же вещество в зависимости от соотношения между удвоенной средней энергией, приходящейся на одну степень свободы хаотического теплового движения молекул, и наименьшей потенциальной энергией взаимодействия молекул может находиться в одном из трех агрегатных состояний: твердом, жидком или газообразном. Это соотношение, в свою очередь, определяется внешними условиями - температурой и давлением. Следовательно, фазовые превращения также определяются изменениями температуры и давления. Для наглядного изображения фазовых превращений используется диаграмма состояния (рис. 115), на которой в координатах р, Т задается зависимость между температурой фазового перехода и давлением в виде кривых испарения (КИ), плавления (КП) и сублимации (КС), разделяющих поле диаграммы на три области, соответствующие условиям существования твердой (ТТ), жидкой (Ж) и газообразной (Г) фаз. Кривые на диаграмме называются кривыми фазового равновесия, каждая точка на них соответ-
ствует условиям равновесия двух сосуществующих фаз: КП - твердого тела и жидкости, КИ - жидкости и газа, КС - твердого тела и газа.
Точка, в которой пересекаются эти кривые и которая, следовательно, определяет условия (температуру T тр и соответствующее ей равновесное давление р тр) одновременного равновесного сосуществования трех фаз вещества, называется тройной точкой. Каждое вещество имеет только одну тройную точку. Тройная точка воды характеризуется температурой 273,16 К (по шкале Цельсия ей соответствует температура 0,01 °С) и является основной реперной точкой для построения термодинамической температурной шкалы.
Термодинамика дает метод расчета кривой равновесия двух фаз одного и того же вещества. Согласно уравнению Клапейрона - Клаузиуса, производная от равновесного давления по температуре

где L - теплота фазового перехода, (V 2 -V 1) -изменение объема вещества при переходе его из первой фазы во вторую, Т - температура перехода (процесс изотермический).
Уравнение Клапейрона - Клаузиуса позволяет определить наклоны кривых равновесия. Поскольку L и Т положительны, наклон задается знаком V 2 -V 1 . При испарении жидкостей и сублимации твердых тел объем вещества всегда возрастает, поэтому, согласно (76.1), dp /dT >0; следовательно, в этих процессах повышение температуры приводит к увеличению давления, и наоборот. При плавлении большинства веществ объем, как правило, возрастает, т. е. dp /dT >0; следовательно, увеличение давления приводит к повышению температуры плавления (сплошная КП на рис. 115). Для некоторых же веществ (H 2 O, Ge, чугун и др.) объем жидкой фазы меньше объема твердой фазы, т. е. dp /dT <0; следовательно, увеличение давления сопровождается понижением температуры плавления (штриховая линия на рис. 115).
Диаграмма состояния, строящаяся на

основе экспериментальных данных, позволяет судить, в каком состоянии находится данное вещество при определенных р и Т, а также какие фазовые переходы будут происходить при том или ином процессе. Например, при условиях, соответствующих точке 1 (рис. 116), вещество находится в твердом состоянии, точке 2 - в газообразном, а точке 3 - одновременно в жидком и газообразном состояниях. Допустим, что вещество в твердом состоянии, соответствующем точке 4, подвергается изобарному нагреванию, изображенному на диаграмме состояния горизонтальной штриховой прямой 4- 5-6. Из рисунка видно, что при температуре, соответствующей точке 5, вещество плавится, при более высокой температуре, соответствующей точке 6 ,- начинает превращаться в газ. Если же вещество находится в твердом состоянии, соответствующем точке 7, то при изобарном нагревании (штриховая прямая 7-8) кристалл превращается в газ минуя жидкую фазу. Если вещество находится в состоянии, соответствующем точке 9, то при изотермическом сжатии (штриховая прямая 9-10) оно пройдет следующие три состояния: газ - жидкость - кристаллическое состояние.
На диаграмме состояний (см. рис. 115 и 116) видно, что кривая испарения заканчивается в критической точке К. Поэтому возможен непрерывный переход вещества из жидкого состояния в газообразное и обратно в обход критической точки, без пересечения кривой испарения (переход 11 -12 на рис. 116), т. е. такой переход, который не сопровождается фазовыми превращениями. Это возможно благодаря тому, что различие между газом и жидкостью является чисто количествен-
ным (оба эти состояния, например, являются изотропными). Переход же кристаллического состояния (характеризуется анизотропией) в жидкое или газообразное может быть только скачкообразным (в результате фазового перехода), поэтому
кривые плавления и сублимации не могут обрываться, как это имеет место для кривой испарения в критической точке. Кривая плавления уходит в бесконечность, а кривая сублимации идет в точку, где р = 0 и Т= 0.
Контрольные вопросы
Чем отличаются реальные газы от идеальных? Каков смысл поправок при выводе уравнения Ван-дер-Ваальса?
Почему перегретая жидкость и пересыщенный пар являются метастабильными состояниями? При адиабатическом расширении газа в вакуум его внутренняя энергия не меняется. Как изменится температура, если газ идеальный? реальный?
Каковы суть и причины эффекта Джоуля - Томсона? Когда его называют положительным? отрицательным?
Почему у всех веществ поверхностное натяжение уменьшается с температурой? Что представляют собой поверхностно-активные вещества? При каком условии жидкость смачивает твердое тело? не смачивает? От чего зависит высота поднятия смачивающей жидкости в капилляре? Чем отличаются монокристаллы от поликристаллов? Как можно классифицировать кристаллы?
Как получить закон Дюлонга и Пти исходя из классической теории теплоемкости? Некоторое количество твердого вещества смешано с тем же веществом в жидком состоянии. Почему при некотором нагреве этой смеси ее температура не поднимается? Чем отличается фазовый переход I рода от фазового перехода II рола?
Задачи
10.1. Углекислый газ массой m=1 кг находится при температуре 290 К в сосуде вместимостью 20 л. Определить давление газа, если: 1) газ реальный; 2) газ идеальный. Объяснить различие в результатах. Поправки а и b принять равными соответственно 0,365 Н м 4 /моль 2 и 4,3 10 -5 м 3 /моль. [ 1) 2,44 МПа; 2) 2,76 МПа ]
10.2. Кислород, содержащий количество вещества v = 2 моль, занимает объем V 1 = 1 л. Определить изменение T температуры кислорода, если он адиабатически расширяется в вакуум до объема V 2 =10 л. Поправку а принять равной 0,136 Н м 4 /моль 2 . [-11,8 К |
10.3. Показать, что эффект Джоуля - Томсона всегда отрицателен, если дросселируется газ, для которого силами притяжения молекул можно пренебречь.
10.4. Считая процесс образования мыльного пузыря изотермическим, определить работу А, которую надо совершить, чтобы увеличить его диаметр от d 1 =2 см до d 2 =6 см. Поверхностное натяжение о мыльного раствора принять равным 40 мН/м.
10.7. Для нагревания металлического шарика массой 25 г от 10 до 30 °С затратили количество теплоты, равное 117 Дж. Определить теплоемкость шарика из закона Дюлонга и Пти и материал шарика. [М107 кг/моль; серебро]
*П. Лаплас (1749 -1827) -вранцузский ученый.
* К. Линде (1842-1934) -немецкий физик и инженер.
Одновременное сосуществование трёх фаз воды
Как видно из параметров тройной точки воды, при нормальных условиях равновесное сосуществование льда, водяного пара и жидкой воды невозможно. Это обстоятельство вроде бы противоречит обыденным наблюдениям - лёд, вода и пар часто наблюдаются одновременно. Но противоречия нет - наблюдаемые состояния далеки от термодинамически равновесных и реализуются на практике только из-за кинетических ограничений фазовых переходов. Тройная точка воды характеризуется определенным набором параметров давления и температуры, поэтому может иногда использоваться как «реперная» - то есть опорная, например, для калибровки приборов.
См. также
Ссылки
- Вода в тройной точке. (На самом деле некая переохлажденная жидкость) Видеоролик
Примечания
Wikimedia Foundation . 2010 .
Смотреть что такое "Тройная точка воды" в других словарях:
тройная точка воды - (для элемента, представляющего собой разновидность сосуда Дьюара) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN triple point of waterTPW … Справочник технического переводчика
Тройная точка - воды; p давление; t температура. ТРОЙНАЯ ТОЧКА, состояние равновесного сосуществования трех фаз вещества, обычно твердой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара) 0,01°C (273,16 К) при… … Иллюстрированный энциклопедический словарь
Состояние равновесного сосуществования. Тройная точка воды трех фаз вещества, обычно твердой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара, рис.) равна 0,01 .С (273,16 К) при давлении 6,1 гПа… … Большой Энциклопедический словарь
Тройная точка - точка на термодинамической диаграмме состояния, соответствующая равновесию трех фаз рассматриваемой термодинамической системы. Например, тройная точка воды соответствует равновесию системы, состоящей из льда, воды и водяного пара. Температуpa… …
ТРОЙНАЯ ТОЧКА - точка на термодинамической диаграмме состояния, соответствующая равновесию трех фаз рассматриваемой термодинамической системы. Например, тройная точка воды соответствует равновесию системы, состоящей из льда, воды и водяного пара. Темпеpaтура… … Металлургический словарь
Состояние равновесного сосуществования трёх фаз вещества, обычно твёрдой, жидкой и газообразной. Температура тройной точки воды (точки сосуществования льда, воды и пара, рис.) равна 0,01°C (273,16 К) при давлении 6,1 гПа (4,58 мм рт. ст.). * * * … Энциклопедический словарь
Типичные виды фазовых диаграмм. Зелёная линия из точек показывает аномальное поведение воды Тройная точка точка на фазовой диаграмме, где сходятся три линии фазовых … Википедия
тройная точка - точка на диаграммы состояния, соответствующая сосуществованию трех фаз вещества. Из правила фаз следует, что у химически индивидуального вещества (однокомпонентная система) при равновесии не может быть больше трех фаз. Эти три… … Энциклопедический словарь по металлургии
В термодинамике, точка на диаграмме состояния, соответствующая равновесному сосуществованию трёх фаз в ва. Из Гиббса правила фаз следует, что химически индивидуальное в во (однокомпонентная система) в равновесии не может иметь больше трёх фаз.… … Физическая энциклопедия
ТРОЙНАЯ ТОЧКА, температура и давление, при которых все три состояния вещества (твердое, жидкое, газообразное) могут существовать одновременно. Для воды тройная точка находится при температуре 273,16 К и давлении 610 Ра … Научно-технический энциклопедический словарь
Cтраница 1
Температура тройной точки воды используется как реперная температура термодинамической шкалы Кельвина.
Температура тройной точки воды по этой шкале принимается равной 0 01 С. Так как численные значения температуры по обеим шкалам (термодинамической и практической) в пределах обычной точности измерения совпадают, то обозначения применяемой шкалы рекомендуется указывать лишь в тех случаях, когда это существенно. В экспериментальных работах все определения температуры производят обычно, пользуясь практической (стоградусной) шкалой.
Температура тройной точки воды по этой шкале принимается равной 0 01 С. Так так численные значения температуры по обеим шкалам (термодинамической и практической), в пределах обычной точности измерения совпадают, то обозначения применяемой шкалы рекомендуется указывать лишь в тех случаях, когда это существенно. В экспериментальных работах все определения температуры производят обычно, пользуясь практической (стоградусной) шкалой.
Температура тройной точки воды по этой шкале принимается равной 4 - 0 01 С. Так как численные значения температуры по обеим шкалам (термодинамической и практической) в пределах обычной точности измерения совпадают, то обозначения применяемой шкалы рекомендуется указывать лишь в тех случаях, когда это существенно. В экспериментальных работах псе определения температуры производят обычно, пользуясь практической (стоградусной) шкалой.
Температура тройной точки воды используется как репер пая температура термодинамической шкалы Кельвина. Допустим, что идеальное рабочее тело, совершая идеальный цикл Карно, получает теплоту (1 при температуре 7 и отдает теплоту 22 при температуре Тг. С / Фз - Для того чтобы построить температурную шкалу, необходимо придать 7 и Г2 определенные (реперные) значения. В качестве таких реперных температур можно взять температуры кипения воды и таяния льда при нормальных условиях, приняв их разность за 100 С.
Температура тройной точки воды по этой шкале принимается равной 0 01 С. Так так численные значения температуры по обеим шкалам (термодинамической и практической) в пределах обычной точности измерения совпадают, го обозначения применяемой шкалы рекомендуется указывать лишь в тех случаях, когда это существенно. В экспериментальных работах все определения температуры производят обычно, пользуясь практической (стоградусной) шкалой.
Температура тройной точки воды по шкале Цельсия равна 0 01 С.
Температура тройной точки воды (точки равновесия трех фаз воды - твердой, жидкой и парообразной) равна 0 01 С, или 273 16 К.
Температуру тройной точки воды удается поддерживать со стандартным отклонением 0 2 мК, чем и определяется стандартное отклонение воспроизведения кельвина, составляющее примерно 10 3 К. Трудности возникают тогда, когда появляется необходимость измерить температуру, отличающуюся от 273 16 К.
Температуру тройной точки воды удается поддерживать со стандартным отклонением 0 2 мК, чем и определяется стандартное отклонение воспроизведения кельвина, составляющее примерно 1 (Г3 К. Трудности возникают тогда, когда появляется необходимость измерить температуру, отличающуюся от 273 16 К.
Температуру тройной точки воды нетрудно вычислить, если предположить, что давление и растворенный в воде воздух влияют на нее независимо друг от друга.
Температуре тройной точки воды 273 16 К соответствует 0 01 G; следовательно, 273 15 К - это температурный промежуток, на который смещено начало отсчета.
Температурой тройной точки воды называют температуру сосуществования жидкой воды, льда и насыщенного водяного пара при отсутствии других газов.
Поскольку температура тройной точки воды, равная 273 16 К, соответствует температуре 0 01 С, смещение начала отсчета составляет 273 15 град.
Значение температуры тройной точки воды выбрано таким, чтобы интервал между точками таяния льда и кипения воды по термодинамической шкале был равен 100 град, как и по Международной практической шкале; иными словами, чтобы единица для измерений температурных промежутков-градус (град ] была для обеих шкал одинакова.
Движение. Теплота Китайгородский Александр Исаакович
Тройная точка
Тройная точка
Итак, имеются условия, при которых пар, жидкость и кристалл могут попарно существовать в равновесии.
Могут ли находиться в равновесии все состояния? Такая точка на диаграмме давление – температура существует, ее называют тройной. Где она находится?
Если поместить в закрытый сосуд при нуле градусов воду с плавающим льдом, то в свободное пространство начнут поступать водяные (и «ледяные») пары. При давлении 4,6 мм Нg испарение прекратится, и начнется насыщение. Теперь три фазы – лед, вода и пар – будут в состоянии равновесия. Это и есть тройная точка.
Соотношения между различными состояниями наглядно и отчетливо показывает диаграмма для воды, изображенная на рис. 103.
Такую диаграмму можно построить для любого тела.
Кривые на рисунке нам знакомы – это кривые равновесия между льдом и паром, льдом и водой, водой и паром. По вертикали, как обычно, откладывается давление, по горизонтали – температура.
Три кривые пересекаются в тройной точке и делят диаграмму на три области – жизненные пространства льда, воды и водяного пара.
Диаграмма состояния – это сжатый справочник. Ее цель – дать ответ на вопрос, какое состояние тела устойчиво при таком-то давлении и такой-то температуре.
Если в условия «левой области» поместить воду или пар, то они станут льдом. Если в «нижнюю область» внести жидкость или твердое тело, то получится пар. В «правой области» пар будет конденсироваться, а лед плавиться.
Диаграмма существования фаз позволяет сразу же ответить, что произойдет с веществом при нагревании или при сжатии. Нагревание при неизменном давлении изобразится на диаграмме горизонтальной линией. Вдоль этой линии слева направо движется точка, изображающая состояние тела.
На рисунке изображены две такие линии, одна из них – это нагревание при нормальном давлении. Линия лежит выше тройной точки. Поэтому она пересечет сначала кривую плавления, а затем, за пределами чертежа, и кривую испарения. Лед при нормальном давлении расплавится при температуре 0 °C, а образовавшаяся вода закипит при 100 °C.
Иначе будет обстоять дело для льда, нагреваемого при очень небольшом давлении, скажем, чуть ниже 5 мм Hg.
Процесс нагревания изобразится линией, идущей ниже тройной точки. Кривые плавления и кипения не пересекаются этой линией. При таком незначительном давлении нагревание приведет к непосредственному переходу льда в пар.
На рис. 104 эта же диаграмма показывает, какое интересное явление произойдет при сжатии водяного пара в состоянии, помеченном на рисунке крестиком. Сначала пар превратится в лед, а затем расплавится. Рисунок позволяет тут же сказать, при каком давлении начнется рост кристалла и когда произойдет плавление.

Диаграммы состояния всех веществ похожи одна на другую. Большие, с житейской точки зрения, различия возникают из-за того, что место нахождения тройной точки на диаграмме может быть у разных веществ самым различным.
Ведь мы существуем вблизи «нормальных условий», т.е. прежде всего при давлении, близком к одной атмосфере. Как расположена тройная точка вещества по отношению к линии нормального давления – для нас очень существенно.
Если давление в тройной точке меньше атмосферного, то для нас, живущих в «нормальных» условиях, вещество относится к плавящимся. При повышении температуры оно сначала превращается в жидкость, а потом закипает. В обратном случае – когда давление в тройной точке выше атмосферного – мы при нагревании не увидим жидкости, твердое вещество будет прямо превращаться в пар. Так ведет себя «сухой лед», что очень удобно для продавцов мороженого. Брикеты мороженого можно перекладывать кусками «сухого льда» и не бояться при этом, что мороженое станет мокрым. «Сухой лед» – это твердый углекислый газ CO 2 . Тройная точка этого вещества лежит при 73 атм. Поэтому при нагревании твердого СО 2 точка, изображающая его состояние, движется по горизонтали, пересекающей только лишь кривую испарения твердого тела (так же, как и для обычного льда при давлении около 5 мм Нg).
Из книги Занимательно о космогонии автора Томилин Анатолий НиколаевичТочка опоры «Дайте мне точку опоры, и я переверну мир!» Кто это хвастался? Вы, конечно, знаете - Архимед. Мир он не перевернул, но мысль была правильной. Во всяком революционном перевороте нужна надежная основа, на которую можно с уверенностью опереться. Так и философам
Из книги Движение. Теплота автора Китайгородский Александр ИсааковичТочка зрения звездного наблюдателя Мы решили изучать движение с точки зрения инерциальных систем. Не придется ли тогда отказаться от услуг земного наблюдателя? Ведь Земля вращается вокруг оси и вокруг Солнца, как доказал Коперник. Сейчас читателю, может быть, трудно
Из книги Как понять сложные законы физики. 100 простых и увлекательных опытов для детей и их родителей автора Дмитриев Александр Станиславович90 Точка концентрации напряжений, или Как остановить трещину на стекле Для опыта нам потребуются: две длинные палки. Ну, раз уж начали про стекло, давайте подумаем над занятным вопросом. Часто бывает, что по стеклу начинает бежать трещина. Чаще всего это заметно на лобовых
Из книги Новый ум короля [О компьютерах, мышлении и законах физики] автора Пенроуз Роджер Из книги Фарадей. Электромагнитная индукция [Наука высокого напряжения] автора Кастильо Сержио РарраМЕРТВАЯ ТОЧКА Казалось, что Фарадею предназначено судьбой стать революционером в области электромагнетизма. Ему даже удалось избавиться от ограничений брака и полностью посвятить себя науке, но на пути ученого возникло новое препятствие. Разочарование пришло со
Из книги Интерстеллар: наука за кадром автора Торн Кип СтивенТочка – линия – квадрат – куб – тессеракт Обычный тессеракт – это гиперкуб, куб в четырех измерениях. С помощью рис. 29.1 и 29.2 я по шагам объясню, что это значит. Если мы возьмем точку (рис. 29.1 сверху) и будем двигать ее в одном измерении, мы получим линию (точнее