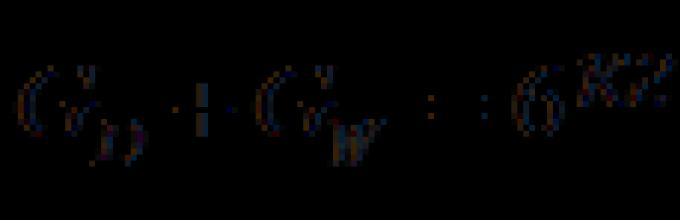2. Свойства бинарной смеси
3.1 Производительность колонны по дистилляту и кубовому остатку
1. Производительность по исходной смеси F=6 кг/с.
3. Давление в паровом пространстве дефлегматора 0,25 МПа.
4. Тип ректификационной колонны - тарельчатый, тип тарелки - ситчатый.
5. Исходная смесь перед подачей в колонну нагревается до температуры кипения насыщенным водяным паром давлением 0,25 МПа.
Введение
Ректификационные установки по принципу действия делятся на периодические и непрерывные. В установках непрерывного действия разделяемая сырая смесь поступает в колонну и продукты разделения выводятся из нее непрерывно. В установках периодического действия разделяемую смесь загружают в куб одновременно и ректификацию проводят до получения продуктов заданного конечного состава .
При разработке ректификационной колонны с ситчатыми тарелками необходимо, как правило, решать задачи:
2) анализ тепловых процессов, осуществляющихся в греющем паре куба колонны;
3) конструирование ректификационной колонны с ситчатыми тарелками.
1. Общие сведения о ректификации
Ректификация - массообменный процесс разделения однородной смеси летучих компонентов, осуществляемый путем противоточного многократного взаимодействия паров, образующихся при перегонке, с жидкостью, образующейся при конденсации этих паров.
Разделение жидкой смеси основано на различной летучести веществ. При ректификации исходная смесь делится на две части: дистиллят - смесь, обогащенную низкокипящим компонентом (НК), и кубовый остаток - смесь, обогащенную высококипящим компонентом (ВК).
Процесс ректификации осуществляется в ректификационной установке основным аппаратом, которой является ректификационная колонна, в которой пары перегоняемой жидкости поднимаются снизу, а навстречу парам стекает жидкость, подаваемая в виде флегмы в верхнюю часть аппарата.
Процесс ректификации может протекать при атмосферном давлении, а также при давлениях выше и ниже атмосферного. Под вакуумом ректификацию проводят, когда разделению подлежат высококипящие жидкие смеси. Повышенное давление применяют для разделения смесей, находящихся в газообразном состоянии при более низком давлении. Атмосферное давление принимают при разделении смесей, имеющих температуру кипения от 30 до 150°С.
Степень разделения смеси жидкостей на составляющие компоненты и чистота получаемых дистиллята и кубового остатка зависят от того, насколько развита поверхность контакта фаз, от количества подаваемой на орошение флегмы и устройства ректификационной колонны.
В промышленности применяют тарельчатые, насадочные, пленочные трубчатые и центробежные пленочные аппараты. Они различаются в основном конструкцией внутреннего устройства аппарата, назначение которого - обеспечение взаимодействия жидкости и пара.
ацетон вода ректификационная колонна
Преимущественное использование тарельчатых колонн в процессах перегонки объясняется их значительно большей производительностью по сравнению с насадочными.
При выборе ректификационной колонны для проектируемого разделения следует иметь ввиду, что тарельчатые колонны очень малого диаметра значительно дороже соответствующих насадочных колонн, однако по мере увеличения диаметра стоимость насадочных колонн возрастает значительно быстрее. Приблизительно можно считать, что стоимость насадочной колонны растет пропорционально квадрату диаметра, а колпачковой - диаметру в первой степени. Следовательно, за пределами некоторого граничного значения диаметра использование тарельчатых колонн должно быть более экономичным.
Длительный опыт промышленной эксплуатации насадочных колонн показал целесообразность их использования при диаметрах не более 0,8 м. При дальнейшем увеличении диаметра насадочной колонны ухудшается равномерное распределение флегмы по насадке, образуются каналы, по которым преимущественно устремляется флегма, и эффективность колонны резко снижается.
Наиболее распространены колпачковые тарельчатые колонны, хотя в последнее время получили преимущество ситчатые, клапанные, чешуйчатые и другие более эффективные виды барботажных устройств, главным назначением которых является максимальное развитие межфазного контакта, что способствует интенсификации массообмена между парами и флегмой. Помимо этого выбор типа контактного устройства определяется и такими факторами, как экономия материала, стоимость, легкость изготовления, чистки и ремонта, стойкость к коррозии, малое падение напора при прохождении паров, широта диапазона устойчивой работы тарелки .
Ректификационная колонна - аппарат, предназначенный для разделения жидких смесей, составляющие которых имеют различную температуру кипения. Классическая колонна представляет собой вертикальный цилиндр с контактными устройствами внутри.
Ректификация известна с начала XIX века как один из важнейших технологических процессов главным образом спиртовой и нефтяной промышленности. В настоящее время ректификацию все шире применяют в самых различных областях химической технологии, где выделение компонентов в чистом виде имеет весьма важное значение (в производствах органического синтеза, изотопов, полимеров, полупроводников и различных других веществ высокой чистоты).
В ректификационную колонну подаются пары перегоняемой жидкости. Они поднимаются снизу, а в режиме противотока навстречу парам идёт жидкость, сконденсировавшаяся наверху в холодильнике. В случае, если разгоняемый продукт состоит из двух компонентов, конечными продуктами являются дистиллят, выходящий из верхней части колонны и кубовый остаток (менее летучий компонент в жидком виде, вытекающий из нижней части колонны). Ситуация усложняется, если необходимо разделить смесь, состоящую из большого количества фракций. В этом случае используются аппараты, подобные изображенному на картинке.
Ректификационные установки по принципу действия делятся на периодические и непрерывные. В установках непрерывного действия разделяемая сырая смесь поступает в колонну и продукты разделения выводятся из нее непрерывно. В установках периодического действия разделяемую смесь загружают в куб одновременно и ректификацию проводят до получения продуктов заданного конечного состава.
Промышленные ректификационные колонны могут достигать 60 метров в высоту и 6 метров диаметре. В ректификационных колоннах в качестве контактных устройств применяются тарелки, которые дали название химическому термину, и насадки. Насадка, заполняющая колонну, может представлять из себя металлические, керамические, стеклянные и другие элементы различной формы. Конденсация осуществляется на развитой поверхности этих элементов.
2. Свойства бинарной смеси
1. Ацетон (диметилкетон, систематическое наименование: пропаноон-2) - простейший представитель кетонов. Формула: CH 3 -C (O) - CH 3 . Бесцветная легкоподвижная летучая жидкость с характерным запахом. Он полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, жиры, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия). Является одним из метаболитов, производимых человеческим организмом. Мировое производство ацетона составляет более 3-х миллионов тонн в год. В промышленности получается напрямую или косвенно из пропена.
Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Алкилированием бензолапропеном, окислением полученного кумола до гидропероксида с последующим разложением его на фенол и ацетон.
C 6 H 6 + CH 3 CH=CH 2 → C 6 H 5 CH (CH 3) 2
C 6 H 5 CH (CH 3) 2 + O 2 → C 6 H 5 C (OOH) (CH 3) 2
C 6 H 5 C (OOH) (CH 3) 2 → C 6 H 5 OH + OC (CH 3) 2
Прямым окислением пропена в жидкой фазе в присутствии PdCl 2 в среде растворов солей Pd, Cu, Fe при 50-120°C и 50-100 атм.
CH 3 CH=CH 2 + PdCl 2 + H 2 O → CH 3 C (O) CH 3 + Pd + 2HCl
Pd+2HCl + 0.5O 2 → PdCl 2 + H 2 O
Некоторое значение имеет метод брожения крахмала под действием Bacyllus acetobutylicus с образованием ацетона и бутанола. Метод характеризуется малыми выходами. Используется также методы получения из изопропилового спирта и ацетилена.
Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение
CH 3 C (O) CH 3 + NaHSO 3 → (CH 3) 2 C (OH) - SO 3 Na
Вступает в альдольную самоконденсацию под действием щелочей, с образованием диацетонового спирта.
2CH 3 C (O) CH 3 → (CH 3) 2 C (OH) CH 2 C (O) CH 3
Восстанавливается цинком до пинакона.
2CH 3 C (O) CH 3 + Zn → (CH 3) 2 C (OH) C (OH) (CH 3) 2
При пиролизе (700°C) образует кетен.
CH 3 C (O) CH 3 → CH 2 =C=O
Легко присоединяет циановодород с образованием ацетонциангидрина.
CH 3 C (O) CH 3 + HCN → (CH 3) 2 C (OH) CN
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
Ацетон, как и другие кетоны, в щелочной среде способен изомерироваться в пропаналь, последний - до пропенового спирта. В кислой среде и в присутствии ионов двухвалентной ртути, пропеновый спирт изомерируется сразу в ацетон. Между этими веществами всегда существует таутомерное равновесие:
CH 3 C (O) CH 3 ↔ С 2 Н 5 СОН ↔ СН 2 =С (ОН) - СН 3
В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи - 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона. Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое - с мочой.
Сырьё для синтеза многих важных химических продуктов: уксусного ангидрида, кетена, диацетонового спирта, окиси мезитила,метилизобутилкетона, метилметакрилата, дифенилпропана, изофорона, бифенола А и др.;
(CH 3) 2 CO + 2 C 6 H 5 OH → (CH 3) 2 C (C 6 H 4 OH) 2 + H 2 O
2. Вода - оксид водорода - одно из наиболее распространенных и важных веществ. Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой воды в природе нет, - она всегда содержит примеси. Получают чистую воду методом перегонки. Перегнанная вода называется дистиллированной. Состав воды (по массе): 11,19 % водорода и 88,81 % кислорода.
Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0° С (1 г/см 3). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0° С и кипит при 100° С при давлении 101 325 Па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода - хороший растворитель. Молекула воды имеет угловую форму атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды - диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, - отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
В жидкой воде наряду с обычными молекулами Н 2 0 содержатся ассоциированные молекулы, т.е. соединенные в более сложные агрегаты (Н 2 О) x благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств: максимальная плотность при 4° С, высокая температура кипения (в ряду Н 2 0-Н 2 S - Н 2 Sе) аномально высокая теплоемкость . С повышением температуры водородные связи разрываются, и полный разрыв наступает при переходе воды в пар.
Вода - весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения - кристаллогидраты.
Очевидно, соединения, связывающие воду, могут служить в качестве осушителей. Из других осушающих веществ можно указать Р 2 0 5 , СаО, ВаО, металлический Ма (они тоже химически взаимодействуют с водой), а также силикагель.
К важным химическим свойствам воды относится ее способность вступать в реакции гидролитического разложения .
Таблица 1. Равновесный состав смеси ацетон-вода
| x | 0 | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | Азеотропная смесь |
| t | 0 | 60,3 | 72 | 80,3 | 82,7 | 84,2 | 85,5 | 86,9 | 88,2 | 90,4 | 94,3 | 100 | - |
| y | 100 | 77,9 | 69,6 | 64,5 | 62,6 | 61,6 | 60,7 | 59,8 | 59 | 58,2 | 57,5 | 56,9 | - |
Обозначим массовый расход дистиллята G D кг/с, кубового остатка через G W кг/с, тогда
![]() ,
,
, ![]()
Питание: 
Дистиллят: 
Кубовый остаток: 
Относительный мольный расход питания
3.2 Расчет оптимального флегмового числа

Рис.2. Кривые равновесия при П=760 мм рт. ст.:
1 - ацетон-вода; 2 - четыреххлористый углерод-ацетон.
Минимальное число флегмы

Где =0,76 - мольную долю ацетона в равновесном с жидкостью питания, определяем по диаграмме - х. Рабочее число флегмы
Уравнения рабочих линий
а) верхней (укрепляющей) части колонны
б) нижней (исчерпывающей) части колонны
4. Определение скорости пара и диаметра колонны
4.1 Определение скорости пара в колонне
Средние концентрации жидкости
а) в верхней части колонны
б) в нижней части колонны
Средние уравнения пара находим по уравнениям рабочих линий:
а) в верхней части колонны
б) в нижней части колонны
Средние температуры пара определяем по диаграмме t-x,y:
Средние мольные массы и плотности пара:


Средняя плотность пара в колонне
Температура в верху колонны при x D =0,83 равняется 57 о С, а в кубе-испарителе при x W =0,008 она равна 97 о С.
Плотность жидкого ацетона при 57 о
С ![]() , а воды при 97 о
С
, а воды при 97 о
С ![]() .
.
Принимаем среднюю плотность жидкости в колонне
![]()
Определяем скорость пара в колонне
 ,
,
где С - коэффициент, зависящий от конструкции тарелок, расстояния между тарелками, рабочего давления в колонне, нагрузки колонны по жидкости.
Объемный расход проходящего через колонну пара при средней температуре
![]()
Где М D - мольная масса дистиллята, равная:
4.2 Определение диаметра колонны
Диаметр колонны

По каталогу-справочнику "Колонные аппараты" D=800 мм. Тогда скорость пара в колонне будет

По ОСТ 26-01-108-85 определяем:
Диаметр колонны - 800 мм.
Расстояние между тарелками - 300 мм.
Высота сливного порога - 25 мм.
Диаметр отверстия - 5 мм.
Шаг - 15 мм.
Исполнение - 1.
Материал для изготовления - углеродистая сталь ВСт3сп.
5. Гидравлический расчет тарелок
Принимаем следующие размеры ситчатой тарелки: диаметр отверстий d 0 = 5мм , высота сливной перегородки h п = 25мм . Свободное сечение тарелки 8% от общей площади тарелки. Площадь, занимаемая двумя сегментными переливными стаканами, составляет 20% от общей площади тарелки. Гидравлическое сопротивление тарелки в верхней и нижней части колонны по уравнению:
а) Верхняя часть колонны. Гидравлическое сопротивление сухой тарелки
![]()
где =1,82 - коэффициент сопротивления неорошаемых ситчатых тарелок со свободным сечением 7 - 10%; ![]() - скорость пара в отверстиях тарелки. Сопротивление, обусловленное силами поверхностного натяжения
- скорость пара в отверстиях тарелки. Сопротивление, обусловленное силами поверхностного натяжения

где =Н/м - поверхностное натяжение жидкости при средней температуре в верхней части колонны; d Э = d 0 =0,005м .
Сопротивление парожидкостного слоя на тарелке
Высота парожидкостного слоя
![]()
Величина Δh - высоту слоя над сливной перегородкой рассчитываем по формуле

где V Ж - объемный расход жидкости, м 3 /с ; П - периметр сливной перегородки, м ; - отношение плотности парожидкостного слоя (пены) к плотности жидкости, принимаемое приближенно равным 0,5.
Объемный расход жидкости в верхней части колонны
где - средняя мольная масса жидкости.
Периметр сливной перегородки П находим, решая систему уравнений

![]()
где R =0,2м - радиус тарелки; 2/3П b - приближенное значение площади сегмента.
Находим, что П =0,294м ; b =0,064м .

Высота парожидкостного слоя на тарелке
Сопротивление парожидкостного слоя
Общее гидравлическое сопротивление тарелки
б) Нижняя часть колонны
![]()


Общее гидравлическое сопротивление тарелки в нижней части колонны
Проверим, соблюдается ли при расстоянии между тарелками h =0,3м необходимое для нормальной работы тарелок условие
Для тарелок в нижней части колонны, у которых гидравлическое сопротивление больше, чем у тарелок в верхней части

Следовательно, вышеуказанное условие соблюдается:
Проверим равномерность работы тарелок - рассчитаем минимальную скорость пара в отверстиях , достаточную для того, чтобы ситчатая тарелка работала всеми отверстиями
Рассчитанная скорость ![]() ; следовательно, тарелки будут работать всеми отверстиями.
; следовательно, тарелки будут работать всеми отверстиями.
6. Определение числа тарелок и высоты колонны
6.1 Расчет к. п. д. тарелок
а) наносим на диаграмму у-х рабочие линии верхней и нижней части колонны и находим ступени изменения концентрации n Т . В верхней части колонны ; в нижней части , всего 8 ступеней.
Число тарелок рассчитываем по уравнению
Для определения среднего к. п. д. тарелок находим коэффициент относительной летучести разделяемых компонентов и динамический коэффициент вязкости смеси μ
при средней температуре в колонне, равной 77 o
C
. При этой температуре давление насыщенного пара ацетона мм рт. ст.,
воды Р В
=314,1 мм рт. ст
., откуда  . Динамический коэффициент вязкости ацетона при t
=77 o
C
равен 0,2·10 -3
Па·с
, воды 0,3702·10 -3
Па·с
. Принимаем:
. Динамический коэффициент вязкости ацетона при t
=77 o
C
равен 0,2·10 -3
Па·с
, воды 0,3702·10 -3
Па·с
. Принимаем:
По графику находим . Длина пути жидкости на тарелке
По графику (рис.3) находим значение поправки на длину пути . Средний к. п. д. тарелок

Рис.3. Зависимость поправки Δ от длины пути жидкости на тарелке l .
Для сравнения считаем средний к. п. д. тарелки по критериальной формуле, полученной путем статистической обработки многочисленных опытных данных для колпачковых и ситчатых тарелок
![]()
Предварительно рассчитаем коэффициент диффузии:

В этом случае
![]() ; .
; .
Коэффициент диффузии
Безразмерные комплексы
Средний к. п. д. тарелки
6.2 Расчет числа тарелок
Число тарелок:
в верхней части колонны

в нижней части колонны

Общее число тарелок n =11, с запасом n =15, из них в верхней части колонны 9, а в нижней 6 тарелок.
Высота тарельчатой части колонны
Общее гидравлическое сопротивление тарелок
7. Тепловой расчет установки
Расход теплоты, отдаваемой охлаждающей воде в дефлегматоре-конденсаторе
где r A и r В - удельные теплоты парообразования ацетона и воды при 77 о С .
Расход теплоты, получаемой в кубе-испарителе от греющего пара
Здесь тепловые потери Q пот. Приняты в размере 3% от полезно затрачиваемой теплоты; удельные теплоемкости взяты соответственно при t D =57 о С ; t W =97 о С ; t F =67 о С ; температура кипения исходной смеси t F определена по рис.1.
Расход теплоты в паровом подогревателе исходной смеси
Здесь тепловые потери приняты в размере 5%, удельная теплоемкость исходной смеси ![]() . Расход теплоты, отдаваемой охлаждающей воде в водяном холодильнике дистиллята.
. Расход теплоты, отдаваемой охлаждающей воде в водяном холодильнике дистиллята.
где удельная теплоемкость дистиллята ![]() взята при средней температуре
взята при средней температуре
![]() .
.
Расход теплоты, отдаваемой охлаждающей воде в водяном холодильнике кубового остатка
где удельная теплоемкость кубового остатка ![]() взята при средней температуре
взята при средней температуре ![]() .
.
Расход греющего пара, имеющего давление P абс . =2,5МПа и влажность 5%: а) в кубе-испарителе
где r Г.П. =2141·10 3 Дж/кг - удельная теплота конденсации греющего пара;
б) в подогревателе исходной смеси
![]()
Всего: 0,58+0,53=1,11 кг/с или 4,0 т/ч.
Расход охлаждающей воды при нагреве ее на 20 о С
а) в дефлегматоре
б) в водяном холодильнике дистиллята
![]()
в) в водяном холодильнике кубового остатка
![]()
Всего: 0,0208м 3 /с или 75м 3 /ч.
Заключение
Рассчитали ректификационную колонну для разделения смеси ацетон - вода подаваемый расход 6 кг/с, необходима колонна с диаметром D =800мм , высота тарельчатой части колонны 4,2м, общее гидравлическое сопротивление 0,05МПа с ситчатыми тарелками, количество которых 15 штук, расстояние между тарелками - 300мм , высота сливного порога - 25мм , диаметр отверстия - 5мм , при этих данных к. п. д. тарелки 0,58 производительность дистиллята 0,87. Материал для изготовления колонны - углеродистая сталь ВСт3сп.
Список использованной литературы
1. Иоффе И.Л. Проектирование процессов и аппаратов химической технологии. - Л.: Химия, 1991. - 352с.
2. Павлов К.Ф., Романков П.Г., Носков А.А. Примеры и задачи по курсу процессов и аппаратов химической технологии. - Л.: Химия, 2006. - 576с.
3. Плановский А.Н., Рамм В.М., Каган С.З. Процессы и аппараты химической технологии. М.: Госхимиздат, 1962. - 546 с.
4. Электронный ресурс - http://spetsmashservis. narod.ru/katalog_kolon.html
2. Свойства бинарной смеси
3.1 Производительность колонны по дистилляту и кубовому остатку
4. Определение скорости пара и диаметра колонны
4.2 Определение диаметра колонны
6. Определение числа тарелок и высоты колонны
1. Производительность по исходной смеси F=6 кг/с.
3. Давление в паровом пространстве дефлегматора 0,25 МПа.
4. Тип ректификационной колонны - тарельчатый, тип тарелки - ситчатый.
5. Исходная смесь перед подачей в колонну нагревается до температуры кипения насыщенным водяным паром давлением 0,25 МПа.
Введение
Ректификационные установки по принципу действия делятся на периодические и непрерывные. В установках непрерывного действия разделяемая сырая смесь поступает в колонну и продукты разделения выводятся из нее непрерывно. В установках периодического действия разделяемую смесь загружают в куб одновременно и ректификацию проводят до получения продуктов заданного конечного состава .
При разработке ректификационной колонны с ситчатыми тарелками необходимо, как правило, решать задачи:
2) анализ тепловых процессов, осуществляющихся в греющем паре куба колонны;
3) конструирование ректификационной колонны с ситчатыми тарелками.
1. Общие сведения о ректификации
Ректификация - массообменный процесс разделения однородной смеси летучих компонентов, осуществляемый путем противоточного многократного взаимодействия паров, образующихся при перегонке, с жидкостью, образующейся при конденсации этих паров.
Разделение жидкой смеси основано на различной летучести веществ. При ректификации исходная смесь делится на две части: дистиллят - смесь, обогащенную низкокипящим компонентом (НК), и кубовый остаток - смесь, обогащенную высококипящим компонентом (ВК).
Процесс ректификации осуществляется в ректификационной установке основным аппаратом, которой является ректификационная колонна, в которой пары перегоняемой жидкости поднимаются снизу, а навстречу парам стекает жидкость, подаваемая в виде флегмы в верхнюю часть аппарата.
Процесс ректификации может протекать при атмосферном давлении, а также при давлениях выше и ниже атмосферного. Под вакуумом ректификацию проводят, когда разделению подлежат высококипящие жидкие смеси. Повышенное давление применяют для разделения смесей, находящихся в газообразном состоянии при более низком давлении. Атмосферное давление принимают при разделении смесей, имеющих температуру кипения от 30 до 150°С.
Степень разделения смеси жидкостей на составляющие компоненты и чистота получаемых дистиллята и кубового остатка зависят от того, насколько развита поверхность контакта фаз, от количества подаваемой на орошение флегмы и устройства ректификационной колонны.
В промышленности применяют тарельчатые, насадочные, пленочные трубчатые и центробежные пленочные аппараты. Они различаются в основном конструкцией внутреннего устройства аппарата, назначение которого - обеспечение взаимодействия жидкости и пара.
ацетон вода ректификационная колонна
Преимущественное использование тарельчатых колонн в процессах перегонки объясняется их значительно большей производительностью по сравнению с насадочными.
При выборе ректификационной колонны для проектируемого разделения следует иметь ввиду, что тарельчатые колонны очень малого диаметра значительно дороже соответствующих насадочных колонн, однако по мере увеличения диаметра стоимость насадочных колонн возрастает значительно быстрее. Приблизительно можно считать, что стоимость насадочной колонны растет пропорционально квадрату диаметра, а колпачковой - диаметру в первой степени. Следовательно, за пределами некоторого граничного значения диаметра использование тарельчатых колонн должно быть более экономичным.
Длительный опыт промышленной эксплуатации насадочных колонн показал целесообразность их использования при диаметрах не более 0,8 м. При дальнейшем увеличении диаметра насадочной колонны ухудшается равномерное распределение флегмы по насадке, образуются каналы, по которым преимущественно устремляется флегма, и эффективность колонны резко снижается.
Наиболее распространены колпачковые тарельчатые колонны, хотя в последнее время получили преимущество ситчатые, клапанные, чешуйчатые и другие более эффективные виды барботажных устройств, главным назначением которых является максимальное развитие межфазного контакта, что способствует интенсификации массообмена между парами и флегмой. Помимо этого выбор типа контактного устройства определяется и такими факторами, как экономия материала, стоимость, легкость изготовления, чистки и ремонта, стойкость к коррозии, малое падение напора при прохождении паров, широта диапазона устойчивой работы тарелки .
Ректификационная колонна - аппарат, предназначенный для разделения жидких смесей, составляющие которых имеют различную температуру кипения. Классическая колонна представляет собой вертикальный цилиндр с контактными устройствами внутри.
Ректификация известна с начала XIX века как один из важнейших технологических процессов главным образом спиртовой и нефтяной промышленности. В настоящее время ректификацию все шире применяют в самых различных областях химической технологии, где выделение компонентов в чистом виде имеет весьма важное значение (в производствах органического синтеза, изотопов, полимеров, полупроводников и различных других веществ высокой чистоты).
В ректификационную колонну подаются пары перегоняемой жидкости. Они поднимаются снизу, а в режиме противотока навстречу парам идёт жидкость, сконденсировавшаяся наверху в холодильнике. В случае, если разгоняемый продукт состоит из двух компонентов, конечными продуктами являются дистиллят, выходящий из верхней части колонны и кубовый остаток (менее летучий компонент в жидком виде, вытекающий из нижней части колонны). Ситуация усложняется, если необходимо разделить смесь, состоящую из большого количества фракций. В этом случае используются аппараты, подобные изображенному на картинке.
Ректификационные установки по принципу действия делятся на периодические и непрерывные. В установках непрерывного действия разделяемая сырая смесь поступает в колонну и продукты разделения выводятся из нее непрерывно. В установках периодического действия разделяемую смесь загружают в куб одновременно и ректификацию проводят до получения продуктов заданного конечного состава.
Промышленные ректификационные колонны могут достигать 60 метров в высоту и 6 метров диаметре. В ректификационных колоннах в качестве контактных устройств применяются тарелки, которые дали название химическому термину, и насадки. Насадка, заполняющая колонну, может представлять из себя металлические, керамические, стеклянные и другие элементы различной формы. Конденсация осуществляется на развитой поверхности этих элементов.
2. Свойства бинарной смеси1. Ацетон (диметилкетон, систематическое наименование: пропаноон-2) - простейший представитель кетонов . Формула: CH 3 -C (O) - CH 3 . Бесцветная легкоподвижная летучая жидкость с характерным запахом . Он полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и _25D0_25BB_25D1_258E_25D0_25BB_25D0_25BE_25D0_25B7_25D0_25B0" title="Нитроцеллюлоза">нитроцеллюлозу , жиры, воск , резину и др.), а также ряд солей (хлорид кальция, B_25D0_25B8_25D1_258F" title="Иодид калия">иодид калия). Является одним из метаболитов, производимых человеческим организмом. Мировое производство ацетона составляет более 3-х миллионов тонн в год. В промышленности получается напрямую или косвенно из пропена .
Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Алкилированием бензолапропеном , окислением полученного кумола до гидропероксида с последующим разложением его на фенол и ацетон.
C 6 H 6 + CH 3 CH=CH 2 → C 6 H 5 CH (CH 3) 2
C 6 H 5 CH (CH 3) 2 + O 2 → C 6 H 5 C (OOH) (CH 3) 2
C 6 H 5 C (OOH) (CH 3) 2 → C 6 H 5 OH + OC (CH 3) 2
Прямым окислением пропена в жидкой фазе в присутствии PdCl 2 в среде растворов солей Pd, Cu, Fe при 50-120°C и 50-100 атм.
CH 3 CH=CH 2 + PdCl 2 + H 2 O → CH 3 C (O) CH 3 + Pd + 2HCl
Pd+2HCl + 0.5O 2 → PdCl 2 + H 2 O
Некоторое значение имеет метод брожения крахмала под действием Bacyllus acetobutylicus с образованием ацетона и бутанола . Метод характеризуется малыми выходами. Используется также методы получения из изопропилового спирта и ацетилена .
Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение
CH 3 C (O) CH 3 + NaHSO 3 → (CH 3) 2 C (OH) - SO 3 Na
Вступает в альдольную самоконденсацию под действием щелочей, с образованием диацетонового спирта.
2CH 3 C (O) CH 3 → (CH 3) 2 C (OH) CH 2 C (O) CH 3
CH 3 C (O) CH 3 → CH 2 =C=O
Легко присоединяет циановодород с образованием ацетонциангидрина.
CH 3 C (O) CH 3 + HCN → (CH 3) 2 C (OH) CN
Атомы водорода в ацетоне легко замещаются на галогены . Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
Ацетон, как и другие кетоны, в щелочной среде способен изомерироваться в пропаналь, последний - до пропенового спирта. В кислой среде и в присутствии ионов двухвалентной ртути, пропеновый спирт изомерируется сразу в ацетон. Между этими веществами всегда существует таутомерное равновесие:
CH 3 C (O) CH 3 ↔ С 2 Н 5 СОН ↔ СН 2 =С (ОН) - СН 3
В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи - 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона. Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое - с мочой.
Сырьё для синтеза многих важных химических продуктов: __25D0_25B0_25D0_25BD_25D0_25B3_25D0_25B8_25D0_25B4_25D1_2580_25D0_25B8_25D0_25B4" title="Уксусный ангидрид">уксусного ангидрида , кетена, 0_25BE_25D0_25BD_25D0_25BE_25D0_25B0184B821CB" title="Диацетоновый спирт (страница отсутствует)">диацетонового спирта , окиси мезитила,0_25B7_25D0_25BE_25D0_25B1_25D1_2580B6408A112" title="Метилизобутилкетон (страница отсутствует)">метилизобутилкетона , метилметакрилата, 0_25BB_25D0_25BF_25D1_2580_25D0_25BE_25D0_25BF_25D0_25B0_25D0_25BD&action=edit&redlink=1" title="Дифенилпропан (страница отсутствует)">дифенилпропана , изофорона, 0" title="Бифенол А">бифенола А и др.;
(CH 3) 2 CO + 2 C 6 H 5 OH → (CH 3) 2 C (C 6 H 4 OH) 2 + H 2 O
2. Вода - оксид водорода - одно из наиболее распространенных и важных веществ. Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой воды в природе нет, - она всегда содержит примеси. Получают чистую воду методом перегонки. Перегнанная вода называется дистиллированной. Состав воды (по массе): 11,19 % водорода и 88,81 % кислорода.
Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0° С (1 г/см 3). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0° С и кипит при 100° С при давлении 101 325 Па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода - хороший растворитель. Молекула воды имеет угловую форму атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды - диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, - отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
В жидкой воде наряду с обычными молекулами Н 2 0 содержатся ассоциированные молекулы, т.е. соединенные в более сложные агрегаты (Н 2 О) x благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств: максимальная плотность при 4° С, высокая температура кипения (в ряду Н 2 0-Н 2 S - Н 2 Sе) аномально высокая теплоемкость . С повышением температуры водородные связи разрываются, и полный разрыв наступает при переходе воды в пар.
Вода - весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения - кристаллогидраты.
Очевидно, соединения, связывающие воду, могут служить в качестве осушителей. Из других осушающих веществ можно указать Р 2 0 5 , СаО, ВаО, металлический Ма (они тоже химически взаимодействуют с водой), а также силикагель.
К важным химическим свойствам воды относится ее способность вступать в реакции гидролитического разложения .
Таблица 1. Равновесный состав смеси ацетон-вода
| x | 0 | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | Азеотропная смесь |
| t | 0 | 60,3 | 72 | 80,3 | 82,7 | 84,2 | 85,5 | 86,9 | 88,2 | 90,4 | 94,3 | 100 | - |
| y | 100 | 77,9 | 69,6 | 64,5 | 62,6 | 61,6 | 60,7 | 59,8 | 59 | 58,2 | 57,5 | 56,9 | - |
Рис.1. Диаграмма t-x,y для смеси ацетон - вода.
3. Материальный баланс колонны 3.1 Производительность колонны по дистилляту и кубовому остатку
Таблица 2. Температуры кипения и молекулярные массы разделяемых компонентов
| МВ, кг/кмоль | ||
| ацетон | 56 | |
| вода | 100 |
Обозначим массовый расход дистиллята G D кг/с, кубового остатка через G W кг/с, тогда
![]() ,
,
, ![]()
Питание: 
Дистиллят: 
Кубовый остаток: 
Относительный мольный расход питания
3.2 Расчет оптимального флегмового числа

Рис.2. Кривые равновесия при П=760 мм рт. ст.:
1 - ацетон-вода; 2 - четыреххлористый углерод-ацетон.
Минимальное число флегмы

Где =0,76 - мольную долю ацетона в равновесном с жидкостью питания, определяем по диаграмме - х. Рабочее число флегмы
Уравнения рабочих линий
а) верхней (укрепляющей) части колонны
б) нижней (исчерпывающей) части колонны
4. Определение скорости пара и диаметра колонны 4.1 Определение скорости пара в колонне
Средние концентрации жидкости
а) в верхней части колонны
б) в нижней части колонны
Средние уравнения пара находим по уравнениям рабочих линий:
а) в верхней части колонны
б) в нижней части колонны
Средние температуры пара определяем по диаграмме t-x,y:
Средние мольные массы и плотности пара:


Средняя плотность пара в колонне
Температура в верху колонны при x D =0,83 равняется 57 о С, а в кубе-испарителе при x W =0,008 она равна 97 о С.
Плотность жидкого ацетона при 57 о С ![]() , а воды при 97 о С
, а воды при 97 о С
![]() .
.
Принимаем среднюю плотность жидкости в колонне
![]()
Определяем скорость пара в колонне
 ,
,
где С - коэффициент, зависящий от конструкции тарелок, расстояния между тарелками, рабочего давления в колонне, нагрузки колонны по жидкости.
Объемный расход проходящего через колонну пара при средней температуре
![]()
Где М D - мольная масса дистиллята, равная:
4.2 Определение диаметра колонныДиаметр колонны

По каталогу-справочнику "Колонные аппараты" D=800 мм. Тогда скорость пара в колонне будет

По ОСТ 26-01-108-85 определяем:
Диаметр колонны - 800 мм.
Расстояние между тарелками - 300 мм.
Высота сливного порога - 25 мм.
Диаметр отверстия - 5 мм.
Шаг - 15 мм.
Исполнение - 1.
Материал для изготовления - углеродистая сталь ВСт3сп.
5. Гидравлический расчет тарелок
Принимаем следующие размеры ситчатой тарелки: диаметр отверстий d 0 = 5мм , высота сливной перегородки h п = 25мм . Свободное сечение тарелки 8% от общей площади тарелки. Площадь, занимаемая двумя сегментными переливными стаканами, составляет 20% от общей площади тарелки. Гидравлическое сопротивление тарелки в верхней и нижней части колонны по уравнению:
а) Верхняя часть колонны. Гидравлическое сопротивление сухой тарелки
![]()
где =1,82 - коэффициент сопротивления неорошаемых
ситчатых тарелок со свободным сечением 7 - 10%; ![]() - скорость пара в отверстиях
тарелки. Сопротивление, обусловленное силами поверхностного натяжения
- скорость пара в отверстиях
тарелки. Сопротивление, обусловленное силами поверхностного натяжения

где =Н/м - поверхностное натяжение жидкости при средней температуре в верхней части колонны; d Э = d 0 =0,005м .
Сопротивление парожидкостного слоя на тарелке
Высота парожидкостного слоя
![]()
Величина Δh - высоту слоя над сливной перегородкой рассчитываем по формуле

где V Ж - объемный расход жидкости, м 3 /с ; П - периметр сливной перегородки, м ; - отношение плотности парожидкостного слоя (пены) к плотности жидкости, принимаемое приближенно равным 0,5.
Объемный расход жидкости в верхней части колонны
где - средняя мольная масса жидкости.
Периметр сливной перегородки П находим, решая систему уравнений

![]()
где R =0,2м - радиус тарелки; 2/3П b - приближенное значение площади сегмента.
Находим, что П =0,294м ; b =0,064м .

Высота парожидкостного слоя на тарелке
Сопротивление парожидкостного слоя
Общее гидравлическое сопротивление тарелки
б) Нижняя часть колонны
Введение
1. Общие сведения о ректификации
2. Свойства бинарной смеси
3. Материальный баланс колонны
3.1 Производительность колонны по дистилляту и кубовому остатку
3.2 Расчет оптимального флегмового числа
4. Определение скорости пара и диаметра колонны
4.1 Определение скорости пара в колонне
4.2 Определение диаметра колонны
5. Гидравлический расчет тарелок
6. Определение числа тарелок и высоты колонны
6.1 Расчет к. п. д. тарелок
6.2 Расчет числа тарелок
7. Тепловой расчет установки
Заключение
Список использованной литературы
Задание на проектирование
Производительность по исходной смеси F=6 кг/с.
Давление в паровом пространстве дефлегматора 0,25 МПа.
Тип ректификационной колонны - тарельчатый, тип тарелки - ситчатый.
Исходная смесь перед подачей в колонну нагревается до температуры кипения насыщенным водяным паром давлением 0,25 МПа.
Введение
Ректификационные установки по принципу действия делятся на периодические и непрерывные. В установках непрерывного действия разделяемая сырая смесь поступает в колонну и продукты разделения выводятся из нее непрерывно. В установках периодического действия разделяемую смесь загружают в куб одновременно и ректификацию проводят до получения продуктов заданного конечного состава .
При разработке ректификационной колонны с ситчатыми тарелками необходимо, как правило, решать задачи:
анализ тепловых процессов, осуществляющихся в греющем паре куба колонны;
конструирование ректификационной колонны с ситчатыми тарелками.
1. Общие сведения о ректификации
Ректификация - массообменный процесс разделения однородной смеси летучих компонентов, осуществляемый путем противоточного многократного взаимодействия паров, образующихся при перегонке, с жидкостью, образующейся при конденсации этих паров.
Разделение жидкой смеси основано на различной летучести веществ. При ректификации исходная смесь делится на две части: дистиллят - смесь, обогащенную низкокипящим компонентом (НК), и кубовый остаток - смесь, обогащенную высококипящим компонентом (ВК).
Процесс ректификации осуществляется в ректификационной установке основным аппаратом, которой является ректификационная колонна, в которой пары перегоняемой жидкости поднимаются снизу, а навстречу парам стекает жидкость, подаваемая в виде флегмы в верхнюю часть аппарата.
Процесс ректификации может протекать при атмосферном давлении, а также при давлениях выше и ниже атмосферного. Под вакуумом ректификацию проводят, когда разделению подлежат высококипящие жидкие смеси. Повышенное давление применяют для разделения смесей, находящихся в газообразном состоянии при более низком давлении. Атмосферное давление принимают при разделении смесей, имеющих температуру кипения от 30 до 150°С.
Степень разделения смеси жидкостей на составляющие компоненты и чистота получаемых дистиллята и кубового остатка зависят от того, насколько развита поверхность контакта фаз, от количества подаваемой на орошение флегмы и устройства ректификационной колонны.
В промышленности применяют тарельчатые, насадочные, пленочные трубчатые и центробежные пленочные аппараты. Они различаются в основном конструкцией внутреннего устройства аппарата, назначение которого - обеспечение взаимодействия жидкости и пара.
ацетон вода ректификационная колонна
Преимущественное использование тарельчатых колонн в процессах перегонки объясняется их значительно большей производительностью по сравнению с насадочными.
При выборе ректификационной колонны для проектируемого разделения следует иметь ввиду, что тарельчатые колонны очень малого диаметра значительно дороже соответствующих насадочных колонн, однако по мере увеличения диаметра стоимость насадочных колонн возрастает значительно быстрее. Приблизительно можно считать, что стоимость насадочной колонны растет пропорционально квадрату диаметра, а колпачковой - диаметру в первой степени. Следовательно, за пределами некоторого граничного значения диаметра использование тарельчатых колонн должно быть более экономичным.
Длительный опыт промышленной эксплуатации насадочных колонн показал целесообразность их использования при диаметрах не более 0,8 м. При дальнейшем увеличении диаметра насадочной колонны ухудшается равномерное распределение флегмы по насадке, образуются каналы, по которым преимущественно устремляется флегма, и эффективность колонны резко снижается.
Наиболее распространены колпачковые тарельчатые колонны, хотя в последнее время получили преимущество ситчатые, клапанные, чешуйчатые и другие более эффективные виды барботажных устройств, главным назначением которых является максимальное развитие межфазного контакта, что способствует интенсификации массообмена между парами и флегмой. Помимо этого выбор типа контактного устройства определяется и такими факторами, как экономия материала, стоимость, легкость изготовления, чистки и ремонта, стойкость к коррозии, малое падение напора при прохождении паров, широта диапазона устойчивой работы тарелки .
Ректификационная колонна - аппарат, предназначенный для разделения жидких смесей, составляющие которых имеют различную температуру кипения. Классическая колонна представляет собой вертикальный цилиндр с контактными устройствами внутри.
Ректификация известна с начала XIX века как один из важнейших технологических процессов главным образом спиртовой и нефтяной промышленности. В настоящее время ректификацию все шире применяют в самых различных областях химической технологии, где выделение компонентов в чистом виде имеет весьма важное значение (в производствах органического синтеза, изотопов, полимеров, полупроводников и различных других веществ высокой чистоты).
В ректификационную колонну подаются пары перегоняемой жидкости. Они поднимаются снизу, а в режиме противотока навстречу парам идёт жидкость, сконденсировавшаяся наверху в холодильнике. В случае, если разгоняемый продукт состоит из двух компонентов, конечными продуктами являются дистиллят, выходящий из верхней части колонны и кубовый остаток (менее летучий компонент в жидком виде, вытекающий из нижней части колонны). Ситуация усложняется, если необходимо разделить смесь, состоящую из большого количества фракций. В этом случае используются аппараты, подобные изображенному на картинке.
Ректификационные установки по принципу действия делятся на периодические и непрерывные. В установках непрерывного действия разделяемая сырая смесь поступает в колонну и продукты разделения выводятся из нее непрерывно. В установках периодического действия разделяемую смесь загружают в куб одновременно и ректификацию проводят до получения продуктов заданного конечного состава.
Промышленные ректификационные колонны могут достигать 60 метров в высоту и 6 метров диаметре. В ректификационных колоннах в качестве контактных устройств применяются тарелки, которые дали название химическому термину, и насадки. Насадка, заполняющая колонну, может представлять из себя металлические, керамические, стеклянные и другие элементы различной формы. Конденсация осуществляется на развитой поверхности этих элементов.
2. Свойства бинарной смеси
1. Ацетон (диметилкетон, систематическое наименование: пропаноон-2) - простейший представитель кетонов. Формула: CH3-C (O) - CH3. Бесцветная легкоподвижная летучая жидкость с характерным запахом. Он полностью смешивается с водой и большинством органических растворителей. Ацетон хорошо растворяет многие органические вещества (ацетилцеллюлозу и нитроцеллюлозу, жиры, воск, резину и др.), а также ряд солей (хлорид кальция, иодид калия). Является одним из метаболитов, производимых человеческим организмом. Мировое производство ацетона составляет более 3-х миллионов тонн в год. В промышленности получается напрямую или косвенно из пропена.
Основную часть ацетона получают как сопродукт при получении фенола из бензола по кумольному способу. Алкилированием бензолапропеном, окислением полученного кумола до гидропероксида с последующим разложением его на фенол и ацетон.
C6H6+ CH3CH=CH2 → C6H5CH (CH3) 2
C6H5CH (CH3) 2 + O2 → C6H5C (OOH) (CH3) 2
C6H5C (OOH) (CH3) 2 → C6H5OH + OC (CH3) 2
Прямым окислением пропена в жидкой фазе в присутствии PdCl2 в среде растворов солей Pd, Cu, Fe при 50-120°C и 50-100 атм.
CH3CH=CH2 + PdCl2 + H2O → CH3C (O) CH3 + Pd + 2HCl
Pd+2HCl + 0.5O2 → PdCl2 + H2O
Некоторое значение имеет метод брожения крахмала под действием Bacyllus acetobutylicus с образованием ацетона и бутанола. Метод характеризуется малыми выходами. Используется также методы получения из изопропилового спирта и ацетилена.
Ацетон является одним из наиболее реакционноспособных кетонов. Так, он один из немногих кетонов образует бисульфитное соединение
CH3C (O) CH3 + NaHSO3 → (CH3) 2C (OH) - SO3Na
Вступает в альдольную самоконденсацию под действием щелочей, с образованием диацетонового спирта.
2CH3C (O) CH3 → (CH3) 2C (OH) CH2C (O) CH3
Восстанавливается цинком до пинакона.
2CH3C (O) CH3 + Zn → (CH3) 2C (OH) C (OH) (CH3) 2
При пиролизе (700°C) образует кетен.
CH3C (O) CH3 → CH2=C=O
Легко присоединяет циановодород с образованием ацетонциангидрина.
CH3C (O) CH3 + HCN → (CH3) 2C (OH) CN
Атомы водорода в ацетоне легко замещаются на галогены. Под действием хлора (иода) в присутствии щёлочи образует хлороформ (йодоформ).
Ацетон, как и другие кетоны, в щелочной среде способен изомерироваться в пропаналь, последний - до пропенового спирта. В кислой среде и в присутствии ионов двухвалентной ртути, пропеновый спирт изомерируется сразу в ацетон. Между этими веществами всегда существует таутомерное равновесие:
CH3C (O) CH3 ↔ С2Н5СОН ↔ СН2=С (ОН) - СН3
В крови в норме содержится 1-2 мг/100 мл ацетона, в суточном количестве мочи - 0,01-0,03 г. При нарушениях обмена веществ, например, при сахарном диабете, в моче и крови повышается содержание ацетона. Незначительная часть ацетона превращается в оксид углерода (IV), который выделяется с выдыхаемым воздухом. Некоторое количество ацетона выделяется из организма в неизменном виде с выдыхаемым воздухом и через кожу, а некоторое - с мочой.
Сырьё для синтеза многих важных химических продуктов: уксусного ангидрида, кетена, диацетонового спирта, окиси мезитила,метилизобутилкетона, метилметакрилата, дифенилпропана, изофорона, бифенола А и др.;
(CH3) 2CO + 2 C6H5OH → (CH3) 2C (C6H4OH) 2 + H2O
2. Вода - оксид водорода - одно из наиболее распространенных и важных веществ. Поверхность Земли, занятая водой, в 2,5 раза больше поверхности суши. Чистой воды в природе нет, - она всегда содержит примеси. Получают чистую воду методом перегонки. Перегнанная вода называется дистиллированной. Состав воды (по массе): 11,19 % водорода и 88,81 % кислорода.
Чистая вода прозрачна, не имеет запаха и вкуса. Наибольшую плотность она имеет при 0° С (1 г/см3). Плотность льда меньше плотности жидкой воды, поэтому лед всплывает на поверхность. Вода замерзает при 0° С и кипит при 100° С при давлении 101 325 Па. Она плохо проводит теплоту и очень плохо проводит электричество. Вода - хороший растворитель. Молекула воды имеет угловую форму атомы водорода по отношению к кислороду образуют угол, равный 104,5°. Поэтому молекула воды - диполь: та часть молекулы, где находится водород, заряжена положительно, а часть, где находится кислород, - отрицательно. Благодаря полярности молекул воды электролиты в ней диссоциируют на ионы.
В жидкой воде наряду с обычными молекулами Н20 содержатся ассоциированные молекулы, т.е. соединенные в более сложные агрегаты (Н2О) x благодаря образованию водородных связей. Наличием водородных связей между молекулами воды объясняются аномалии ее физических свойств: максимальная плотность при 4° С, высокая температура кипения (в ряду Н20-Н2S - Н2Sе) аномально высокая теплоемкость . С повышением температуры водородные связи разрываются, и полный разрыв наступает при переходе воды в пар.
Вода - весьма реакционноспособное вещество. При обычных условиях она взаимодействует со многими основными и кислотными оксидами, а также со щелочными и щелочно-земельными металлами. Вода образует многочисленные соединения - кристаллогидраты.
Очевидно, соединения, связывающие воду, могут служить в качестве осушителей. Из других осушающих веществ можно указать Р205, СаО, ВаО, металлический Ма (они тоже химически взаимодействуют с водой), а также силикагель.
К важным химическим свойствам воды относится ее способность вступать в реакции гидролитического разложения .
Таблица 1. Равновесный состав смеси ацетон-вода
| x | 0 | 5 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 | Азеотропная смесь |
| t | 0 | 60,3 | 72 | 80,3 | 82,7 | 84,2 | 85,5 | 86,9 | 88,2 | 90,4 | 94,3 | 100 | - |
| y | 100 | 77,9 | 69,6 | 64,5 | 62,6 | 61,6 | 60,7 | 59,8 | 59 | 58,2 | 57,5 | 56,9 | - |
Рис.1.
Диаграмма t-x,y
для смеси ацетон
- вода.
3. Материальный баланс колонны
3.1 Производительность колонны по дистилляту и кубовому остатку
Таблица 2. Температуры кипения и молекулярные массы разделяемых компонентов
Обозначим массовый расход дистиллята GD кг/с, кубового остатка через GW кг/с, тогда
![]() ,
,
,
![]()
Питание:

Дистиллят:

Кубовый
остаток:

Относительный мольный расход питания
3.2 Расчет оптимального флегмового числа

Рис.2. Кривые равновесия при П=760 мм рт. ст.:
1 - ацетон-вода; 2 - четыреххлористый углерод-ацетон.
Минимальное число флегмы

Где =0,76 - мольную долю ацетона в равновесном с жидкостью питания, определяем по диаграмме - х. Рабочее число флегмы
Уравнения рабочих линий
а) верхней (укрепляющей) части колонны
б) нижней (исчерпывающей) части колонны
4. Определение скорости пара и диаметра колонны
4.1 Определение скорости пара в колонне
Средние концентрации жидкости
а) в верхней части колонны
б) в нижней части колонны
Средние уравнения пара находим по уравнениям рабочих линий:
а) в верхней части колонны
б) в нижней части колонны
Средние температуры пара определяем по диаграмме t-x,y:
б) при
![]()
Средние мольные массы и плотности пара:


Средняя плотность пара в колонне
Температура в верху колонны при xD=0,83 равняется 57оС, а в кубе-испарителе при xW=0,008 она равна 97оС.
Плотность
жидкого ацетона
при 57оС
![]() ,
а воды при 97оС
,
а воды при 97оС
![]() .
.
Принимаем среднюю плотность жидкости в колонне
![]()
Определяем скорость пара в колонне
 ,
,
где С - коэффициент, зависящий от конструкции тарелок, расстояния между тарелками, рабочего давления в колонне, нагрузки колонны по жидкости.
Объемный расход проходящего через колонну пара при средней температуре

Где МD - мольная масса дистиллята, равная:
4.2 Определение диаметра колонны
Диаметр колонны

По каталогу-справочнику "Колонные аппараты" D=800 мм. Тогда скорость пара в колонне будет

По ОСТ 26-01-108-85 определяем:
Диаметр колонны - 800 мм.
Расстояние между тарелками - 300 мм.
Высота сливного порога - 25 мм.
Диаметр отверстия - 5 мм.
Шаг - 15 мм.
Исполнение - 1.
Материал для изготовления - углеродистая сталь ВСт3сп.
5. Гидравлический расчет тарелок
Принимаем следующие размеры ситчатой тарелки: диаметр отверстий d0=5мм, высота сливной перегородки hп=25мм. Свободное сечение тарелки 8% от общей площади тарелки. Площадь, занимаемая двумя сегментными переливными стаканами, составляет 20% от общей площади тарелки. Гидравлическое сопротивление тарелки в верхней и нижней части колонны по уравнению:
а) Верхняя часть колонны. Гидравлическое сопротивление сухой тарелки

где
=1,82
- коэффициент
сопротивления
неорошаемых
ситчатых тарелок
со свободным
сечением 7 - 10%;
 - скорость пара
в отверстиях
тарелки. Сопротивление,
обусловленное
силами поверхностного
натяжения
- скорость пара
в отверстиях
тарелки. Сопротивление,
обусловленное
силами поверхностного
натяжения

где =Н/м - поверхностное натяжение жидкости при средней температуре в верхней части колонны; dЭ=d0=0,005м.
Сопротивление парожидкостного слоя на тарелке
Высота парожидкостного слоя
![]()
Величина Δh - высоту слоя над сливной перегородкой рассчитываем по формуле

где VЖ - объемный расход жидкости, м3/с; П - периметр сливной перегородки, м; - отношение плотности парожидкостного слоя (пены) к плотности жидкости, принимаемое приближенно равным 0,5.
Объемный расход жидкости в верхней части колонны
где - средняя мольная масса жидкости.
Периметр сливной перегородки П находим, решая систему уравнений

![]()
где R=0,2м - радиус тарелки; 2/3Пb - приближенное значение площади сегмента.
Находим, что П=0,294м; b=0,064м.

Высота парожидкостного слоя на тарелке
Сопротивление парожидкостного слоя
Общее гидравлическое сопротивление тарелки
б) Нижняя часть колонны


С пособы разделения смесей (и гетерогенных, и гомогенных) основаны на том факте, что вещества, входящие в состав смеси, сохраняют свои индивидуальные свойства. Гетерогенные смеси могут различаться по составу и фазовому состоянию, например: газ+жидкость; твердое вещество+жидкость; две несмешивающиеся жидкости и др. Основные способы разделения смесей представлены на схеме ниже. Рассмотрим каждый способ отдельно.
Разделение гетерогенных смесей
Для разделения гетерогенных смесей, представляющих собой системы твердое тело- жидкость или твердое тело - газ, выделяют три основных способа:
- фильтрование,
- отстаивание (декантирование,
- магнитная сепарацияю
ФИЛЬТРОВАНИЕ
метод основанный на различной растворимости веществ и разных размерах частиц компонентов смеси. Фильтрование позволяет отделить твердое вещество от жидкости или газа.
Для фильтрования жидкостей можно использовать фильтровальную бумагу, которую обычно складывают в четверо и вставляют в стеклянную воронку. Воронку помещают в стакана, в который скапливается фильтрат - жидкость, прошедшая через фильтр.
Размер пор в фильтровальной бумаге таков, что позволяет молекулам воды и молекулам растворенного вещества беспрепятственно просачиваться. Частицы размером больше 0,01мм задерживаются на фильтре и не проходят сквозь него, таким образом формируется слой осадка.
Запомни! С помощью фильтрования нельзя разделить истинные растворы веществ, то есть растворы, в которых растворение произошло на уровне молекул или ионов.
Кроме фильтровальной бумаги в химических лабораториях используют специальные фильтры с
разным размером пор.
Фильтрование газовых смесей принципиально не отличается от фильтрования жидкостей. Разница заключается только в том, что при фильтровании газов от твердых взвешенных частиц (ТВЧ) используются фильтры специальных конструкций (бумажный, угольный) и насосы для принудительного прокачивания газовой смеси через фильтр, например фильтрация воздуха в салоне автомобиля или вытяжка над плитой.
Фильтрованием можно разделить :
- крупы и воду,
- мел и воду,
- песок и воду и т.д.
- пыль и воздух (различные конструкции пылесосов)
ОТСТАИВАНИЕ
Метод основан на различной скорости оседания твердых частиц с разным весом (плотностью) в жидкой или воздушной среде. Метод используют для разделения двух и более твердых нерастворимых веществ в воде (или другом растворителе). Смесь нерастворимых веществ помещают в воду, тщательно перемешивают. Спустя некоторое время вещества с плотностью больше единицы оседают на дно сосуда, а вещества с плотностью меньше единицы - всплывают. Если в смеси находится несколько веществ с разной силой тяжести, то в нижнем слое будут отстаиваться более тяжелые вещества, а затем более легкие. Такие слои тоже можно разделить. Раньше так выделяли крупинки золота из измельченной золотоносной породы. Золотоносный песок помещали на наклонный желоб, по которому пускали струю воды. Поток воды подхватывал и уносил пустую породу, а тяжелые крупинки золота оседали на дне желоба. В случае газовых смесей также происходит оседание твердых частиц на твердых поверхностях, например оседание пыли на мебели или листьях растений.
Данным методом можно разделять и несмешивающиеся жидкости. Для этого используют делительную воронку.
Например для разделения бензина и воды, смесь помещают в делительную воронку, ждут момента, пока не появится четкая граница раздела фаз. После чего аккуратно открывают краник и в стакан стекает вода.
Отстаиванием можно разделить смеси :
- речного песка и глины,
- тяжелого кристаллического осадка от раствора
- нефти и воды
- растительного масла и воды и т.д.
МАГНИТНАЯ СЕПАРАЦИЯ
Метод основан на разных магнитных свойствах твердых компонентов смеси. Данный метод используют при наличии в смеси веществ-ферромагнетиков, то есть веществ, обладающих магнитными свойствами, например железа.
Все вещества, по отношению к магнитному полю, условно можно разделить на три большие группы:
- феромагнетики : притягиваются магнитом-Fe, Co, Ni, Gd, Dy
- парамагнетики : слабо притягиваются-Al, Cr, Ti, V, W, Mo
- диамагнетики : оттлакиваются от магнита-Cu, Ag, Au, Bi, Sn, латунь
Магнитной сепарацией можно разделит ь:
- порошок серы и железа
- сажу и железо и т.д.
Разделение гомогенных смесей
Для разделения жидких гомогенных смесей (истинных растворов) используют следующие методы:
- выпаривание (кристаллизация),
- дистилляция (перегонка),
- хроматография.
ВЫПАРИВАНИЕ. КРИСТАЛЛИЗАЦИЯ.
Метод основан на различных температурах кипения растворителя и растворенного вещества. Используется для выделения растворимых твердых веществ из растворов. Выпаривание обычно проводят следующим образом: раствор наливают в фарфоровую чашку и нагревают ее, постоянно перемешивая раствор. Вода постепенно испаряется и на дне чашки остается твердое вещество.
ОПРЕДЕЛЕНИЕ
Кристаллизация - фазовый переход вещества из газообразного (парообразного), жидкого или твердого аморфного состояния в кристаллическое.
При этом испаренное вещество (воду или растворитель) можно собрать методом конденсирования на более холодной поверхности. Например, если поместить холодное предметное стекло над выпаривательной чашкой, то на его поверхности образуются капли воды. На этом же принципе основан метод дистилляции.
ДИСТИЛЛЯЦИЯ. ПЕРЕГОНКА.
Если вещество, например сахар, разлагается при нагревании, то воду испаряют не полностью – упаривают раствор, а затем из насыщенного раствора осаждают кристаллы сахара. Иногда требуется очистить растворители от примесей, например воду от соли. В этом случае растворитель следует испарить, а затем его пары необходимо собрать и сконденсировать при охлаждении. Такой способ разделения гомогенной смеси называется дистилляцией, или перегонкой.
В природе вода в чистом виде (без солей) не встречается. Океаническая, морская, речная, колодезная и родниковая вода – это разновидности растворов солей в воде. Однако часто людям необходима чистая вода, не содержащая солей (используется в двигателях автомобилей; в химическом производстве для получения различных растворов и веществ; при изготовлении фотографий). Такую воду называют дистиллированной, именно ее применяют в лаборатории для проведения химических опытов.
Перегонкой можно разделить:
- воду и спирт
- нефть (на различные фракции)
- ацетон и воду и т.д.
ХРОМАТОГРАФИЯ
Метод разделения и анализа смесей веществ. Основан на разных скоростях распределения исследуемого вещества между двумя фазами - неподвижной и подвижной (элюент ). Неподвижная фаза, как правило, представляет собой сорбент (мелкодисперсный порошок, например оксид алюминия или оксид цинка или фильтровальная бумага) с развитой поверхностью, а подвижная - поток газа или жидкости. Поток подвижной фазы фильтруется через слой сорбента или перемещается вдоль слоя сорбента, например по поверхности фильтровальной бумаги.
Можно самостоятельно получить хроматограмму и увидеть сущность метода на практике. Нужно смешать несколько чернил и каплю полученной смеси нанести на фильтровальную бумагу. Затем точно в середину цветного пятнышка начнем по каплям приливать чистую воду. Каждую каплю нужно вносить только после того, как впитается предыдущая. Вода играет роль элюэнта, переносящего исследуемое вещество по сорбенту - пористой бумаге. Вещества, входящие в состав смеси, задерживаются бумагой по-разному: одни хорошо удерживаются ею, а другие впитываются медленнее и продолжают некоторое время растекаться вместе с водой. Вскоре по листу бумаги начнет расползаться настоящая красочная хроматограмма: пятно одного цвета в центре, окруженное разноцветными концентрическими кольцами.
Особенно большое распространение получила тонкослойная хроматография, в органическом анализе. Достоинства тонкослойной хроматографии в том, что можно использовать простейший и очень чувствительный метод детектирования – визуальный контроль. Проявлять невидимые глазу пятна можно различными реактивами, а также используя ультрафиолетовый свет или авторадиографию.
В анализе органических и неорганических веществ применяют хроматографию на бумаге. Разработаны многочисленные методы разделения сложных смесей ионов, например смесей редкоземельных элементов, продуктов деления урана, элементов группы платины
СПОСОБЫ РАЗДЕЛЕНИЯ СМЕСЕЙ, ИСПОЛЬЗУЕМЫЕ В ПРОМЫШЛЕННОСТИ.
Способы разделения смесей, используемые в промышленности немногим отличаются от лабораторных способов, описанных выше.
Для разделения нефти чаще всего используют ректификацию (перегонку). Более подробно этот процесс описан в теме "Переработка нефти".
Самыми распространенными методами очистки и разделения веществ в промышленности являются отстаивание, фильтрация, сорбция и экстракция. Методы фильтрации и отстаивания проводятся аналогично лабораторным метода, с той разницей, что используются отстойники и фильтры больших объемов. Чаще всего, эти методы используются для очистки сточных вод. Поэтому рассмотрим подробнее методы экстракции и сорбции.
Термин «экстракция» приложим к различным фазовым равновесиям (жидкость – жидкость, газ – жидкость, жидкость – твердое тело и т.д.), но чаще его применяют к системам жидкость – жидкость, поэтому чаще всего можно встретить такое определение:
ОПРЕДЕЛЕНИЕ
Экстракци я -метод разделения, очистки и выделения веществ, основанный на процессе распределения вещества между двумя несмешивающимися растворителями.
Одним из несмешивающихся растворителей обычно является вода, вторым – органический растворитель, однако это не обязательно. Экстракционный метод отличается универсальностью, он пригоден для выделения почти всех элементов в различных концентрациях. Экстракция позволяет разделять сложные многокомпонентные смеси зачастую эффективнее и быстрее, чем другие методы. Выполнение экстракционного отделения или разделения не требует сложного и дорогостоящего оборудования. Процесс может быть автоматизирован, при необходимости им можно управлять на расстоянии.
ОПРЕДЕЛЕНИЕ
Сорбция - метод выделения и очистки веществ, основанный на поглощении твердым телом (адсорбция) или жидкостью-сорбентом (абсорбция) различных веществ (сорбатов) из газовых или жидких смесей.
Чаще всего в промышленности методы абсорбции используют для очистки газовоздушных выбросов от частиц пыли или дыма, а также токсичных газообразных веществ. В случае поглощения газообразных веществ, между сорбентом и растворенным веществом может протекать химическая реакция. Например, при поглощении газообразного аммиака NH 3 раствором азотной кислоты HNO 3 образуется нитрат аммония NH 4 NO 3 (аммиачная селитра), который можно использовать в качестве высокоэффективного азотного удобрения.