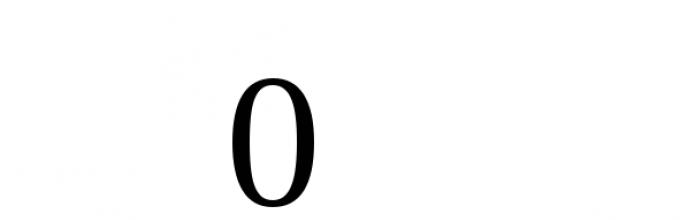Видеокурс «Получи пятерку» включает все темы, необходимые для успешной сдачи ЕГЭ по математике на 60-65 баллов. Полностью все задачи 1-13 Профильного ЕГЭ по математике. Подходит также для сдачи Базового ЕГЭ по математике. Если вы хотите сдать ЕГЭ на 90-100 баллов, вам надо решать часть 1 за 30 минут и без ошибок!
Курс подготовки к ЕГЭ для 10-11 класса, а также для преподавателей. Все необходимое, чтобы решить часть 1 ЕГЭ по математике (первые 12 задач) и задачу 13 (тригонометрия). А это более 70 баллов на ЕГЭ, и без них не обойтись ни стобалльнику, ни гуманитарию.
Вся необходимая теория. Быстрые способы решения, ловушки и секреты ЕГЭ. Разобраны все актуальные задания части 1 из Банка заданий ФИПИ. Курс полностью соответствует требованиям ЕГЭ-2018.
Курс содержит 5 больших тем, по 2,5 часа каждая. Каждая тема дается с нуля, просто и понятно.
Сотни заданий ЕГЭ. Текстовые задачи и теория вероятностей. Простые и легко запоминаемые алгоритмы решения задач. Геометрия. Теория, справочный материал, разбор всех типов заданий ЕГЭ. Стереометрия. Хитрые приемы решения, полезные шпаргалки, развитие пространственного воображения. Тригонометрия с нуля - до задачи 13. Понимание вместо зубрежки. Наглядное объяснение сложных понятий. Алгебра. Корни, степени и логарифмы, функция и производная. База для решения сложных задач 2 части ЕГЭ.
Химия подготовка к ЗНО и ДПА
Комплексное издание
ЧАСТЬ И
ОБЩАЯ ХИМИЯ
ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ ВЕЩЕСТВА
Степень окисления
Степень окисления - это условный заряд на атоме в молекуле или кристалле, который возник на нем, когда бы все полярные связи, созданные им, имели ионный характер.
На отличие от валентности, степени окисления может быть положительным, отрицательным или равняться нулю. В простых ионных соединениях степень окисления совпадает с зарядами ионов. Например, в натрий хлориде
NaCl (Na + Cl - ) Натрий имеет степень окисления +1, а Хлор -1, в кальций оксиде СаО (Са +2 О -2) Кальций проявляет степень окисления +2, а Оксисен - -2. Это правило распространяется на все основные оксиды: степень окисления металлического элемента равен заряду иона металла (Натрия +1, Бария +2, Алюминия +3), а степень окисления Кислорода равна-2. Степень окисления обозначают арабскими цифрами, которые ставят над символом элемента, подобно валентности, причем вначале указывают знак заряда, а потом его численное значение:Если модуль степени окисления равна единице, то число «1» можно не ставить и писать только знак:
Na + Cl - .Степень окисления и валентность - родственные понятия. Во многих соединениях абсолютная величина степени окисления элементов совпадает с их валентностью. Однако существует немало случаев, когда валентность отличается от степени окисления.
В простых веществах - неметалах существует ковалентная неполярная связь, совместная электронная пара смещается к одному из атомов, поэтому степень окисления элементов в простых веществ всегда равна нулю. Но атомы друг с другом связаны, то есть проявляют определенную валентность, как, например, в кислороде валентность Кислорода равна II, а в азоте валентность Азота - III:
В молекуле водород пероксида валентность Кислорода также равна II, а Водорода - И:
Определение возможных степеней окисления элементов
Степени окисление, какие элементы могут проявлять в различных соединениях, в большинстве случаев можно определить по строению внешнего электронного уровня или по местом элемента в Периодической системе.
Атомы металлических элементов могут только отдавать электроны, поэтому в соединениях они проявляют положительные степени окисления. Его абсолютное значение во многих случаях (за исключением d -элементов) равен числу электронов на внешнем уровне, то есть номера группы в Периодической системе. Атомы d -элементов могут также отдавать электроны с передзовнішнього уровня, а именно - с незаполненных d -орбиталей. Поэтому для d -элементов определить все возможные степени окисления значительно сложнее, чем для s - и р-элементов. С уверенностью можно утверждать, что большинство d -элементов проявляют степень окисления +2 благодаря электронам внешнего электронного уровня, а максимальная степень окисления в большинстве случаев равен номеру группы.
Атомы неметаллических элементов могут проявлять как положительные, так и отрицательные степени окисление, в зависимости от того, с атомом какого элемента они образуют связь. Если элемент более электроотрицательным, то он проявляет негативное степень окисления, а если менее электроотрицательный - положительный.
Абсолютное значение степени окисления неметаллических элементов можно определить по строению внешнего электронного слоя. Атом способен принять столько электронов, чтобы на его внешнем уровне расположилось восемь электронов: неметаллические элементы VII группы принимают один электрон и проявляют степень окисления -1, VIгруппы - два электроны и проявляют степень окисления -2 и т.д.
Неметаллические элементы способны отдавать разное число электронов: максимум столько, сколько расположено на внешнем энергетическом уровне. Иначе говоря, максимальный степень окисления неметаллических элементов равна номеру группы. Благодаря промотуванню электронов на внешнем уровне атомов число неспаренных электронов, которые атом может отдавать в химических реакциях, бывает разным, поэтому неметаллические элементы способны обнаруживать различные промежуточные значения степени окисления.
Возможны степени окисления s - и р-элементов
|
Группа ПС |
|||||||
|
Высшую степень окисления |
|||||||
|
Промежуточный степень окисления |
|||||||
|
Ниже степень окисления |
Определение степеней окисления в соединениях
Любая электронейтральная молекула, поэтому сумма степеней окисления атомов всех элементов должна равняться нулю. Определим степень окисления в сульфур(И V ) оксиде SO 2 тауфосфор(V ) сульфіді P 2 S 5 .
Сульфур(И V ) оксид SO 2 образован атомами двух элементов. Из них электроотрицательности большая у Кислорода, поэтому атомы Кислорода будут иметь негативный степень окисления. Для Кислорода он равен-2. В этом случае Сульфур оказывает положительное степень окисления. В различных соединениях Сульфур может проявлять разные степени окисления, поэтому в этом случае его необходимо вычислить. В молекуле SO 2 два атома Кислорода со степенью окисления -2, поэтому общий заряд атомов Кислорода равна-4. Для того, чтобы молекула была електронейтральною, атом Серы имеет полностью нейтрализовать заряд обоих атомов Кислорода, поэтому степень окисления Серы равна +4:
В молекуле фосфор(V ) сульфида P 2 S 5 более електронегативним элементом является Сульфур, то есть он проявляет негативное степень окисления, а Фосфор - положительный. Для Серы негативный степень окисления составляет только 2. Вместе пять атомов Серы несут отрицательный заряд, равный-10. Поэтому два атома Фосфора имеют нейтрализовать этот заряд с общим зарядом +10. Поскольку атомов Фосфора в молекуле два, то каждый должен иметь степень окисления +5:
Сложнее вычислять степень окисления не в бинарных соединениях - солях, основаниях и кислотах. Но для этого также следует воспользоваться принципом электронейтральности, а еще помнить о том, что в большинстве соединений степень окисления Кислорода составляет -2, Водорода +1.
Рассмотрим это на примере калий сульфата K 2 SO 4 . Степень окисления Калия в соединениях может быть только +1, а Кислорода -2:
С принципа электронейтральности вычисляем степень окисления Серы:
2(+1) + 1 (х) + 4 (-2) = 0, откуда х = +6.
При определении степеней окисления элементов в соединениях следует придерживаться таких правил:
1. Степень окисления элемента в простом веществе равна нулю.
2. Фтора - наиболее электроотрицательный химический элемент, поэтому степень окисления Фтора в всех соединениях равна-1.
3. Оксиген - наиболее электроотрицательный элемент после Фтора, поэтому степень окисления Кислорода во всех соединениях, кроме фторидов, отрицательный: в большинстве случаев он равна -2, а в пероксидах - -1.
4. Степень окисления Водорода в большинстве соединений равна +1, а в соединениях с металлическими элементами (гидридах) - -1.
5. Степень окисления металлов в соединениях всегда положительный.
6. Более электроотрицательный элемент всегда имеет отрицательный степень окисления.
7. Сумма степеней окисления всех атомов в молекуле равна нулю.
Для характеристики окислительно-восстановительной способности частиц важное значение имеет такое понятие, как степень окисления. СТЕПЕНЬ ОКИСЛЕНИЯ – это заряд, который мог бы возникнуть у атома в молекуле или ионе, если бы все его связи с другими атомами оказались разорваны, а общие электронные пары ушли с более электроотрицательными элементами.
В отличие от
реально существующих зарядов у ионов,
степень окисления показывает лишь
условный заряд атома в молекуле. Она
может быть отрицательной, положительной
и нулевой. Например, степень окисления
атомов в простых веществах равна «0»
(, ,
, ,
, ).
В химических соединениях атомы могут
иметь постоянную степень окисления или
переменную. У металлов главных подгруппI,
II
и III
групп Периодической системы в химических
соединениях степень окисления, как
правило, постоянна и равна соответственно
Ме +1 ,
Ме +2
и Ме +3
(Li + ,
Ca +2 ,
Al +3).
У атома фтора всегда -1. У хлора в
соединениях с металлами всегда -1. В
подавляющем числе соединений кислород
имеет степень окисления -2 (кроме
пероксидов, где его степень окисления
-1), а водород +1(кроме гидридов металлов,
где его степень окисления -1).
).
В химических соединениях атомы могут
иметь постоянную степень окисления или
переменную. У металлов главных подгруппI,
II
и III
групп Периодической системы в химических
соединениях степень окисления, как
правило, постоянна и равна соответственно
Ме +1 ,
Ме +2
и Ме +3
(Li + ,
Ca +2 ,
Al +3).
У атома фтора всегда -1. У хлора в
соединениях с металлами всегда -1. В
подавляющем числе соединений кислород
имеет степень окисления -2 (кроме
пероксидов, где его степень окисления
-1), а водород +1(кроме гидридов металлов,
где его степень окисления -1).
Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона. Эта взаимосвязь позволяет рассчитывать степени окисления атомов в сложных соединениях.
В молекуле серной
кислоты H 2 SO 4
атом водорода имеет степень окисления
+1, а атом кислорода -2. Так как атомов
водорода два, а атомов кислорода четыре,
то мы имеем два «+» и восемь «-». До
нейтральности не хватает шесть «+».
Именно это число и является степенью
окисления серы -
 .
Молекула дихромата калияK 2 Cr 2 O 7
состоит из двух атомов калия, двух атомов
хрома и семи атомов кислорода. У калия
степень окисления всегда +1, у кислорода
-2. Значит, мы имеем два «+» и четырнадцать
«-». Оставшиеся двенадцать «+» приходятся
на два атома хрома, у каждого из которых
степень окисления равна +6 (
.
Молекула дихромата калияK 2 Cr 2 O 7
состоит из двух атомов калия, двух атомов
хрома и семи атомов кислорода. У калия
степень окисления всегда +1, у кислорода
-2. Значит, мы имеем два «+» и четырнадцать
«-». Оставшиеся двенадцать «+» приходятся
на два атома хрома, у каждого из которых
степень окисления равна +6 ( ).
).
Типичные окислители и восстановители
Из определения процессов восстановления и окисления следует, что, в принципе, в роли окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей степени окисления и поэтому могут понижать свою степень окисления. Аналогично в роли восстановителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в высшей степени окисления и поэтому могут повышать свою степень окисления.
К наиболее сильным окислителям относятся:
1) простые вещества, образуемые атомами, имеющими большую электроотрицательность, т.е. типичные неметаллы, расположенные в главных подгруппах шестой и седьмой групп периодической системы: F, O, Cl, S (соответственно F 2 , O 2 , Cl 2 , S);
2) вещества, содержащие элементы в высших и промежуточных
положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fe 3+), так и кислородосодержащих, оксоанионов (перманганат-ион - MnO 4 -);
3) перекисные соединения.
Конкретными
веществами, применяемыми на практике
в качестве окислителей, являются кислород
и озон, хлор, бром, перманганаты, дихроматы,
кислородные кислоты хлора и их соли
(например,
 ,
, ,
, ),
азотная кислота (
),
азотная кислота ( ),
концентрированная серная кислота
(
),
концентрированная серная кислота
( ),
диоксид марганца (
),
диоксид марганца ( ),
пероксид водорода и пероксиды металлов
(
),
пероксид водорода и пероксиды металлов
( ,
, ).
).
К наиболее сильным восстановителям относятся:
1)простые вещества, атомы которых имеют низкую электроотрицательность («активные металлы»);
2) катионы металлов в низжих степенях окисления (Fe 2+);
3) простые элементарные анионы, например, сульфид-ион S 2- ;
4) кислородосодержащие
анионы (оксоанионы), соответствующие
низшим положительным степеням окисления
элемента (нитрит
 ,
сульфит
,
сульфит ).
).
Конкретными
веществами, применяемыми на практике
в качестве восстановителей, являются,
например, щелочные и щелочноземельные
металлы, сульфиды, сульфиты, галогенводороды
(кроме HF),
органические вещества – спирты,
альдегиды, формальдегид, глюкоза,
щавелевая кислота, а также водород,
углерод, моноксид углерода ( )
и алюминий при высоких температурах.
)
и алюминий при высоких температурах.
В принципе, если в состав вещества входит элемент в промежуточной степени окисления, то эти вещества могут проявлять как окислительные, так и восстановительные свойства. Все зависит от
«партнера» по реакции: с достаточно сильным окислителем оно может реагировать как восстановитель, а с достаточно сильным восстановителем – как окислитель. Так, например, нитрит-ион NO 2 - в кислой среде выступает в роли окислителя по отношению к иону I - :
2 +
2
+
2 + 4HCl→
+ 4HCl→
 +
2
+
2 + 4KCl
+ 2H 2 O
+ 4KCl
+ 2H 2 O
и в роли восстановителя по отношению к перманганат-иону MnO 4 -
5 +
2
+
2 + 3H 2 SO 4
→ 2
+ 3H 2 SO 4
→ 2 +
5
+
5 +K 2 SO 4
+ 3H 2 O
+K 2 SO 4
+ 3H 2 O
Инструкция
В результате образуется комплексное соединение – тетрахлораурат водорода. Комплексообразователем в нем является ион золота, лигандами – ионы хлора, внешней сферой – ион водорода. Как же определить степени окисления элементов в этом комплексном соединении ?
Прежде всего определите, какой из элементов, входящих в состав молекулы, самый электроотрицательный, то есть кто будет перетягивать к себе общую электронную плотность. Это, хлор, поскольку он в верхней правой части таблицы Менделеева, и по уступает только фтору и кислороду. Следовательно, его степень окисления будет со знаком «минус». А какова величина степени окисления хлора?
Хлор, как и все другие галогены, расположен в 7-й группе таблицы Менделеева, на его внешнем электронном уровне находится 7 электронов. Перетянув на этот уровень еще один электрон, он перейдет в устойчивое положение. Таким образом, его степень окисления будет равна -1. А поскольку в этом комплексном соединении четыре иона хлора, то суммарный заряд будет равняться -4.
Но сумма величин степеней окисления элементов, входящих в состав молекулы, должна быть равной нулю, ведь любая молекула электрически нейтральна. Таким образом, -4 должен быть уравновешен положительным зарядом +4, за счет водорода и золота.

Вам понадобится
- Школьный учебник по химии 8-9 класс любого автора, таблица Менделеева, таблица электроотрицательности элементов (печатаются в школьных учебниках по химии).
Инструкция
Для начала необходимо обозначить, что степень - это понятие , принимающее связи за , то есть не углубляющиеся в строение. Если элемент находится в свободном состоянии, то это самый простой случай - образуется простое вещество, а значит степень окисления его равна нулю. Так например, водород, кислород, азот, фтор и т.д.
В сложных веществах все обстоит иначе: электроны между атомами распределены неравномерно, и именно степень окисления помогает определить количество отданных или принятых электронов. Степень окисления может положительной и отрицательной. При плюсе электроны отдаются, при минусе принимаются. Некоторые элементы свою степень окисления сохраняют в различных соединениях, но многие этой особенностью не отличаются. Нужно помнить немаловажное правило - сумма степеней окисления всегда равна нулю. Простейший пример, газ СО: зная, что степень окисления кислорода в преобладающем большинстве случаев равна -2 и используя вышеобозначенное правило, можно вычислить степень окисления для С. В сумме с -2 ноль дает только +2, а значит степень окисления углерода +2. Усложним задачу и возьмем для вычислений газ СО2: степень окисления кислорода по-прежнему остается -2, но молекул его в данном случае две. Следовательно, (-2) * 2 = (-4). Число, в сумме с -4 дающее ноль, +4, то есть в этом газе имеет степень окисления +4. Пример посложнее: Н2SO4 - у водорода степень окисления +1, у кислорода -2. Во взятом соединении 2 водорода и 4 кислорода, т.е. будут, соответственно, +2 и -8. Для того чтобы в сумме получить ноль, нужно добавить 6 плюсов. Значит, степень окисления серы +6.
Когда в соединении сложно определить, где плюс, где минус, необходима электроотрицательности (ее несложно найти в учебнике по общей ). Металлы часто имеют положительную степень окисления , а неметаллы отрицательную. Но например, PI3 - оба элемента неметаллы. В таблице указано, что электроотрицательность йода равна 2,6, а 2,2. При сравнении выясняется, что 2,6 больше, чем 2,2, то есть электроны стягиваются в сторону йода (йод имеет отрицательную степень окисления ). Следуя приведенным несложным примерам, можно легко определить степень окисления любого элемента в соединениях.
Обратите внимание
Не нужно путать металлы и неметаллы, тогда степень окисления будет проще найти и не запутаться.
Степенью окисления называют условный заряд атома в молекуле. При этом предполагают, что все связи имеют ионный характер. Иначе говоря, окисления характеризует возможность элемента образовывать ионную связь.

Вам понадобится
- - таблица Менделеева.
Инструкция
В соединении сумма степеней атомов равна заряду этого соединения. Значит, в простом веществе, например, Na или H2, степень окисления элемента равна нулю.
Степень окисления
кислорода в соединениях обычно равна -2. Например, в воде H2O два атома водорода и один атом кислорода. Действительно, -2+1+1 = 0 - в левой части выражении стоит сумма степеней окисления
всех входящих в соединение атомов. В СaO кальций имеет степень окисления
+2, а - -2. Исключения из этого - соединения OF2 и H2O2.
У степень окисления
всегда равна -1.
Обычно максимальная положительная степень окисления элемента совпадает с номером его группы в периодической таблицы элементов Менделеева. Максимальная степень окисления равна элемента минус восемь. Пример - хлор в седьмой группе. 7-8 = -1 - степень окисления . Исключение в этом правиле составляют фтор, кислород и железо - высшая степень окисления ниже номера их группы. У элементов подгруппы меди высшая степень окисления больше 1.
Источники:
- Степень окисления элементов в 2018
Степень окисления элемента – это условный заряд атомов химического элемента в соединении, вычисленный из предположения, что соединения состоят только из ионов. Они могут иметь положительные, отрицательные, нулевые значения. У металлов степени окисления всегда положительные, у неметаллов могут быть как положительные, так и отрицательные. Это зависит от того, с каким атомом соединен атом неметалла.

Инструкция
Обратите внимание
Степень окисления может иметь дробные значения, например в магнитном железняке Fe2O3 равна +8/3.
Источники:
- "Пособие по химии", Г.П. Хомченко, 2005.
Степень окисления - часто встречающаяся в учебниках химии характеристика элементов. Существует большое количество задач, направленных на определение этой степени, и многие из них вызывают у школьников и студентов трудности. Но, следуя определенному алгоритму, эти трудности можно избежать.

Вам понадобится
- - периодическая система химических элементов (таблица Д.И. Менделеева).
Инструкция
Запомните одно общее правило: любого элемента в простом веществе равна нулю ( простых веществ: Na, Mg, Al, - т.е. вещества, состоящие из одного элемента). Для определения вещества вначале просто запишите его, не теряя индексов - цифр, стоящих в правой нижней части рядом с символом элемента. Примером будет серная - H2SO4.
Далее откройте таблицу Д.И. Менделеева и найдите степень самого левого элемента в вашем веществе - в случае данного примера. По существующему правилу его степень окисления будет всегда положительна, и записывается она со знаком «+», так как он занимает крайнее левое положение в записи формулы вещества. Чтобы определить числовое значение степени окисления, обратите внимание на расположение элемента относительно групп. Водород находится в первой группе, следовательно, его степень окисления +1, но так как в серной два атома водорода (это нам показывает индекс), то над его символом напишите +2.
После этого определите степень окисления самого правого элемента в записи - кислорода в данном случае. Его условный (или степень окисления) будет всегда отрицателен, так как он занимает правое положение в записи вещества. Это правило справедливо во всех случаях. Числовое значение правого элемента находится в результате вычитания из номера его группы числа 8. В данном случае степень окисления кислорода равна -2 (6-8=-2), учитывая индекс - -8.
Чтобы найти условный заряд атома третьего элемента, воспользуйтесь правилом - сумма степеней окисления всех элементов должна быть равна нулю. Значит, условный заряд атома кислорода в веществе будет равен +6: (+2)+(+6)+(-8)=0. После этого запишите +6 над символом серы.
Источники:
- как степени окисления химических элементов
Фосфор – химический элемент, имеющий 15-й порядковый номер в Таблице Менделеева. Он расположен в ее V группе. Классический неметалл, открытый алхимиком Брандом в 1669-м году. Существует три основных модификации фосфора: красный (входящий в состав смеси для розжига спичек), белый и черный. При очень высоких давлениях (порядка 8,3*10^10Па) черный фосфор переходит в другое аллотропическое состояние («металлический фосфор») и начинает проводить ток. фосфора в различных веществах?

Инструкция
Вспомните, степень . Это величина, соответствующая заряду иона в молекуле, при условии, что электронные пары, осуществляющие связь, смещены в сторону более электроотрицательного элемента (расположенного в Таблице Менделеева правее и выше).
Надо также знать главное условие: сумма электрических зарядов всех ионов, входящих в состав молекулы, с учетом коэффициентов всегда должна равняться нулю.
Степень окисления далеко не всегда количественно совпадает с валентностью. Наилучший пример – углерод, который в органических всегда имеет , равную 4, а степень окисления может быть равной и -4, и 0, и +2, и +4.
Какова степень окисления в молекуле фосфина PH3, например? С учетом всего дать на этот вопрос очень легко. Поскольку водород – самый первый элемент в Таблице Менделеева, он по определению не может располагаться там «правее и выше», чем . Следовательно, именно фосфор притянет к себе электроны водорода.
Каждый атом водорода, лишившись электрона, превратится в положительно заряженный ион окисления +1. Следовательно, суммарный положительный заряд равен +3. Значит, с учетом правила, гласящего, что суммарный заряд молекулы равен нулю, степень окисления фосфора в молекуле фосфина равна -3.
Ну, а какова степень окисления фосфора в оксиде P2O5? Возьмите Таблицу Менделеева. Кислород расположен в VI группе, правее фосфора, и к тому же выше, следовательно, он однозначно более электроотрицателен. То есть степень окисления кислорода в этом соединении будет со знаком «минус», а фосфора – со знаком «плюс». Каковы же эти степени, чтобы молекула в целом была нейтральна? Легко можно увидеть, что наименьшее общее кратное для чисел 2 и 5 – это 10. Следовательно, степень окисления кислорода -2, а фосфора +5.
Темы кодификатора ЕГЭ: Электроотрицательность. Степень окисления и валентность химических элементов.
Когда атомы взаимодействуют и образуют , электроны между ними в большинстве случаев распределяются неравномерно, поскольку свойства атомов различаются. Более электроотрицательный атом сильнее притягивает к себе электронную плотность. Атом, который притянул к себе электронную плотность, приобретает частичный отрицательный заряд δ — , его «партнер» — частичный положительный заряд δ+ . Если разность электроотрицательностей атомов, образующих связь, не превышает 1,7, мы называем связь ковалентной полярной . Если разность электроотрицательностей, образующих химическую связь, превышает 1,7, то такую связь мы называем ионной .
Степень окисления – это вспомогательный условный заряд атома элемента в соединении, вычисленный из предположения, что все соединения состоят из ионов (все полярные связи – ионные).
Что значит «условный заряд»? Мы просто-напросто договариваемся, что немного упростим ситуацию: будем считать любые полярные связи полностью ионными, и будем считать, что электрон полностью уходит или приходит от одного атома к другому, даже если на самом деле это не так. А уходит условно электрон от менее электроотрицательного атома к более электроотрицательному.
Например , в связи H-Cl мы считаем, что водород условно «отдал» электрон, и его заряд стал +1, а хлор «принял» электрон, и его заряд стал -1. На самом деле таких полных зарядов на этих атомах нет.
Наверняка, у вас возник вопрос — зачем же придумывать то, чего нет? Это не коварный замысел химиков, все просто: такая модель очень удобна. Представления о степени окисления элементов полезны при составлении классификации химических веществ, описании их свойств, составлении формул соединений и номенклатуры. Особенно часто степени окисления используются при работе с окислительно-восстановительными реакциями .
Степени окисления бывают высшие , низшие и промежуточные .
Высшая степень окисления равна номеру группы со знаком «плюс».
Низшая определяется, как номер группы минус 8.
И промежуточная степень окисления — это почти любое целое число в интервале от низшей степени окисления до высшей.
Например , для азота характерны: высшая степень окисления +5, низшая 5 — 8 = -3, а промежуточные степени окисления от -3 до +5. Например, в гидразине N 2 H 4 степень окисления азота промежуточная, -2.
Чаще всего степень окисления атомов в сложных веществах обозначается сначала знаком, потом цифрой, например +1, +2, -2 и т.д. Когда речь идет о заряде иона (предположим, что ион реально существует в соединении), то сначала указывают цифру, потом знак. Например : Ca 2+ , CO 3 2- .
Для нахождения степеней окисления используют следующие правила :
- Степень окисления атомов в простых веществах равна нулю;
- В нейтральных молекулах алгебраическая сумма степеней окисления равна нулю, для ионов эта сумма равна заряду иона;
- Степень окисления щелочных металлов (элементы I группы главной подгруппы) в соединениях равна +1, степень окисления щелочноземельных металлов (элементы II группы главной подгруппы) в соединениях равна +2; степень окисления алюминия в соединениях равна +3;
- Степень окисления водорода в соединениях с металлами ( — NaH, CaH 2 и др.) равна -1 ; в соединениях с неметаллами () +1 ;
- Степень окисления кислорода равна -2 . Исключение составляют пероксиды – соединения, содержащие группу –О-О-, где степень окисления кислорода равна -1 , и некоторые другие соединения (супероксиды, озониды, фториды кислорода OF 2 и др.);
- Степень окисления фтора во всех сложных веществах равна -1 .
Выше перечислены ситуации, когда степень окисления мы считаем постоянной . У всех остальных химических элементов степень окисления — переменная , и зависит от порядка и типа атомов в соединении.
Примеры :
Задание : определите степени окисления элементов в молекуле дихромата калия: K 2 Cr 2 O 7 .
Решение: степень окисления калия равна +1, степень окисления хрома обозначим, как х , степень окисления кислорода -2. Сумма всех степеней окисления всех атомов в молекуле равна 0. Получаем уравнение: +1*2+2*х-2*7=0. Решаем его, получаем степень окисления хрома +6.
В бинарных соединениях более электроотрицательный элемент характеризуется отрицательной степенью окисления, менее электроотрицательный – положительной.
Обратите внимание, что понятие степени окисления – очень условно! Степень окисления не показывает реальный заряд атома и не имеет реального физического смысла . Это упрощенная модель, которая эффективно работает, когда нам необходимо, например, уравнять коэффициенты в уравнении химической реакции, или для алгоритмизации классификации веществ.
Степень окисления – это не валентность ! Степень окисления и валентность во многих случаях не совпадают. Например, валентность водорода в простом веществе Н 2 равна I, а степень окисления, согласно правилу 1, равна 0.
Это базовые правила, которые помогут Вам определить степень окисления атомов в соединениях в большинстве случаев.
В некоторых ситуациях вы можете столкнуться с трудностями при определении степени окисления атома. Рассмотрим некоторые из этих ситуаций, и разберем способы их разрешения:
- В двойных (солеобразных) оксидах степень у атома, как правило, две степени окисления. Например, в железной окалине Fe 3 O 4 у железа две степени окисления: +2 и +3. Какую из них указывать? Обе. Для упрощения можно представить это соединение, как соль: Fe(FeO 2) 2 . При этом кислотный остаток образует атом со степенью окисления +3. Либо двойной оксид можно представить так: FeO*Fe 2 O 3 .
- В пероксосоединениях степень окисления атомов кислорода, соединенных ковалентными неполярными связями, как правило, изменяется. Например, в пероксиде водорода Н 2 О 2 , и пероксидах щелочных металлов степень окисления кислорода -1, т.к. одна из связей – ковалентная неполярная (Н-О-О-Н). Другой пример – пероксомоносерная кислота (кислота Каро) H 2 SO 5 (см. рис.) содержит в составе два атома кислорода со степенью окисления -1, остальные атомы со степенью окисления -2, поэтому более понятной будет такая запись: H 2 SO 3 (O 2). Известны также пероксосоединения хрома – например, пероксид хрома (VI) CrO(O 2) 2 или CrO 5 , и многие другие.
- Еще один пример соединений с неоднозначной степенью окисления – супероксиды (NaO 2) и солеобразные озониды KO 3 . В этом случае уместнее говорить о молекулярном ионе O 2 с зарядом -1 и и O 3 с зарядом -1. Строение таких частиц описывается некоторыми моделями, которые в российской учебной программе проходят на первых курсах химических ВУЗов: МО ЛКАО, метод наложения валентных схем и др.
- В органических соединениях понятие степени окисления не очень удобно использовать, т.к. между атомами углерода существует большое число ковалентных неполярных связей. Тем не менее, если нарисовать структурную формулу молекулы, то степень окисления каждого атома также можно определить по типу и количеству атомов, с которыми данный атом непосредственно связан. Например, у первичных атомов углерода в углеводородах степень окисления равна -3, у вторичных -2, у третичных атомов -1, у четвертичных — 0.
Потренируемся определять степень окисления атомов в органических соединениях. Для этого необходимо нарисовать полную структурную формулу атома, и выделить атом углерода с его ближайшим окружением — атомами, с которыми он непосредственно соединен.
- Для упрощения расчетов можно использовать таблицу растворимости – там указаны заряды наиболее распространенных ионов. На большинстве российских экзаменов по химии (ЕГЭ, ГИА, ДВИ) использование таблицы растворимости разрешено. Это готовая шпаргалка, которая во многих случаях позволяет значительно сэкономить время.
- При расчете степени окисления элементов в сложных веществах сначала указываем степени окисления элементов, которые мы точно знаем (элементы с постоянной степенью окисления), а степень окисления элементов с переменной степенью окисления обозначаем, как х. Сумма всех зарядов всех частиц равна нулю в молекуле или равна заряду иона в ионе. Из этих данных легко составить и решить уравнение.