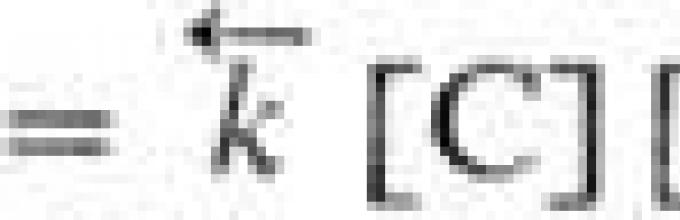Основы термодинамики
Обратимые и необратимые тепловые процессы.
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении, причем если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений.
Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
Любой равновесный процесс является обратимым. Обратимость равновесного процесса, происходящего в системе, следует из того, что ее любое промежуточное состояние есть состояние термодинамического равновесия; независимо от того идет ли процесс в прямом или в обратном направлении. Реальные процессы сопровождаются рассеянием энергии (из-за трения, теплопроводности и т.д.), которая нами не рассматривается. Обратимые процессы – это идеализация реальных процессов. Их рассмотрение важно по 2-м причинам: 1) многие процессы в природе и технике практически обратимы; 2) обратимые процессы являются наиболее экономичными; имеют максимальный термический коэффициент полезного действия, что позволяет указать пути повышения КПД реальных тепловых двигателей.
Работа газа при изменении его объема.
Работа совершается только тогда, когда изменяется объем.
Найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде. Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу
A=Fdl=pSdl=pdV, гдеS-площадь поршня,Sdl=dV-изменение объема системы. Таким образом,A=pdV.(1)
Полную работу А, совершаемую газом при изменении его объема от V1 доV2, найдем интегрированием формулы (1):A=pdV(отV1 доV2).(2)
Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
П
Полная
работа газа будет равна площади фигуры,
ограниченной осью абсцисс, кривой и
значениями V1,V2.
Графически можно изображать только равновесные процессы – процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев их неравновесностью можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному).
Первое начало термодинамики.
Существует 2 способа обмена энергией между телами:
передача энергии через перенос тепла (посредством теплопередачи);
через совершение работы.
Таким образом, можно говорить о 2-х формах передачи энергии от одних тел к другим: работе и теплоте. Энергия механического движения может превращаться в энергию теплового движения, и наоборот. При этих превращениях соблюдается закон сохранения и превращения энергии; применительно к термодинамическим процессам этим законом и является первое начало термодинамики:
∆U=Q-A или Q=∆U+A.(1)
Т.е, теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил. Это выражение в дифференциальной форме будет иметь вид Q=dU+A(2) , гдеdU- бесконечно малое изменение внутренней энергии системы,A- элементарная работа,Q– бесконечно малое количество теплоты.
Из формулы (1) следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т.е. в джоулях(Дж).
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии ∆U=0. Тогда, согласно 1-му началу термодинамики,A=Q,
Т.е вечный двигатель первого рода – периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия, - невозможен (одна из формулировок 1-го начала термодинамики).
Применение 1-го начала термодинамики к изопроцессам и к адиабатическому процессу.
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются изопроцессы, при которых один из основных параметров состояния сохраняется постоянным.
Изохорный процесс (V = const )
При таком процессе газ не совершает работы над внешними телами, т.е A=pdV=0.
Тогда, из 1-го начала термодинамики следует, что вся теплота, переданная телу, идет на увеличение его внутренней энергии: Q=dU. Зная, чтоdU m =C v dT.
Тогда для произвольной массы газа получим Q=dU=m\M*C v dT.
Изобарный процесс (p = const ).
При этом процессе работа газа при увеличении объема от V1 доV2 равнаA=pdV(отV1 доV2)=p(V2-V1) и определяется площадью фигуры, ограниченной осью абсцисс, кривойp=f(V) и значениямиV1,V2. Если вспомнить ур-е Менделеева-Клапейрона для выбранных нами 2-х состояний, то
pV 1 =m\M*RT 1 , pV 2 =m\M*RT 2 , откуда V 1 - V 2 = m\M*R\p(T 2 - T 1). Тогда выражение для работы изобарного расширения примет видA=m\M*R(T 2 -T 1)(1.1).
При изобарном процессе при сообщении газу массой mколичества теплоты
Q=m\M*C p dTего внутренняя энергия возрастает на величинуdU=m\M*C v dT. При этом газ совершает работу, определяемую выражением(1.1).
Изотермический процесс (T = const ).
Этот процесс описывается законом Бойля-Мариотта: pV=const.
Найдем работу изотермического расширения газа: A=pdV(отV1 доV2)=m/M*RTln(V2/V1)=m/M*RTln(p1/p2).
Т.к при Т=constвнутренняя энергия идеального газа не изменяется:dU=m/M*C v dT=0, то из 1-го начала термодинамики (Q=dU+A) следует, что для изотермического процессаQ=A, т.е все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:Q=A=m/M*RTln(p1/p2)=m/M*RTln(V2
Следовательно, чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.
Адиабатический процесс.
АП - это процесс, при котором отсутствует теплообмен (Q=0) между системой и окружающей средой. К адиабатическим можно отнести все быстропротекающие процессы. Из 1-го начала термодинамики (Q=dU+A) для адиабатического процесса следует, чтоA= -dU, т.е внешняя работа совершается за счет изменения внутренней энергии системы. Т.о,pdV= -m/M*C v dT(1).
Продифференцировав ур-е состояния для идеального газа,pV=m/M*RT, получим
PdV + Vdp=m/M*RdT.(2)
Исключим из ур-я (1) и (2) температуру T: (pdV+Vdp)/(pdV)= -R/C v = -(C p -C v)/C v .
Разделив переменные и учитывая, что C p /C v =, найдемdp/p= -dV/V.
Интегрируя это ур-е в пределах от p1 доp2 и соответственно отV1 доV2, а затем, потенцируя, придем к выражениюp2/p1=(V1/V2) , илиp1(V1) =p2(V2) .Так как состояния 1 и 2 выбраны произвольно, то можно записать
pV =const(ур-е адиабатического процесса или ур-е Пуассона).Здесь- показатель адиабаты (или коэффициент Пуассона),=(i+2)/i.
Вычислим работу, совершаемую газом в адиабатическом процессе: A= -m/M*C v dT.
Если газ адиабатически расширяется от объема V1 доV2, то его температура уменьшается отT1 доT2 и работа расширения идеального газа
A= - m/M*C v dT=m/M* C v (T1-T2).
Изохорный, изобарный, изотермический и адиабатический процессы имеют одну особенность – они происходят при постоянной теплоемкости.
Эквиваленты теплоты и работы .
Обмен энергией между термодинамической системой и внешними телами может осуществляться 2мя качественно различными способами: путем совершения работы и путем теплообмена. В отсутствии внешних полей работа совершается при изменении объема или формы системы. Работа A", совершаемая внешнми телами над системой численно равна и противоположна по знаку работе, совершаемой самой системой.
Энтропия.
Помимо внутренней энергии, которая является только функциональной составляющей термодинамической системы, в термодинамике используется еще ряд других функций, описывающих состояние термодинамической системы. Особое место среди них занимает энтропия. Пусть Q - теплота, полученная термодинамической системой в изотермическом процессе, а T - температура, при которой произошла эта передача теплоты. Величина Q/ T называется приведенной теплотой. Приведенное количество теплоты, сообщаемое термодинамической системе на бесконечно малом участке процесса будет равно dQ / T. В термодинамике доказывается, что в любом обратимом процессе сумма приведенных количеств теплоты, передаваемая системе на бесконечно малых участках процесса равна нулю. Математически это означает, что dQ/T - есть полный дифференциал некоторой функции, которая определяется только состоянием системы и не зависит от того, каким путем перешла система в такое состояние. Функция, полученный дифференциал которой равен dS= dQ/ T - называется энтропией. Энтропия определяется только состоянием термодинамической системы и не зависит от способа перехода системы в это состояние. S - энтропия. Для обратимых процессов delta S = 0. Для необратимых delta S > 0 - неравенство Клаудио. Неравенство Клаудио справедливо только для замкнутой системы. Только в замкнутой системе процессы идут так, что энтропия возрастает. Если система незамкнута и может обмениваться теплотой с окружающей средой, ее энтропия может вести себя любым образом; dQ = T dS ; При равновестном переходе системы из одного состояния в другое dQ = dU + dA ; delta S = (интеграл 1 - 2) dQ / T = (интеграл) (dU + dA) / T. Физический смысл имеет не сама энтропия, а разность энтропий при переходе системы из одного состояния в другое.
Связь энтропии с вероятностью состояния системы .
Более глубокий смысл энтропии скрывается в статической физике. Энтропия связывается с термодинамической вероятностью состояния системы. Термодинамическая вероятность состояния системы - это число способов, которыми может быть реализовано данное состояние макроскопической системы. Иными словами W - это число микросостояний, которые реализовывают данные макросостояния.
Больцман методами статистической физики показал, что энтропия S системы и термодинамическая вероятность связаны соотношением: S= k ln (W) ; где k - постоянная Больцмана. Термодинамическая вероятность W не имеет с математической вероятностью ничего общего. Из этого соотношения видно, что энтропия может рассматриваться как мера вероятности состояния термодинамической системы, энтропия является мерой неупорядоченной системы. Чем больше число микросостояний, реализующих данное макросостояние, тем больше ее энтропия.
Второй закон термодинамики .
Количество теплоты, полученное от нагревателя, не может быть целиком преобразовано в механическую работу циклически действующей тепловой машиной. Это и есть 2ой закон: в циклически действующей тепловой машине невозможен процесс, единственным результатом которого было бы преобразование в механическую работу всего количества теплоты, полученного от источника энергии - нагревателя. (by Кельвин Copyright 1851). Второй закон связан с необратимостью процессов в природе. Возможна другая формулировка: невозможен процесс, единственным результатом которого была бы передача энергии путем теплообмена от холодного тела к горячему. Второй закон имеет вероятный характер. В отличие от закона сохранения энергии, второй закон применим лишь к системам, состоящим из очень большого числа частиц. Для таких систем необратимость процессов объясняется тем, что обратный переход должен был бы привести систему в состояние ничтожно малой вероятностью, практически не отличимой от невозможности.
Самопроизвольные процессы в изолированной системе всегда проходят в направлении перехода от маловероятного состояния в более вероятное.
Цикл Карно .
Для создания тепловой машины недостаточно просто иметь нагретое тело (нагреватель), требуется еще 2-е тело – холодильник. Т.о, рабочее тело передает теплоту от нагревателя к холодильнику и попутно совершает полезную работу.
Вкачестве рабочего тела Сади Карно выбрал идеальный газ. Он рассмотрел следующий процесс:
Кривые 1-2, 3-4 – изотермы, кривые 2-3,4-1 – адиабаты.
На участке 1-2 газ получает теплотуQ1 от нагревателя и, расширяясь, совершает работу (т.е расходует полученноеQ1 на совершение работы).Q1=∆U+A1, ∆U=0, т.к. T=const. Q1=A1.
На участке 2-3: газ совершает работу А2, которая равна убыли внутренней энергии; температура понижается. А2= - ∆U2 (температура понижается от Т1 до Т2).
На участке 3-4 :Vуменьшается, Т2=const. Внешние силы совершают работу по сжатию газаA3:Q2= -A3,Q2=A′. От системы отводится количество теплотыQ2: |Q2|=A3.
На участке 4-1 :Vуменьшается,Tувеличивается.A’4=∆U,Q=∆U+A, 0= ∆U4 +A4 =∆U4-A’4,A’4=∆U(внешние силы совершили работу, которая пошла на увеличение внутренней энергии.
Для изотерм A=A1+A3=Q4-|Q2|.
Площадь под изотермой 3-4 меньше, чем под изотермой 1-2 |A’3|<|A1|,Q1>Q2газ получает от нагревателя больше теплоты, чем отдает холодильнику.
За полный цикл: ∆U=0, А=А1 – А’3 - ∆U2(=A2) +A’4, ∆U2=3/2*m/M*R(T2-T1).
A=Q1-|Q2| - 3/2*m/M*R(T2-T1) + (-3/2*m/M*R(T1-T2))=Q1-|Q2|.
Коэффициентом полезного действия тепловой машины называется отношение полезной работы, совершаемой за цикл, к количеству теплоты, полученной системой. Выражается в процентах. =(Q1-|Q2|)/Q1 * 100% (1), или =A/Q1 *100% (2). Эти формулы можно использовать для любой тепловой машины.
Теорема Карно: Q1/T1=|Q2|/T2 (для машины Карно).=(T1-T2)/T1 *100%.
КПД, определяемый формулами (1) и (2) – наибольший возможный. В реальных тепловых машинах КПД меньше.
2.5. Фазовые равновесия и фазовые превращения.
Фаза - это равновесное состояние вещества, отличающееся по своим физическим свойствам от других состояний того же вещества.
Переход вещества из одной фазы в другую называется фазовым переходом . При таких переходах меняются механические, тепловые, электрические и магнитные свойства вещества.
Тройная точка .
Кривые плавления и парообразования в пересекаются в точке A. Эту точку называют тройной точкой, т.к. если при давлении p тр. и температуре Tтр некоторые количества вещества в твердом, жидком и газообразном состояниях находятся в контакте, то без подведения или отвода тепла количество вещества, находящегося в каждом из 3х состояний, не изменяется
Из диаграммы состояний видно, что переход вещества при нагревании из твердого состояния в газообразное может совершиться, минуя жидкое состояние. Переход кристалл-жидкость-газ при нормальном атмосферном давлении происходит лишь у тех веществ, у которых давление в тройной точке ниже этого давления. Те же вещества, которых давление в тройной точке превышает атмосферное, в результате нагревания при атмосферном давлении не плавятся, а переходят в газообразное состояние.
Поскольку тройной точке соответствует вполне определенная температура, она может служить опорной точкой термодинамической шкалы.
Реальные газы .
При движении молекулы вдали от стенок сосуда, в котором заключен газ, на нее действуют силы притяжения соседних молекул, но равнодействующая всех этих сил в среднем равна нулю, т.к. молекулу со всех сторон окружает в среднем одинаковое число соседей. При приближении некоторой молекулы к стенке сосуда все остальные молекулы газа оказываются по одну сторону от нее и равнодействующая всех сил притяжения оказывается направленной от стенки сосуда внутрь газа. Это приводит к тому, что уменьшается импульс, передаваемый молекулой стенке сосуда. В результате давление газа на стенки сосуда уменьшается по сравнению с тем, каким оно было бы в отсутствие сил притяжения между молекулами: p = p идеального + delta p. Вместо уравнения идеального газа получаем p + delta p = nkT ; delta p = a/V(ст.2);
Где a - постоянная, зависящая от вида газа. Для одного моля газа получаем p+a/V(ст.2) = R T / V ; Поправка: при любых давлениях, объем газа не может стать равным нулю.
Уравнение Ван-дер-Ваальса :
(p + a / V (ст.2)) (V - b) = RT, где b - так называемый "запрещенный объем"
Критическая температура .
Было установлено, что из газообразного состояния в жидкое можно перевести любое вещество. Однако каждое вещество может испытать такое превращение лишь при температурах ниже определенной, так называемой критической температуры Tк. При температуре выше критической вещество не превращается в жидкость или твердое тело ни при каких давлениях. При критической температуре средняя кинетическая энергия теплового движения молекул вещества примерно равна модулю потенциальной энергии их связи в жидкости или твердом теле. Т. к. силы притяжения, действующие между молекулами разных веществ, различны, неодинакова и потенциальная энергия их связи, отсюда различными оказываются критические температуры для различных веществ.
Диаграмма состояний вещества .
Чем выше температура жидкости, тем больше плотность и давление ее пара. Геометрическим местом точек, отмечающих на диаграмме p, T равновесные состояния между жидким и газообразным состояниями вещества, является кривая AK (рисунок - график, правая часть параболы - CB выходит не из нуля, а чуть выше и правее; из точки A этой кривой, чуть дальше, выходит еще более широкая часть параболы - AK; все пространство делится на 3 части таким образом - твердое тело, жидкость и газ; оси - T и p).
Процесс испарения твердых тел называется сублимацией.
Обратимые и необратимые процессы
, пути изменения состояния термодинамической системы. Процесс называют обратимым, если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса. Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым.
Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы , вязкое течение и другое. Для химической реакции применяют понятия термодинамической и кинетической обратимости, которые совпадают только в непосредственной близости к состоянию равновесия. Р-ция А + В С + D наз. кинетически обратимой или двусторонней, если в данных условиях продукты С и D могут реагировать друг с другом с образованием исходных веществ А и В. При этом скорости прямой и обратной реакций, соотв. ![]() , где и -константы скорости, [А], [В], [С], [D]- текущие (активности), с течением времени становятся равными и наступает , в котором
-константа равновесия,
зависящая от температуры. Кинетически необратимыми (односторонними) являются обычно такие реакции, в ходе которых хотя бы один из продуктов удаляется из зоны реакции (выпадает в осадок, улетучивается или выделяется в виде малодиссоциированного соединения), а также реакции, сопровождающиеся выделением большого кол-ва тепла.
, где и -константы скорости, [А], [В], [С], [D]- текущие (активности), с течением времени становятся равными и наступает , в котором
-константа равновесия,
зависящая от температуры. Кинетически необратимыми (односторонними) являются обычно такие реакции, в ходе которых хотя бы один из продуктов удаляется из зоны реакции (выпадает в осадок, улетучивается или выделяется в виде малодиссоциированного соединения), а также реакции, сопровождающиеся выделением большого кол-ва тепла.
На практике нередко встречаются системы, находящиеся в частичном равновесии, т.е. в равновесии по отношению к определенного рода процессам, тогда как в целом система неравновесна. Например, образец закаленной стали обладает пространственной неоднородностью и является системой, неравновесной по отношению к , однако в этом образце могут происходить равновесные циклы механической деформации, поскольку времена диффузии и в отличаются на десятки порядков. Следовательно, процессы с относительно большим временем являются кинетически заторможенными и могут не приниматься во внимание при термодинамич. анализе более быстрых процессов.
Необратимые процессы сопровождаются диссипативными эффектами, сущностью которых является производство (генерирование) в системе в результате протекания рассматриваемого процесса. Простейшее выражение закона диссипации имеет вид:
![]()
где средняя температура, d i S-
производство энтропии, - т. наз. нескомпенсированная теплота Клаузиуса (теплота диссипации).
Обратимые процессы, будучи идеализированными, не сопровождаются диссипативными эффектами. Микроскопическая теория обратимых и необратимых процессов развивается в статистической термодинамике. Системы, в которых протекают необратимые процессы, изучает термодинамика необратимых процессов.
Лит.
см. при ст. Химическая термодинамика. Е. П. Агеее.
Выберите первую букву в названии статьи:
Определение 1
Обратимый процесс считается в физике процессом, который возможен для проведения в обратном направлении таким образом, что система будет подвержена прохождению тех же состояний, но в обратных направлениях.
Рисунок 1. Обратимые и необратимые процессы. Автор24 - интернет-биржа студенческих работ
Определение 2
Необратимый процесс считается процессом, самопроизвольно протекающим исключительно в одном направлении.
Термодинамический процесс
Рисунок 2. Термодинамические процессы. Автор24 - интернет-биржа студенческих работ
Термодинамический процесс представляет непрерывное изменение состояний системы, которое происходит в итоге ее взаимодействий с окружающей средой. Внешним признаком процесса будет считаться в таком случае изменение хотя бы одного параметра состояния.
Реальные процессы изменения состояния проистекают при условии присутствия значительных скоростей и разностей потенциалов (давлений и температур), существующих между системой и средой. В подобных условиях появится сложное неравномерное распределение параметров и функций состояния, исходя из объема системы, пребывающей в неравновесном состоянии. Термодинамические процессы, предусматривающие прохождение системы через ряд неравновесных состояний, будут называться неравновесными.
Изучение неравновесных процессов считается сложнейшей для ученых задачей, поскольку разработанные в рамках термодинамики методы приспособлены в основном для исследования равновесных состояний. К примеру, неравновесный процесс весьма сложно рассчитывается посредством уравнений состояния газа, применимых для равновесных условий, в то время, как в отношении всего объема системы давление и температура обладают равными значениями.
Возможно было бы выполнять приближенный расчет неравновесного процесса путем подстановки в уравнение средних значений параметров состояния, но в большинстве случаев осреднение параметров по объему системы становится невозможным.
В технической термодинамике в рамках исследования реальных процессов условно принимают распределение параметров состояния равномерным образом. Это, в свою очередь, позволяет воспользоваться уравнениями состояния и иными расчетными формулами, полученными с целью равномерного распределения в системе параметров.
В некоторых конкретных случаях погрешности, обусловленные подобным упрощением, незначительны и при расчете реальных процессов их возможно не учитывать. Если в результате неравномерности процесс ощутимо отличается от идеальной равновесной модели, то в расчет внесут соответствующие поправки.
Условия равномерно распределенных параметров в системе при изменении ее состояния, по существу подразумевают взятие идеализированного процесса в качестве объекта исследования. Подобный процесс при этом состоит из бесконечно большого количества равновесных состояний.
Такой процесс возможно представить в формате протекающего настолько медленно, что в каждый конкретный момент времени в системе установится практически равновесное состояние. Степень приближения такого процесса к равновесному окажется тем большей, чем меньшей будет при этом скорость изменения системы.
В пределе мы приходим к бесконечно медленному процессу, предоставившему непрерывную смену для состояний равновесия. Подобный процесс равновесного изменения состояния будет называться квазистатическим (или как бы статическим). Такому виду процесса будет соответствовать бесконечно малая разность потенциалов между системой и окружающей средой.
Определение 3
При обратном направлении квазистатического процесса система будет проходить через состояния, аналогичные тем, что происходят в прямом процессе. Такое свойство квазистатических процессов называют обратимостью, а сами процессы при этом являются обратимыми.
Обратимый процесс в термодинамике
Рисунок 3. Обратимый процесс в термодинамике. Автор24 - интернет-биржа студенческих работ
Определение 4
Обратимый процесс (равновесный) – представляет термодинамический процесс, способный к прохождению и в прямом, и в обратном направлении (за счет прохождения через одинаковые промежуточные состояния), система при этом возвращается в исходное состояние без энергетических затрат, а в окружающей среде не остается никаких макроскопических изменений.
Обратимый процесс возможно в абсолютно любой момент времени заставить протекать в обратном направлении, за счет изменения какой-либо независимой переменной на бесконечно малую величину. Обратимые процессы могут давать наибольшую работу. Большую работу от системы получить невозможно ни при каких условиях. Это придает теоретическую важность обратимым процессам, реализовать которые на практике также нереально.
Такие процессы протекают бесконечно медленно, и становится возможным лишь приблизиться к ним. Важно отметить существенное отличие термодинамической обратимости процесса от химической. Химическая обратимость будет характеризовать направление процесса, а термодинамическая – способ, при котором он будет проводиться.
Понятия обратимого процесса и равновесного состояния играют очень значимую роль в термодинамике. Так, каждый количественный вывод термодинамики будет применим исключительно в отношении равновесных состояний и обратимых процессов.
Необратимые процессы термодинамики
Необратимый процесс невозможен к проведению в противоположном направлении посредством все тех же самых промежуточных состояний. Все реальные процессы считаются в физике необратимыми. В качестве примеров таких процессов выступают следующие явления:
- диффузия;
- термодиффузия;
- теплопроводность;
- вязкое течение и др.
Переход кинетической энергии (для макроскопического движения) в теплоту через трение (во внутреннюю энергию системы) будет представлять собой необратимый процесс.
Все осуществляемые в природе физические процессы подразделяются на обратимые и необратимые. Пусть изолированная система вследствие некоего процесса осуществит переход из состояния А в состояние В и затем возвратится в свое изначальное состояние.
Процесс, в таком случае, станет обратимым в условиях вероятного осуществления обратного перехода из состояния В в А через аналогичные промежуточные состояния таким путем, чтобы при этом не оставалось совершенно никаких изменений в окружающих телах.
Если осуществление подобного перехода невозможно и при условии сохранения по окончании процесса в окружающих телах или внутри самой системы каких-либо изменений, то процесс окажется необратимым.
Любой процесс, сопровождающийся явлением трения, станет необратимым, поскольку, в условиях трения, часть работы всегда превратится в тепло, оно рассеется, в окружающих телах сохранится след процесса – (нагревание), что превратит процесс (с участием трения) в необратимый.
Пример 1
Идеальный механический процесс, выполняемый в консервативной системе (без сил трения), стал бы обратимым. Примером подобного процесса можно считать колебания на длинном подвесе тяжеловесного маятника. По причине незначительной степени сопротивления среды, амплитуда маятниковых колебаний становится практически неизменной на протяжении продолжительного времени, кинетическая энергия колеблющегося маятника при этом оказывается полностью переходящей в его потенциальную энергию и обратно.
В качестве важнейшей принципиальной особенности всех тепловых явлений (где участвует громаднейшее количество молекул), будет выступать их необратимый характер. Примером процесса такого характера можно считать расширение газа (в частности, идеального) в пустоту.
Итак, в природе наблюдается существование двух видов принципиально различных процессов:
- обратимых;
- необратимых.
Согласно заявлению М. Планка, сделанного однажды, различия между такими процессами, как необратимые и обратимые, будут лежать значительно глубже, чем, к примеру, между электрическими и механическими разновидностями процессов. По этой причине, его с большим основанием (сравнительно с любым другим признаком) имеет смысл выбирать как первейший принцип в рамках рассмотрения физических явлений.
Котлоагрегат
Значение слова "Котлоагрегат"
Котлоагрегат, котельный агрегат, конструктивно объединённый в единое целое комплекс устройств для получения под давлением пара или горячей воды за счёт сжигания топлива. Главной частью К. являются топочная камера и газоходы, в которых размещены поверхности нагрева, воспринимающие тепло продуктов сгорания топлива (пароперегреватель, водяной экономайзер, воздухоподогреватель). Элементы К. опираются на каркас и защищены от потерь тепла обмуровкой и изоляцией. К. применяются натепловых электростанциях для снабжения паром турбин; в промышленных и отопительных котельных для выработки пара и горячей воды на технологические и отопительные нужды; в судовых котельных установках. Конструкция К. зависит от его назначения, вида применяемого топлива и способа сжигания, единичной паропроизводительности, а также от давления и температуры вырабатываемого пара.
Обратимый процесс (то есть равновесный) - термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Обратимые процессы дают наибольшую работу. Большую работу от системы вообще получить невозможно. Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно. Он протекает бесконечно медленно, и можно только приблизиться к нему.
Следует отметить, что термодинамическая обратимость процесса отличается от химической обратимости. Химическая обратимость характеризует направление процесса, а термодинамическая - способ его проведения.
Понятия равновесного состояния и обратимого процесса играют большую роль в термодинамике. Все количественные выводы термодинамики применимы только к равновесным состояниям и обратимым процессам.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Переход кинетической энергии макроскопического движения через трение в теплоту, то есть во внутреннюю энергию системы, является необратимым процессом.
Все происходящие в природе физические процессы делятся на два типа – обратимые и необратимые.
Пусть изолированная система в результате некоторого процесса переходит из состояния А в состояние В и затем возвращается в начальное состояние. Процесс называется обратимым, если возможно осуществить обратный переход из В в А через те же промежуточные состояния так, чтобы при этом не осталось никаких изменений в окружающих телах. Если такой обратный переход осуществить нельзя, если по окончании процесса в самой системе или окружающих телах остались какие-то изменения, то процесс является необратимым.
Любой процесс, сопровождаемый трением, является необратимым, ибо при трении часть работы всегда превращается в тепло, тепло рассеивается, в окружающих телах остается след процесса – нагревание, что делает процесс с участием трения необратимым. Идеальный механический процесс, происходящий в консервативной системе (без участия сил трения), был бы обратимым. Примером такого процесса является колебание тяжелого маятника на длинном подвесе. Из-за малого сопротивления среды амплитуда колебаний маятника практически не изменяется в течение продолжительного времени, при этом кинетическая энергия колеблющегося маятника полностью переходит в его потенциальную энергию и обратно.
Важнейшей принципиальной особенностью всех тепловых явлений, в которых участвует громадное число молекул, является их необратимый характер. Примером необратимого процесса является расширение газа, даже идеального, в пустоту. Предположим, что нам дан закрытый сосуд, разделенный на две равные части заслонкой (рисунок. 1). Пусть в части I находится некоторое количество газа, а в части II – вакуум. Опыт показывает, что если убрать заслонку, то газ равномерно распределится по всему объему сосуда (расширится в пустоту). Это явление происходит как бы "само собой" без внешнего вмешательства. Сколько бы мы не следили в дальнейшем за газом, он будет всегда оставаться распределенным с одинаковой плотностью по всему сосуду; сколько бы мы ни ждали, нам не удастся наблюдать того, чтобы газ, распределенный по всему сосуду I + II сам собой, то есть без вмешательства извне, ушел из части II и сконцентрировался весь в части I, что дало бы нам возможность вновь вдвинуть заслонку и тем самым возвратиться к исходному состоянию. Таким образом, очевидно, что процесс расширения газа в пустоту является необратимым.
Рис 1. Закрытый сосуд, содержащий газ и вакуум и разделённый перегородкой
Опыт показывает, что тепловые явления почти всегда обладают свойством необратимости. Так, например, если рядом находятся два тела, из которых одно теплее другого, то их температуры постепенно выравниваются, то есть тепло "само собой" перетекает от более теплого тела к более холодному. Однако обратный переход теплоты от более холодного тела к нагретому, который может быть осуществлен в холодильной машине, не идет "сам собой". Для осуществления такого процесса требуется затрата работы еще какого-либо тела, что приводит к изменению состояния этого тела. Следовательно, условия обратимости не выполняются.
Кусочек сахара, помещенный в горячий чай, растворяется в нем, но никогда не бывает, чтобы из горячего чая, в котором уже растворен кусочек сахара, этот последний выделился и вновь собрался в виде кусочка. Конечно, получить сахар, выпарив его из раствора, можно. Но этот процесс сопровождается изменениями в окружающих телах, что свидетельствует о необратимости процесса растворения. Необратимым является и процесс диффузии. И вообще примеров необратимых процессов можно привести сколь угодно много. По сути, любой процесс, протекающий в природе в реальных условиях, является необратимым.
Итак, в природе существуют два вида принципиально различных процессов – обратимые и необратимые. М. Планк сказал однажды, что различие между обратимыми и необратимыми процессами лежит гораздо глубже, чем, например, между процессами механическими и электрическими, поэтому его с большим основанием, чем любой другой признак, следовало бы выбрать в качестве первейшего принципа при рассмотрении физических явлений.
Обратимые и необратимые в термодинамическом смысле процессы. Процессы жизнедеятельности как пример необратимых процессов.
Обратимые и необратимые процессы , пути изменения состояния термодинамической системы.
Процесс называют обратимым , если он допускает возвращение рассматриваемой системы из конечного состояния в исходное через ту же последовательность промежуточных состояний, что и в прямом процессе, но проходимую в обратном порядке. При этом в исходное состояние возвращается не только система, но и среда. Обратимый процесс возможен, если и в системе, и в окружающей среде он протекает равновесно. При этом предполагается, что равновесие существует между отдельными частями рассматриваемой системы и на границе с окружающей средой. Обратимый процесс - идеализированный случай, достижимый лишь при бесконечно медленном изменении термодинамических параметров. Скорость установления равновесия должна быть больше, чем скорость рассматриваемого процесса.
Если невозможно найти способ вернуть и систему, и тела в окружающей среде в исходное состояние, процесс изменения состояния системы называют необратимым .
Необратимые процессы могут протекать самопроизвольно только в одном направлении; таковы диффузия,теплопроводность, вязкое течение и другое. Для химической реакции применяют понятия термодинамической и кинетической обратимости, которые совпадают только в непосредственной близости к состоянию равновесия На практике нередко встречаются системы, находящиеся в частичном равновесии, т.е. в равновесии по отношению к определенного рода процессам, тогда как в целом система неравновесна. Например, образец закаленной стали обладает пространственной неоднородностью и является системой, неравновесной по отношению к диффузионным процессам, однако в этом образце могут происходить равновесные циклы механической деформации, поскольку времена релаксации диффузии и деформации в твердых телах отличаются на десятки порядков. Следовательно, процессы с относительно большим временем релаксации являются кинетически заторможенными и могут не приниматься во внимание при термодинамич. анализе более быстрых процессов.
Общее заключение о необратимости процессов в природе
. Переход тепла от горячего тела к холодному и механической энергии во внутреннюю - это примеры наиболее типичных необратимых процессов. Число подобных примеров можно увеличивать практически неограниченно. Все они говорят о том, что процессы в природе имеют определенную направленность, никак не отраженную в первом законетермодинамики. Все макроскопические процессы в природе протекают только в одном определенном направлении
. В обратном направлении они самопроизвольно протекать не могут. Все процессы в природе необратимы, и самые трагические из них - старение и смерть организмов.
Важность этого закона в том, что из него можно вывести заключение о необратимости не только процесса теплопередачи, но и других процессов в природе. Если бы тепло в каких-либо случаях могло самопроизвольно передаваться от холодных тел к горячим, то это позволило бы сделать обратимыми и другие процессы. Все процессы самопроизвольно протекают в одном определенном направлении. Они необратимы. Тепло всегда переходит от горячего тела к холодному, а механическая энергия макроскопических тел - во внутреннюю.
Направление процессов в природе указывается вторым законом термодинамики.