Термодинамический процесс называетсяобратимым ,если он может проходить как в прямом, так и в обратном направлении; при этом после возвращения системы в исходное состояние в окружающей среде и в самой системе не происходит никаких изменений.
Равновесный (квазистатический) процесс представляет собой непрерывную последовательность равновесных состояний. Любая точка такого процесса – состояние равновесия, из которого система может идти как в прямом, так и в обратном направлении. Отсюда следует, что любой равновесный процесс обратим.
Только термодинамически равновесные процессы можно изображать графически, потому что для неравновесной системы значение параметров, например, температуры или концентрации, объёму неодинаково, а для всей системы является неопределённой величиной. Процессы, происходящие в таких системах, могут быть изображены графически только приближённо, по усреднённым значениям параметров.
Можно привести пример обратимого процесса из механики – абсолютно упругое соударение. Если заменить переменную времени t на –t , то при абсолютно упругом ударе начальные и конечные скорости тел просто поменяются ролями. Законы Ньютона обратимы.
Обратимые процессы – идеализация. Все реальные процессы в той или иной степени необратимы из-за трения, диффузии, теплопроводности. Все явления переноса – необратимые процессы. Теплота сама собой может переходить только от горячего к холодному, но никогда наоборот. Ещё пример необратимого процесса: абсолютно неупругое соударение, при котором механическая энергия превращается частично или полностью в теплоту.
Обратимые процессы наиболее экономичны, система при таких процессах совершает максимальную работу, а КПД оказывается максимальным.
9) Цикл Карно. Теорема Карно .
Попробуем создать тепловую машину, при работе которой используются только обратимые процессы.
Обратимым может быть адиабатный процесс – теплопередачи там нет вообще; работа внешних сил идёт на приращение внутренней энергии или наоборот, работа системы совершается за счёт убыли внутренней энергии системы, и эти процессы обратимы.
Но теплопередачу от нагревателя как-то надо осуществить, иначе за счёт какой тепловой энергии мы получим полезную работу? Обратимый процесс теплопередачи между двумя телами можно осуществить в изотермическом процессе, если температура обоих тел равна. Тогда безразлично, в какую сторону течёт поток теплоты. Но такой процесс будет и бесконечно медленным.
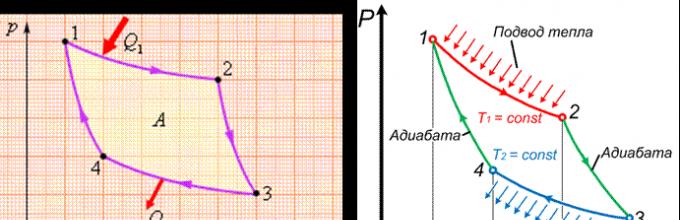
В цикле Карно (рис.8.10 и 8.11) идеальный газ проходит цикл, состоящий из двух адиабат (2-3 и 4-1) и двух изотерм (1-2 и 3-4).
1-2 – изотермическое расширение от объёма V 1 до V 2 ; при этом газ находится в контакте с нагревателем при температуре T 1 ;
2-3 – адиабатическое расширение от объёма V 2 до V 3 ; конечная температура газа равна температуре охладителя T 2 ;

3-4 – изотермическое сжатие от объёма V 3 до V 4 ; при этом газ находится в контакте с охладителем при температуре T 2 ;
4-1 – адиабатическое сжатие от объёма V 4 до V 1 ; конечная температура газа равна температуре нагревателя T 1 .
Для изотермических процессов:



Для адиабатических процессов:
![]() ;
;
![]() .
.
Тогда из последних двух равенств:

Тогда КПД цикла Карно равен:
 .
.
Доказана первая часть теоремы Карно:
1) КПД цикла Карно не зависит от природы рабочего тела и определяется только температурами нагревателя и охладителя:
Сформулируем две другие части теоремы Карно, а докажем их позже.
2)КПД любого обратимого цикла не больше КПД цикла Карно с теми же температурами нагревателя и охладителя:
 . (8.39)
. (8.39)
3)КПД любого необратимого цикла меньше КПД цикла Карно с теми же температурами нагревателя и охладителя:
 . (8.40)
. (8.40)
Энтропия.
Определение энтропии
 |
Понятие энтропии было введено Клаузиусом. Энтропия – это одна из функций состояния термодинамической системы. Функция состояния – это такая величина, значения которой однозначно определяются состоянием системы, а изменение функции состояния при переходе системы из одного состояния в другое определяется только начальным и конечным состояниями системы и не зависят от пути перехода.
Внутренняя энергия U
– функция состояния. Внутренняя энергия идеального газа равна , и её изменение определяется только начальной и конечной температурами: ![]() . Величина – это молярная теплоёмкость идеального газа при постоянном объёме.
. Величина – это молярная теплоёмкость идеального газа при постоянном объёме.
Количество теплоты Q
и работа A
не являются функциями состояния: они зависят от пути перехода системы из начального состояния в конечное. Например, пусть идеальный газ переходит из состояния 1 в состояние 2, совершив последовательно сначала изобарный процесс, затем – изохорный (рис.8.12, а
). Тогда совершённая за весь процесс работа равна ![]() . Пусть теперь из 1 в 2 идеальный газ переходит, сначала совершив изохорный процесс, а затем изобарный (рис.8.12, b
). Работа при таком переходе равна
. Пусть теперь из 1 в 2 идеальный газ переходит, сначала совершив изохорный процесс, а затем изобарный (рис.8.12, b
). Работа при таком переходе равна ![]() . Очевидно, . Величина работы оказалась разная, хотя начальное и конечное состояние одинаковы. Поскольку по первому закону термодинамики количество теплоты, сообщённое системе, идёт на приращение внутренней энергии и на работу системы против внешних сил:
. Очевидно, . Величина работы оказалась разная, хотя начальное и конечное состояние одинаковы. Поскольку по первому закону термодинамики количество теплоты, сообщённое системе, идёт на приращение внутренней энергии и на работу системы против внешних сил: ![]() , то теплота, полученная системой в процессах a
и b
, тоже будет разной, то есть теплота также не является функцией состояния.
, то теплота, полученная системой в процессах a
и b
, тоже будет разной, то есть теплота также не является функцией состояния.
С точки зрения математики, малые приращения величин, не являющихся функциями состояния, не будут полными дифференциалами, и для них нужно использовать обозначения: и . Оказывается, что для теплоты интегрирующим множителем является обратная температура: , и величина, равная отношению полученной системой теплоты к абсолютной температуре, является полным дифференциалом – это приведённая теплота: . По определению Клаузиуса, функция состояния системы, дифференциал которой в обратимом процессе равен приведённой теплоте, является энтропией :
Свойства энтропии
1) Энтропия – функция состояния системы, то есть в замкнутой системе в обратимом процессе, когда система возвращается в исходное состояние, полное изменения энтропии равно нулю:
![]() . (8.42)
. (8.42)
2) Энтропия аддитивна, то есть энтропия системы равна сумме энтропий всех её частей.
3) Энтропия замкнутой системы не убывает:
причём для обратимых процессов и для необратимых.
Соотношение (8.43) называется неравенством Клаузиуса и представляет собой одну из формулировок второго начала термодинамики: энтропия замкнутой системы остаётся постоянной, если в ней происходят только обратимые процессы, и возрастает в случае необратимых процессов.
Рассмотрим замкнутую систему, состоящую из двух тел с температурами и . Пусть – количество теплоты, полученное вторым телом от первого . Тогда количество теплоты, полученное первым телом, отрицательно и равно . Полное приращение энтропии системы двух тел в процессе теплопередачи равно сумме изменений энтропий двух тел.
Второе начало термодинамики. Обратимые и необратимые процессы.
Из формулы (8.6.1) видно, что к.п.д. тепловой машины меньше единицы. Наилучшей была бы машина, с к.п.д., равным единице. Такая машина могла бы полностью превращать в работу всю полученную от некоторого тела теплоту, ничего не отдавая холодильнику. Многочисленные опыты показали невозможность создания подобной машины. К такому выводу впервые пришел Сади Карно в 1824 г. Изучив условия работы тепловых машин, он доказал, что для производства работы тепловой машиной нужно не менее двух источников теплоты с различными температурами. В дальнейшем это детально было изучено Р. Клаузиусом (1850 г.) и В.Кельвином (1852 г.), которые сформулировали второе начало термодинамики.
Формулировка Клаузиуса : Тепло не может самопроизвольно переходить от менее нагретого к более нагретому телу без каких-либо изменений в системе. Т.е. невозможен процесс, единственным конечным результатом которого является передача энергии в форме теплоты от менее нагретого тела к более нагретому.
Из этого определения не вытекает, что тепло не может передаваться от менее нагретого к более нагретому телу. Это происходит в любых холодильных установках, но передача тепла здесь не является конечным результатом, так как при этом совершается работа.
Формулировка Томсона (Кельвина) : Невозможно преобразовать в работу всю теплоту, взятую от тела с однородной температурой, не производя никаких других изменений в состоянии системы. Т.е. невозможен процесс, единственным конечным результатом которого является превращение всей теплоты, полученной от некоторого тела, в эквивалентную ей работу.
Здесь не вытекает, что теплота не может быть полностью обращена в работу. Например, при изотермическом процессе (dU=0) теплота полностью обращается в работу, но этот результат не является единственным, конечным, так как здесь еще происходит расширение газа.
Видно, что приведенные формулировки эквивалентны.
Второе начало термодинамики был окончательно сформулирован тогда, когда окончились неудачей все попытки создать двигатель, который бы обращал в работу всю полученную им теплоту, не вызывая при этом никаких других изменений состояния система - вечный двигатель второго рода . Это двигатель, имеющий к.п.д. 100 %. Поэтому другая формулировка второго начала термодинамики: невозможен перпетуум мобиле второго рода, т.е. такой периодически действующий двигатель, который получал бы тепло от одного резервуара и превращал эту теплоту полностью в работу.
Второе начало термодинамики позволяет разделить все термодинамические процессы на обратимые и необратимые . Если в результате какого-либо процесса система переходит из состояния А в другое состояние В и если возможно вернуть ее хотя бы одним способом в исходное состояние А и притом так, чтобы во всех остальных телах не произошло никаких изменений, то этот процесс называется обратимым. Если же это сделать невозможно, то процесс называется необратимым. Обратимый процесс можно было бы осуществить в том случае, если прямое и обратное направления его протекания были бы равновозможны и равноценны.
Обратимыми процессами являются процессы, протекающие с очень малой скоростью, в идеальном случае бесконечно медленно. В реальных условиях процессы протекают с конечной скоростью, и поэтому их можно считать обратимыми только с определенной точностью. Наоборот, необратимость является характерным свойством, вытекающим из самой природы тепловых процессов. Примером необратимых процессов являются все процессы, сопровождающиеся трением, процессы теплообмена при конечной разности температур, процессы растворения и диффузии. Эти все процессы в одном направлении протекают самопроизвольно, "сами собой", а для совершения каждого из этих процессов в обратном направлении необходимо, чтобы параллельно происходил какой-то другой, компенсирующий процесс. Следовательно, в земных условиях у событий имеется естественный ход, естественное направление.
Второе начало термодинамики определяет направление протекания термодинамических процессов и тем самым дает ответ на вопрос, какие процессы в природе могут протекать самопроизвольно. Оно указывает на необратимость процесса передачи одной формы энергии – работы в другую – теплоту. Работа – форма передачи энергии упорядоченного движения тела как целого; теплота – форма передачи энергии неупорядоченного хаотического движения. Упорядоченное движение может переходить в неупорядоченное самопроизвольно. Обратный переход возможен лишь при условии совершения работы внешними силами.
Цикл Карно.
Анализируя работу тепловых двигателей, Карно пришел к выводу, что наивыгоднейшим процессом является обратимый круговой процесс, состоящий из двух изотерм и двух адиабат, так как он характеризуется наибольшим коэффициентом полезного действия. Такой цикл получил название цикла Карно.
Цикл Карно – прямой круговой процесс, при котором выполненная системой работа максимальна.
Пусть некоторая система может вступать в тепловой контакт с двумя тепловыми резервуарами, температуры которых Т 1 и Т 2 , а теплоемкости бесконечно велики (то есть добавление или отнятие некоторого количество теплоты не изменяет температуры). Примем, что система представляет собой идеальный газ, находящийся в цилиндрическом сосуде под поршнем (рис. 8.7.). Считаем, что стенки и поршень теплонепроницаемы.
Пусть сначала система, находящаяся в состоянии с (р 1 , V 1 , Т 1), приводится в тепловой контакт с первым резервуаром. При сообщении системе теплоты Q 1 совершается работа против внешних сил, численно равная Q 1 , газ расширяется до объема V 2 .
Затем цилиндр переставляется на изолирующую подставку. Газу предоставляется возможность и дальше расширяться до объема V 3 , чтобы температура стала Т 2 .
Переведем цилиндр с поршнем в тепловой контакт со вторым резервуаром с температурой Т 2 , причем внешние тела совершают работу Q 2 над системой, так что объем становится V 4 .
Вновь изолируем систему и уменьшаем объем до первоначального значения V 1 , так что температура повысится от Т 2 до Т 1 .
Если все четыре процесса являются обратимыми, то все наши рассуждения справедливы, и система действительно вернется в исходное состояние с (р 1 , V 1 , Т 1).
Итак, описанный цикл состоит из двух изотермических (1®2 и 3®4) и двух адиабатических расширений и сжатий (2®3 и 4®1) (см. рис.8.8.). Машина, совершающая цикл Карно, называется идеальной тепловой машиной.
Работа, совершаемая при изотермическом расширении:
![]() ; А 1 =Q 1
. (8.8.1)
; А 1 =Q 1
. (8.8.1)
При адиабатическом расширении работа совершается за счет убыли внутренней энергии системы, т.к. Q’=0: ![]()
Котлоагрегат
Значение слова "Котлоагрегат"
Котлоагрегат, котельный агрегат, конструктивно объединённый в единое целое комплекс устройств для получения под давлением пара или горячей воды за счёт сжигания топлива. Главной частью К. являются топочная камера и газоходы, в которых размещены поверхности нагрева, воспринимающие тепло продуктов сгорания топлива (пароперегреватель, водяной экономайзер, воздухоподогреватель). Элементы К. опираются на каркас и защищены от потерь тепла обмуровкой и изоляцией. К. применяются натепловых электростанциях для снабжения паром турбин; в промышленных и отопительных котельных для выработки пара и горячей воды на технологические и отопительные нужды; в судовых котельных установках. Конструкция К. зависит от его назначения, вида применяемого топлива и способа сжигания, единичной паропроизводительности, а также от давления и температуры вырабатываемого пара.
Обратимый процесс (то есть равновесный) - термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Обратимые процессы дают наибольшую работу. Большую работу от системы вообще получить невозможно. Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно. Он протекает бесконечно медленно, и можно только приблизиться к нему.
Следует отметить, что термодинамическая обратимость процесса отличается от химической обратимости. Химическая обратимость характеризует направление процесса, а термодинамическая - способ его проведения.
Понятия равновесного состояния и обратимого процесса играют большую роль в термодинамике. Все количественные выводы термодинамики применимы только к равновесным состояниям и обратимым процессам.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Переход кинетической энергии макроскопического движения через трение в теплоту, то есть во внутреннюю энергию системы, является необратимым процессом.
Все происходящие в природе физические процессы делятся на два типа – обратимые и необратимые.
Пусть изолированная система в результате некоторого процесса переходит из состояния А в состояние В и затем возвращается в начальное состояние. Процесс называется обратимым, если возможно осуществить обратный переход из В в А через те же промежуточные состояния так, чтобы при этом не осталось никаких изменений в окружающих телах. Если такой обратный переход осуществить нельзя, если по окончании процесса в самой системе или окружающих телах остались какие-то изменения, то процесс является необратимым.
Любой процесс, сопровождаемый трением, является необратимым, ибо при трении часть работы всегда превращается в тепло, тепло рассеивается, в окружающих телах остается след процесса – нагревание, что делает процесс с участием трения необратимым. Идеальный механический процесс, происходящий в консервативной системе (без участия сил трения), был бы обратимым. Примером такого процесса является колебание тяжелого маятника на длинном подвесе. Из-за малого сопротивления среды амплитуда колебаний маятника практически не изменяется в течение продолжительного времени, при этом кинетическая энергия колеблющегося маятника полностью переходит в его потенциальную энергию и обратно.
Важнейшей принципиальной особенностью всех тепловых явлений, в которых участвует громадное число молекул, является их необратимый характер. Примером необратимого процесса является расширение газа, даже идеального, в пустоту. Предположим, что нам дан закрытый сосуд, разделенный на две равные части заслонкой (рисунок. 1). Пусть в части I находится некоторое количество газа, а в части II – вакуум. Опыт показывает, что если убрать заслонку, то газ равномерно распределится по всему объему сосуда (расширится в пустоту). Это явление происходит как бы "само собой" без внешнего вмешательства. Сколько бы мы не следили в дальнейшем за газом, он будет всегда оставаться распределенным с одинаковой плотностью по всему сосуду; сколько бы мы ни ждали, нам не удастся наблюдать того, чтобы газ, распределенный по всему сосуду I + II сам собой, то есть без вмешательства извне, ушел из части II и сконцентрировался весь в части I, что дало бы нам возможность вновь вдвинуть заслонку и тем самым возвратиться к исходному состоянию. Таким образом, очевидно, что процесс расширения газа в пустоту является необратимым.
Рис 1. Закрытый сосуд, содержащий газ и вакуум и разделённый перегородкой
Опыт показывает, что тепловые явления почти всегда обладают свойством необратимости. Так, например, если рядом находятся два тела, из которых одно теплее другого, то их температуры постепенно выравниваются, то есть тепло "само собой" перетекает от более теплого тела к более холодному. Однако обратный переход теплоты от более холодного тела к нагретому, который может быть осуществлен в холодильной машине, не идет "сам собой". Для осуществления такого процесса требуется затрата работы еще какого-либо тела, что приводит к изменению состояния этого тела. Следовательно, условия обратимости не выполняются.
Кусочек сахара, помещенный в горячий чай, растворяется в нем, но никогда не бывает, чтобы из горячего чая, в котором уже растворен кусочек сахара, этот последний выделился и вновь собрался в виде кусочка. Конечно, получить сахар, выпарив его из раствора, можно. Но этот процесс сопровождается изменениями в окружающих телах, что свидетельствует о необратимости процесса растворения. Необратимым является и процесс диффузии. И вообще примеров необратимых процессов можно привести сколь угодно много. По сути, любой процесс, протекающий в природе в реальных условиях, является необратимым.
Итак, в природе существуют два вида принципиально различных процессов – обратимые и необратимые. М. Планк сказал однажды, что различие между обратимыми и необратимыми процессами лежит гораздо глубже, чем, например, между процессами механическими и электрическими, поэтому его с большим основанием, чем любой другой признак, следовало бы выбрать в качестве первейшего принципа при рассмотрении физических явлений.
Определение 1
Обратимый процесс считается в физике процессом, который возможен для проведения в обратном направлении таким образом, что система будет подвержена прохождению тех же состояний, но в обратных направлениях.
Рисунок 1. Обратимые и необратимые процессы. Автор24 - интернет-биржа студенческих работ
Определение 2
Необратимый процесс считается процессом, самопроизвольно протекающим исключительно в одном направлении.
Термодинамический процесс
Рисунок 2. Термодинамические процессы. Автор24 - интернет-биржа студенческих работ
Термодинамический процесс представляет непрерывное изменение состояний системы, которое происходит в итоге ее взаимодействий с окружающей средой. Внешним признаком процесса будет считаться в таком случае изменение хотя бы одного параметра состояния.
Реальные процессы изменения состояния проистекают при условии присутствия значительных скоростей и разностей потенциалов (давлений и температур), существующих между системой и средой. В подобных условиях появится сложное неравномерное распределение параметров и функций состояния, исходя из объема системы, пребывающей в неравновесном состоянии. Термодинамические процессы, предусматривающие прохождение системы через ряд неравновесных состояний, будут называться неравновесными.
Изучение неравновесных процессов считается сложнейшей для ученых задачей, поскольку разработанные в рамках термодинамики методы приспособлены в основном для исследования равновесных состояний. К примеру, неравновесный процесс весьма сложно рассчитывается посредством уравнений состояния газа, применимых для равновесных условий, в то время, как в отношении всего объема системы давление и температура обладают равными значениями.
Возможно было бы выполнять приближенный расчет неравновесного процесса путем подстановки в уравнение средних значений параметров состояния, но в большинстве случаев осреднение параметров по объему системы становится невозможным.
В технической термодинамике в рамках исследования реальных процессов условно принимают распределение параметров состояния равномерным образом. Это, в свою очередь, позволяет воспользоваться уравнениями состояния и иными расчетными формулами, полученными с целью равномерного распределения в системе параметров.
В некоторых конкретных случаях погрешности, обусловленные подобным упрощением, незначительны и при расчете реальных процессов их возможно не учитывать. Если в результате неравномерности процесс ощутимо отличается от идеальной равновесной модели, то в расчет внесут соответствующие поправки.
Условия равномерно распределенных параметров в системе при изменении ее состояния, по существу подразумевают взятие идеализированного процесса в качестве объекта исследования. Подобный процесс при этом состоит из бесконечно большого количества равновесных состояний.
Такой процесс возможно представить в формате протекающего настолько медленно, что в каждый конкретный момент времени в системе установится практически равновесное состояние. Степень приближения такого процесса к равновесному окажется тем большей, чем меньшей будет при этом скорость изменения системы.
В пределе мы приходим к бесконечно медленному процессу, предоставившему непрерывную смену для состояний равновесия. Подобный процесс равновесного изменения состояния будет называться квазистатическим (или как бы статическим). Такому виду процесса будет соответствовать бесконечно малая разность потенциалов между системой и окружающей средой.
Определение 3
При обратном направлении квазистатического процесса система будет проходить через состояния, аналогичные тем, что происходят в прямом процессе. Такое свойство квазистатических процессов называют обратимостью, а сами процессы при этом являются обратимыми.
Обратимый процесс в термодинамике
Рисунок 3. Обратимый процесс в термодинамике. Автор24 - интернет-биржа студенческих работ
Определение 4
Обратимый процесс (равновесный) – представляет термодинамический процесс, способный к прохождению и в прямом, и в обратном направлении (за счет прохождения через одинаковые промежуточные состояния), система при этом возвращается в исходное состояние без энергетических затрат, а в окружающей среде не остается никаких макроскопических изменений.
Обратимый процесс возможно в абсолютно любой момент времени заставить протекать в обратном направлении, за счет изменения какой-либо независимой переменной на бесконечно малую величину. Обратимые процессы могут давать наибольшую работу. Большую работу от системы получить невозможно ни при каких условиях. Это придает теоретическую важность обратимым процессам, реализовать которые на практике также нереально.
Такие процессы протекают бесконечно медленно, и становится возможным лишь приблизиться к ним. Важно отметить существенное отличие термодинамической обратимости процесса от химической. Химическая обратимость будет характеризовать направление процесса, а термодинамическая – способ, при котором он будет проводиться.
Понятия обратимого процесса и равновесного состояния играют очень значимую роль в термодинамике. Так, каждый количественный вывод термодинамики будет применим исключительно в отношении равновесных состояний и обратимых процессов.
Необратимые процессы термодинамики
Необратимый процесс невозможен к проведению в противоположном направлении посредством все тех же самых промежуточных состояний. Все реальные процессы считаются в физике необратимыми. В качестве примеров таких процессов выступают следующие явления:
- диффузия;
- термодиффузия;
- теплопроводность;
- вязкое течение и др.
Переход кинетической энергии (для макроскопического движения) в теплоту через трение (во внутреннюю энергию системы) будет представлять собой необратимый процесс.
Все осуществляемые в природе физические процессы подразделяются на обратимые и необратимые. Пусть изолированная система вследствие некоего процесса осуществит переход из состояния А в состояние В и затем возвратится в свое изначальное состояние.
Процесс, в таком случае, станет обратимым в условиях вероятного осуществления обратного перехода из состояния В в А через аналогичные промежуточные состояния таким путем, чтобы при этом не оставалось совершенно никаких изменений в окружающих телах.
Если осуществление подобного перехода невозможно и при условии сохранения по окончании процесса в окружающих телах или внутри самой системы каких-либо изменений, то процесс окажется необратимым.
Любой процесс, сопровождающийся явлением трения, станет необратимым, поскольку, в условиях трения, часть работы всегда превратится в тепло, оно рассеется, в окружающих телах сохранится след процесса – (нагревание), что превратит процесс (с участием трения) в необратимый.
Пример 1
Идеальный механический процесс, выполняемый в консервативной системе (без сил трения), стал бы обратимым. Примером подобного процесса можно считать колебания на длинном подвесе тяжеловесного маятника. По причине незначительной степени сопротивления среды, амплитуда маятниковых колебаний становится практически неизменной на протяжении продолжительного времени, кинетическая энергия колеблющегося маятника при этом оказывается полностью переходящей в его потенциальную энергию и обратно.
В качестве важнейшей принципиальной особенности всех тепловых явлений (где участвует громаднейшее количество молекул), будет выступать их необратимый характер. Примером процесса такого характера можно считать расширение газа (в частности, идеального) в пустоту.
Итак, в природе наблюдается существование двух видов принципиально различных процессов:
- обратимых;
- необратимых.
Согласно заявлению М. Планка, сделанного однажды, различия между такими процессами, как необратимые и обратимые, будут лежать значительно глубже, чем, к примеру, между электрическими и механическими разновидностями процессов. По этой причине, его с большим основанием (сравнительно с любым другим признаком) имеет смысл выбирать как первейший принцип в рамках рассмотрения физических явлений.
Обратимый процесс (то есть равновесный) -- термодинамический процесс, который может проходить как в прямом, так и в обратном направлении, проходя через одинаковые промежуточные состояния, причем система возвращается в исходное состояние без затрат энергии, и в окружающей среде не остается макроскопических изменений.
Обратимый процесс можно в любой момент заставить протекать в обратном направлении, изменив какую-либо независимую переменную на бесконечно малую величину.
Обратимые процессы дают наибольшую работу. Большую работу от системы вообще получить невозможно. Это придает обратимым процессам теоретическую важность. На практике обратимый процесс реализовать невозможно. Он протекает бесконечно медленно, и можно только приблизиться к нему.
Следует отметить, что термодинамическая обратимость процесса отличается от химической обратимости. Химическая обратимость характеризует направление процесса, а термодинамическая -- способ его проведения.
Понятия равновесного состояния и обратимого процесса играют большую роль в термодинамике. Все количественные выводы термодинамики применимы только к равновесным состояниям и обратимым процессам.
Необратимым называется процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния. Все реальные процессы необратимы. Примеры необратимых процессов: диффузия, термодиффузия, теплопроводность, вязкое течение и др. Переход кинетической энергии макроскопического движения через трение в теплоту, то есть во внутреннюю энергию системы, является необратимым процессом.
Все происходящие в природе физические процессы делятся на два типа - обратимые и необратимые.
Пусть изолированная система в результате некоторого процесса переходит из состояния А в состояние В и затем возвращается в начальное состояние. Процесс называется обратимым, если возможно осуществить обратный переход из В в А через те же промежуточные состояния так, чтобы при этом не осталось никаких изменений в окружающих телах. Если такой обратный переход осуществить нельзя, если по окончании процесса в самой системе или окружающих телах остались какие-то изменения, то процесс является необратимым.
Любой процесс, сопровождаемый трением, является необратимым, ибо при трении часть работы всегда превращается в тепло, тепло рассеивается, в окружающих телах остается след процесса - нагревание, что делает процесс с участием трения необратимым. Идеальный механический процесс, происходящий в консервативной системе (без участия сил трения), был бы обратимым. Примером такого процесса является колебание тяжелого маятника на длинном подвесе. Из-за малого сопротивления среды амплитуда колебаний маятника практически не изменяется в течение продолжительного времени, при этом кинетическая энергия колеблющегося маятника полностью переходит в его потенциальную энергию и обратно.
Важнейшей принципиальной особенностью всех тепловых явлений, в которых участвует громадное число молекул, является их необратимый характер. Примером необратимого процесса является расширение газа, даже идеального, в пустоту. Предположим, что нам дан закрытый сосуд, разделенный на две равные части заслонкой (рисунок. 1). Пусть в части I находится некоторое количество газа, а в части II - вакуум. Опыт показывает, что если убрать заслонку, то газ равномерно распределится по всему объему сосуда (расширится в пустоту). Это явление происходит как бы "само собой" без внешнего вмешательства. Сколько бы мы не следили в дальнейшем за газом, он будет всегда оставаться распределенным с одинаковой плотностью по всему сосуду; сколько бы мы ни ждали, нам не удастся наблюдать того, чтобы газ, распределенный по всему сосуду I + II сам собой, то есть без вмешательства извне, ушел из части II и сконцентрировался весь в части I, что дало бы нам возможность вновь вдвинуть заслонку и тем самым возвратиться к исходному состоянию. Таким образом, очевидно, что процесс расширения газа в пустоту является необратимым.
Рис 1.
Опыт показывает, что тепловые явления почти всегда обладают свойством необратимости. Так, например, если рядом находятся два тела, из которых одно теплее другого, то их температуры постепенно выравниваются, то есть тепло "само собой" перетекает от более теплого тела к более холодному. Однако обратный переход теплоты от более холодного тела к нагретому, который может быть осуществлен в холодильной машине, не идет "сам собой". Для осуществления такого процесса требуется затрата работы еще какого-либо тела, что приводит к изменению состояния этого тела. Следовательно, условия обратимости не выполняются.
Кусочек сахара, помещенный в горячий чай, растворяется в нем, но никогда не бывает, чтобы из горячего чая, в котором уже растворен кусочек сахара, этот последний выделился и вновь собрался в виде кусочка. Конечно, получить сахар, выпарив его из раствора, можно. Но этот процесс сопровождается изменениями в окружающих телах, что свидетельствует о необратимости процесса растворения. Необратимым является и процесс диффузии. И вообще примеров необратимых процессов можно привести сколь угодно много. По сути, любой процесс, протекающий в природе в реальных условиях, является необратимым.
Итак, в природе существуют два вида принципиально различных процессов - обратимые и необратимые. М. Планк сказал однажды, что различие между обратимыми и необратимыми процессами лежит гораздо глубже, чем, например, между процессами механическими и электрическими, поэтому его с большим основанием, чем любой другой признак, следовало бы выбрать в качестве первейшего принципа при рассмотрении физических явлений.