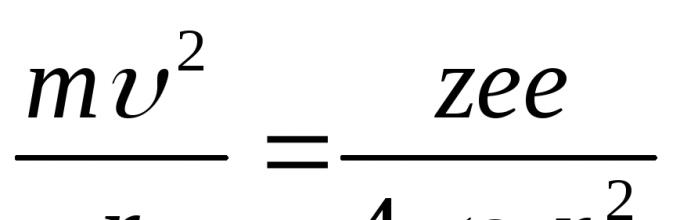После нескольких месяцев работы Бор в 1913 г. опубликовал свою квантовую теорию атома. Основу этой теории составляют три постулата.
Первый постулат Бора :
Атом может находиться не во всех состояниях, допускаемых классической физикой, а только в особых, квантовых (или стационарных) состояниях, каждому из которых соответствует своя определенная энергия Е n . В стационарном состоянии атом не излучает и не поглощает энергию.
Второй постулат Бора:
При переходе атома из одного стационарного состояния в другое излучается или поглощается квант света с энергией ћω, равной разности энергий стационарных состояний (рис.25.5):
ћω = |Е n 2 -Е n 1 | (25.1)
Е n 1 - энергия в начальном состоянии, Е n 2 - энергия в конечном состоянии.
Третий постулат Бора:
В стационарном состоянии электрон может двигаться только по такой («разрешенной») орбите, радиус которой удовлетворяет условию:
m·υ·r=n·ћ (25.2)
Условие стационарности электронных орбит, где m·υ·r - момент импульса электрона, n - номер квантового состояния (n =1, 2, 3, ...).
Целое число n, определяющее номер квантового состояния и энергию атома в этом состоянии, называется главным квантовым числом .
Применив свою теорию к простейшему из атомов - атому водорода, Бор получил результаты, полностью согласующиеся с экспериментальными данными.
Рассмотрим простейший атом - атом водорода. Он состоит из ядра, в состав которого входит один протон, и одного электрона, вращающегося вокруг ядра по круговой орбите. На электрон со стороны ядра действует кулоновская сила притяжения, сообщая ему центростремительное ускорение, поэтому
 (25.3)
(25.3)
[е - заряд электрона и протона, ε о - электрическая постоянная].
Поскольку должен выполняться первый постулат Бора, воспользуемся условием стационарности электронных орбит. Определим из него скорость υ
 (25.4)
(25.4)
возведем в квадрат и подставим в (25.4). Из полученного выражения найдем

отсюда радиус орбит электрона в атоме водорода равен
 (25.5)
(25.5)
Подставляя в (25.5) значения констант и считая n = 1, получаем значение первого боровского радиуса, который является единицей длины в атомной физике:
r Б = 0,528-10 -10 м.
§ 25.3 Энергия атома водорода
По боровской модели ядро атома считается неподвижным, поэтому полная энергия Е атома является суммой кинетической энергии Е к вращения электрона и потенциальной энергии Е п взаимодействия электрона с ядром:


 (25.6)
(25.6)
Полученное значение Е отрицательно, так как потенциальная энергия двух зарядов, находящихся на бесконечно большом расстоянии, предполагается равной нулю. При сближении зарядов потенциальная энергия уменьшается.
Каждое значение энергии, которой обладает атом в том или ином стационарном состоянии, называют энергетическим уровнем . Чем больше n, тем дальше от ядра находится электрон и тем выше его энергетический уровень.
Энергетические уровни атома принято изображать горизонтальными линиями, а переходы атома из одного стационарного состояния в другое - стрелками (рис.25.6).
Когда атом переходит с более высокого на более низкий уровень (чему соответствует «перескок» электрона на более близкую к ядру орбиту), то происходит излучение кванта света. При поглощении, наоборот, падающий на атом квант (фотон) переводит атом из состояния с меньшей в состояние с большей энергией; сам фотон при этом исчезает, а поглотивший его электрон оказывается на более далекой от ядра орбите.
С остояние
атома сn
=1 называют основным
или нормальным состоянием
.
В этом состоянии энергия атома минимальна,
и он может находиться в нем (при
отсутствии внешних воздействий) сколь
угодно долго.
остояние
атома сn
=1 называют основным
или нормальным состоянием
.
В этом состоянии энергия атома минимальна,
и он может находиться в нем (при
отсутствии внешних воздействий) сколь
угодно долго.
Все остальные состояния с n>1 называют возбужденными . В возбужденном состоянии атом может находиться в течение очень малого промежутка времени (порядка 10 -8 с), после чего самопроизвольно переходит в основное состояние (сразу или поэтапно, уровень за уровнем), излучая при этом соответствующие кванты.
В основном состоянии атом водорода обладает энергией Е і = -13,6 эВ. При переходе в возбужденные состояния его энергия возрастает.
Минимальную энергию, которую нужно затратить для удаления электрона с первой боровской орбиты на «бесконечность», называют энергией ионизации W і или энергией связи атома водорода.
Таким образом, для ионизации атома водорода, находящегося в основном состоянии, ему необходимо сообщить энергию ΔЕ = W і = 13,6 эВ. Если же ему будет передаваться энергия ΔЕ < W і , то при ΔЕ=Е n -Е і атом перейдет в состояние с энергией Е п, а при ΔЕ ≠ Е n -Е і поглощения энергии не произойдет и атом останется в прежнем состоянии.
Такой («скачкообразный») характер поглощения энергии должен наблюдаться для атомов любого химического элемента. Для атомов ртути он был обнаружен уже в 1913 г. немецкими физиками-экспериментаторами Д. Франком и Г. Герцем. Их опыты подтвердили существование в атомах дискретных энергетических уровней, что сыграло важнейшую роль в развитии квантовой теории атома.
Существование дискретных энергетических уровней является фундаментальным свойством атомов (так же как и молекул, и атомных ядер).
Попробуем применить известные нам законы физики, чтобы представить себе устройство атома, объясняющее дискретность его энергетических уровней.
Рассмотрим простейший из атомов - атом водорода. Порядковый номер водорода в периодической системе элементов равен единице, следовательно, водородный атом состоит из положительного ядра, заряд которого равен , и одного электрона. Между ядром и электроном действует сила притяжения зарядов. Наличие этой силы обеспечивает радиальное (центростремительное) ускорение, благодаря чему легкий электрон вращается вокруг тяжелого ядра по круговой или эллиптической орбите точно так же, как планета вращается вокруг Солнца под влиянием силы тяготения. Различным возможным состояниям атома соответствует, таким образом, различие в размерах (и форме) орбиты электрона, вращающегося вокруг ядра.
Энергия электрона в атоме слагается из кинетической энергии движения по орбите и потенциальной энергии в электрическом поле ядра. Можно показать (см. в конце параграфа), что энергия электрона на круговой орбите, а следовательно, и энергия атома в целом зависят от радиуса орбиты: меньшему радиусу орбиты соответствует меньшая энергия атома. Но, как мы видели в § 204, энергия атома может принимать не любые, а только определенные избранные значения. Так как энергия определяется радиусом орбиты, то каждому энергетическому уровню атома отвечает орбита определенного избранного радиуса.
Картина возможных круговых орбит электрона в атоме водорода изображена на рис. 367. Основному энергетическому уровню атома соответствует орбита наименьшего радиуса.

Рис. 367. Возможные орбиты электрона в атоме водорода: радиус орбит возрастает пропорционально , т.е. в отношении и т.д.
Нормально электрон находится на этой орбите. При сообщении достаточно большой порции энергии электрон переходит на другой энергетический уровень, т. е. «перескакивает» на одну из внешних орбит. Как указывалось, в таком возбужденном состоянии атом неустойчив. Через некоторое время электрон переходит на более низкий уровень, т. е. «перескакивает» на орбиту меньшего радиуса. Переход электрона с дальней орбиты на ближнюю сопровождается испусканием светового кванта.
Итак, из ядерной модели атома и дискретности его энергетических уровней вытекает существование избранных, «разрешенных», орбит электрона в атоме. Встает вопрос, почему электрон не может вращаться вокруг ядра по орбите произвольного радиуса. В чем физическое различие дозволенных и недозволенных орбит?
Законы механики и электричества, знакомые нам из предыдущих разделов учебника (см. тома I, II), не дают на эти вопросы никакого ответа. С точки зрения этих законов все орбиты совершенно равноправны. Существование выделенных орбит противоречит этим законам.
Не менее разительным противоречием известным нам законам физики является устойчивость атома (в основном состоянии). Мы знаем, что всякий заряд, движущийся с ускорением, излучает электромагнитные волны. Электромагнитное излучение уносите собой энергию. В атоме электрон движется с большой скоростью по орбите малого радиуса и, следовательно, обладает огромным центростремительным ускорением. Согласно известным нам законам электрон должен терять энергию, излучая ее в виде электромагнитных волн. Но, как было указано выше, если электрон теряет энергию, радиус его орбиты уменьшается. Следовательно, электрон не может вращаться по орбите постоянного радиуса. Расчеты показывают, что в результате уменьшения радиуса орбиты из-за излучения электрон должен был бы упасть на ядро за стомиллионную долю секунды. Этот вывод резко противоречит нашему ежедневному опыту, который свидетельствует об устойчивости атомов.
Итак, существует противоречие между данными о строении атома, полученными из эксперимента, и между основными законами механики и электричества, также найденными на опыте.
Но не следует забывать, что упомянутые законы найдены и проверены в экспериментах с телами, содержащими очень большое количество электронов, большое количество атомов. Мы не имеем основания считать, что эти законы применимы к движению отдельного электрона в атоме. Более того, расхождение между поведением электрона в атоме и законами классической физики указывает на неприменимость этих законов к атомным явлениям (см. также § 210).
Выше мы изложили так называемую планетарную модель атома, т.е. представление об электронах, вращающихся по разрешенным орбитам вокруг атомного ядра. При обосновании планетарной модели мы пользовались законами классической физики. Но, как уже отмечалось и как мы увидим подробнее в § 210, движение электрона в атоме относится к области явлений, в которой классическая механика неприменима. Неудивительно поэтому, что более глубокое изучение «микромира» показало неполноту, грубую приближенность планетарной модели; действительная картина атома сложнее. Все же эта модель отражает правильно многие основные свойства атома, и поэтому, несмотря на приближенность, ею иногда пользуются.
Рассмотрим
зависимость энергии атома водорода от радиуса электронной орбиты. Кинетическую энергию движения
электрона по орбите радиуса мы определим из того условия, чту центростремительное
ускорение обеспечивается
силой кулонного притяжения зарядов (в системе СИ ). Приравнивая ускорение создаваемое этой
силой, центростремительному ускорению , найдем, что кинетическая энергии электрона
обратно
пропорциональна радиусу орбиты, т.е. ![]() .
.
Выделим
две орбиты радиуса и . Кинетическая энергия вращения
электрона на второй орбите больше, чем на первой на величину  .
.
Если орбиты недалеко отстоят одна от другой, то и . Поэтому в знаменателе можно пренебречь величиной , и разница кинетических энергий будет приближенно равна .
Потенциальная энергия электрона, напротив, больше на первой, далекой орбите, ибо для удаления электрона от ряда нужно совершить работу против сил электрического притяжения, действующих между электроном и ядром; эта работа идет на увеличение потенциальной энергии.
Пусть
электрон переводится с ближней орбиты на дальнюю по радиальному пути. Длина пути
равна ![]() . Электрическая сила вдоль этого пути непостоянна по модулю. Но
так как орбиты близки одна к другой , можно для приближенного вычисления
работы использовать значение силы на среднем расстоянии электрона от ядра,
равном
. Электрическая сила вдоль этого пути непостоянна по модулю. Но
так как орбиты близки одна к другой , можно для приближенного вычисления
работы использовать значение силы на среднем расстоянии электрона от ядра,
равном ![]() .
По закону Кулона сила есть , а работа на пути , равная приросту
потенциальной энергии, будет равна .
.
По закону Кулона сила есть , а работа на пути , равная приросту
потенциальной энергии, будет равна .
Таким образом, при переходе электрона с дальней орбиты на ближнюю уменьшение его потенциальной энергии равно удвоенному приросту кинетической энергии. Мы доказали эту теорему для близких орбит, расстояние между которыми удовлетворяет условию . Суммируя изменения энергии электрона при переходах между последовательными парами близких орбит, убеждаемся, что теорема справедлива и для сколь угодно удаленных орбит.
Рассмотрим
теперь бесконечно далекую орбиту, т. е. . Потенциальную энергию электрона на
ней примем за начало отсчета потенциальной энергии, т. е. положим ![]() . Кинетическая
энергия
. Кинетическая
энергия ![]() обращается
при в нуль; при переходе с орбиты на конечную
орбиту радиуса она
возрастет на величину . Потенциальная энергия уменьшится
на вдвое большую величину , т. е.
обращается
при в нуль; при переходе с орбиты на конечную
орбиту радиуса она
возрастет на величину . Потенциальная энергия уменьшится
на вдвое большую величину , т. е.
 .(206.1)
.(206.1)
Полная
энергия электрона равна, следовательно, ![]() ; она тем меньше (знак минус!), чем
меньше радиус орбиты.
; она тем меньше (знак минус!), чем
меньше радиус орбиты.
Вернемся в 1911 год. К этому времени дискретность микромира проявилась наиболее ярко в атомных спектрах. Оказалось, что атомы поглощают и испускают свет только определенной длины волны, причем спектральные линии группируются в так называемые серии (рис. 3.1).
Рис. 3.1. Длины волн, излучаемые атомом водорода: спектр состоит из серий (показаны три первые)
-
последовательностей линий, сгущающихся к некоторому (своему для каждой серии) предельному минимальному
значению ; только четыре линии серии Бальмера лежат в видимом диапазоне

Рис. 3.2. (a) Линейчатые спектры излучения газообразных водорода, ртути и гелия: (b) спектр поглощения водорода

Рис. 3.3. Непрерывные спектры излучения дают нагретые твёрдые и жидкие вещества, сильно сжатые газы, высокотемпературная плазма
Для спектра водорода, простейшего из атомов, была установлена (не выведена, а угадана!) несложная формула
|
|
Здесь -
длина волны излучения атома водорода, n
и k > n
-
целые числа, R
-
так называемая постоянная Ридберга
(![]() , где -
внесистемная единица энергии «Ридберг», равная половине атомной единице энергии).
Оказалось, что серия Лаймана описывается этой формулой при значениях ,
серия Бальмера -
при , серия Пашена -
при и т. д. Предельные (минимальные) значения для длин волн получаются из (3.1) при :
, где -
внесистемная единица энергии «Ридберг», равная половине атомной единице энергии).
Оказалось, что серия Лаймана описывается этой формулой при значениях ,
серия Бальмера -
при , серия Пашена -
при и т. д. Предельные (минимальные) значения для длин волн получаются из (3.1) при :
![]()

Рис. 3.4. Йоханнес Роберт Ридберг (1854–1919)

Рис. 3.5. Теодор Лайман (1874–1954)

Рис. 3.6. Спектральная серия Лаймана

Рис. 3.7. Иоганн Якоб Бальмер (1825–1898)
Рис. 3.8. Видимые линии излучения водорода в серии Бальмера. Hα - красная линия справа, имеющая длину волны 656,3 нм. Самая левая линия - Hε, соответствует излучению уже в ультрафиолетовой области спектра на длине волны 397,0 нм

Рис. 3.9. Луис Карл Генрих Фридрих Пашен (1865–1947)
Рис. 3.10. Все линии серии Пашена расположены в инфракрасном диапазоне
Кроме того, в результате изучения свойств газов к тому времени было известно, что размеры атомов приблизительно
равны . Поэтому теория, объясняющая спектр и размеры атомов, должна была включать в себя какой-то параметр, позволяющий построить величину с размерностью длины (постоянных e
и m
-
заряда и массы электрона -
для этого недостаточно). Такого параметра в классической теории не было. Им могла бы стать постоянная Ридберга, но ее происхождение было темно и загадочно.
В 1911 году Э. Резерфорд опубликовал теоретическую работу (Rutherford E., Philosophical Magazine, v. 21, p. 669–688 , 1911), в которой на базе анализа экспериментов, выполненных в 1908–1909 годах его учениками - стажером Гансом Гейгером и аспирантом Эрнстом Марсденом - (Geiger H., Marsden T., Proceedings of the Royal Society of London, Series A, v. 82, p. 495–499 , 1909) утверждал наличие внутри атома положительно заряженного ядра, в котором сосредоточена практически вся масса атома.

Рис. 3.11. Эрне́ст Ре́зерфорд (1871–1937)
Видео 3.2. Немного истории. Черная шляпа и модель рассеяния.В последствии, в одной из своих лекций сам Э. Резерфорд вспоминал о тех временах следующим образом (цитируется по книге Дж. Тригг, Решающие эксперименты в современной физике, Москва, «МИР», 1974, стр. 77): «…Я помню… ко мне пришел очень взволнованный Гейгер и сказал: «Мы, кажется, получили несколько случаев рассеяния - частиц назад…». Это самое невероятное событие, которое было в моей жизни. Это почти также невероятно, как если бы вы выстрелили 15-дюймовым снарядом в папиросную бумагу и он, отразившись от неё, попал бы в вас. При анализе этого я понял, что такое рассеяние назад должно быть результатом однократного столкновения и, проведя расчеты, увидел, что это никоим образом невозможно, если не предположить, что подавляющая часть массы атома сконцентрирована в крошечном ядре. Именно тогда у меня и зародилась идея об атоме с крошечным массивным центром, в котором сосредоточен заряд». От себя добавим, что слова «рассеяние назад» фактически означали рассеяние на 150 градусов, рассеяние на большие углы не позволяла наблюдать конструкция использованной в тот момент установки.
Принципиальная схема опытов Резерфорда представлена на рис. 3.12. Схему реальной установки можно найти в цитированной выше книге Дж. Тригга.

Рис. 3.12. Схема опыта Резерфорда по рассеянию - частиц
Видео 3.3. Натурный опыт Резерфорда на лабораторной установке. Видео 3.4. Опыт Резерфорда «изнутри» (лабораторная установка). Видео 3.5. Компьютерная модель опыта Резерфорда.От радиоактивного источника, заключенного в свинцовый контейнер, частицы направлялись на тонкую фольгу Ф из исследуемого металла. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных частиц в опыте Резерфорда можно было проводить под различными углами к первоначальному направлению пучка. Было обнаружено, что большинство частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30° . Очень редкие частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к . Очевидно, что частица может быть отброшена назад, только если положительный заряд атома и его масса сосредоточены в очень малом объеме внутри атома. Таким образом, было открыто атомное ядро - тело малых по сравнению с атомом размеров, в котором сосредоточен весь положительный заряд и практически вся его масса. Размеры ядра были оценены Э. Резерфордом в работе 1911 года, оценка дала меньше или порядка .
Видео 3.6. Прицельный параметр и форма траектории. Видео 3.7. Заряд рассеиваемой частицы и форма траектории. Видео 3.8. Энергия рассеиваемой частицы и форма траектории. Видео 3.9. Заряд ядра и форма траектории.
Рис. 3.13. Схема рассеяния альфа-частиц на ядре атома золота

Рис. 3.14. Схема рассеяния потока альфа-частиц в тонкой золотой фольге
Возникла планетарная модель атома водорода: протон с электроном на орбите. Физики любят единые модели, а здесь так красиво в малом повторялось большое, в атоме - Солнечная система.

Рис. 3.15. Схема ядерной (планетарной) модели атома Резерфорда
Проблема состояла в том, что электрон, совершающий финитное, а следовательно - ускоренное движение около ядра, должен упасть на ядро. Дело в том, что электрон заряжен и при ускоренном движении должен испускать электромагнитное излучение, то есть стационарное движение невозможно. Классическая электродинамика предсказывает, что, быстро потеряв свою энергию и момент импульса орбитального движения, электрон должен упасть на ядро примерно за . Свет за это время проходит около 1.5 см (получается, что мы видим лишь «мертвые» атомы, но это не так!). Резерфорд понимал проблему, но сознательно концентрировался на факте существования ядра, полагая, что вопрос об устойчивости атома будет решен при исследовании поведения атомных электронов. Это суждено было сделать в 1913 г. Н. Бору , предложившему новую теорию атома.


Рис. 3.16. Неустойчивость модели атома Резерфорда
Постулаты Бора
Первый постулат Бора
Здесь прослеживается «насильственное» введение дискретности (разрешены не все орбиты), а также типичное для физики «заметание проблемы под ковер»: если чему-то не находится объяснений, принимают это как данность и изучают следствия в надежде, что когда-нибудь поймут и причину.

Рис. 3.17. Иллюстрация первому постулату Бора
Второй постулат Бора
Этот постулат отражает сохранение энергии и соотношение Планка – Эйнштейна .

Рис. 3.18. Иллюстрация ко второму постулату Бора
Третий постулат Бора
Неизбежное следствие: так как остальные орбиты для электрона запрещены, переход осуществляется скачком; о пути и энергии электрона между орбитами говорить не имеет смысла: законы механики там не применимы.
Четвертый постулат Бора
Постоянная Планка ħ имеет размерность момента количества движения и вместе с зарядом электрона е и его массой m позволяет образовать параметр размерности длины. Это приводит к возможности вычислить размеры атома.

Рис. 3.19. Нильс Хе́нрик Дави́д Бор (1885–1962)
Применение постулатов Бора
Классическая механика для электрона, вращающегося по круговой орбите радиусом R со скоростью v вокруг ядра с зарядом Ze , дает уравнение движения


Поэтому энергия Е и момент импульса L электрона выражаются через радиус орбиты R :

Если к последнему выражению применение условие квантования Бора L=nħ (n=1, 2, 3, … ), то получатся следующие результаты.

Рис. 3.20. Модель атома Бора
Характеристики водородоподобного атома
Радиусы разрешенных орбит
|
|
Энергия электрона на стационарной орбите
Константа а
В
,
имеющая размерность длины, называется радиусом Бора: ![]() . Смысл числа -
номер разрешенной орбиты. Радиус Бора -
радиус низшей орбиты в атоме водорода .
. Смысл числа -
номер разрешенной орбиты. Радиус Бора -
радиус низшей орбиты в атоме водорода .
Формула (3.3) определяет дискретные значения энергии, которые может иметь электрон в атоме водорода, или, как говорят, энергетические уровни. Отрицательные значения соответствуют связанным состояниям электрона в атоме, то есть движениям в ограниченной области пространства (аналог в классической физике - движение планет по эллипсам в отличие от гиперболических и параболических траекторий, уходящих на бесконечность).
При решении задач о поведении электрона в атоме обычно возникают выражения, включающие квадрат электрического заряда электрона в комбинации с электрической постоянной . Весьма полезно ввести безразмерную комбинацию фундаментальных мировых постоянных - так называемую постоянную тонкой структуры :
|
|
которая, совместно с атомным номером и номером орбиты , определяет масштаб релятивистских эффектов в атоме. Для того, чтобы это было лучше видно, перепишем формулу (3.3) так, чтобы в её правую часть входила постоянная тонкой структуры:

Из-за множителя характерные для атома энергии оказываются на четыре порядка меньше энергии покоя электрона. Это проявление нерелятивизма достаточно легких атомных систем. Как видно из последнего выражения в приведенной выше формуле, релятивистские эффекты перестают быть малыми поправками для ближних к ядру электронов в тяжелых атомах.
Пример 1. Определим скорость электрона на n -й орбите атома Бора. Радиус n-й орбиты определяется формулой
где а В - радиус Бора. Скорость электрона v можно выразить через момент импульса L=nħ:

Выражение для радиуса Бора упростим, используя введенную постоянную тонкой структуры:
|
|
Подставляя это выражение в полученную выше формулу для скорости электрона, получаем для n -й орбиты
Рис. 3.21. Схема энергетических уровней и переходов в атоме водорода по теории Бора:
сплошные линии (переходы сверху вниз) - излучение, пунктирные линии (переходы снизу вверх) - поглощение.
Показаны границы (пределы) серий ![]() , которым соответствуют переходы с уровня с
, которым соответствуют переходы с уровня с
- границы между континуумом и дискретным спектром
Экспериментальное подтверждение утверждение Бора о дискретности энергетического спектра атомов нашло в опытах Франка - Герца, которые заключались в бомбардировке паров ртути электронами в вакуумной трубке и измерении зависимости анодного тока от ускоряющей разности потенциалов. Схема опыта приведена на рис. 3.22.

Рис. 3.22. Схема опыта Франка - Герца
В трубке, заполненной парами ртути под небольшим давлением (около 1 мм. рт. ст.), имеются три электрода: анод, катод и сетка. Электроны, вылетающие с поверхности подогретого катода вследствие термоэлектронной эмиссии, ускоряются напряжением U , приложенным между катодом и сеткой. Это напряжение можно менять с помощью потенциометра П . Между анодом и сеткой приложено слабое обратное поле с разностью потенциалов порядка 0,5ВВ , тормозящее движение электронов к аноду. Определялась зависимость тока I в цепи анода от приложенного напряжения U . Полученные результаты приведены на рис. 3.23.

Рис. 3.23. Зависимость тока I в цепи анода от приложенного напряжения U в опыте Франка - Герца
Сила тока сначала монотонно возрастает, достигает максимума при напряжении 4,9 В , после чего с ростом U резко падает, достигает минимума и снова начинает расти. Максимумы силы тока повторяются при напряжениях 9,8 В , 14,7 В и т. д. Чередование максимумов на равном расстоянии друг от друга доказало дискретность изменения энергии атома.
Видео 3.10. Опыт Франка и Герца. Демонстрационная установка. Видео 3.11. Опыт Франка и Герца. Сравнение ВАХ для неона и гелия. Видео 3.12. Опыт Франка и Герца. Лабораторная установка 1. Видео 3.12. Опыт Франка и Герца. Лабораторная установка 2.
Атомный номер элемента - целое число, так что после округления получаем Z = 2 , что соответствует гелию.
Как отмечалось выше, еще до появления теории Бора был изучен спектр водородного атома и эмпирически установлена формула (3.1). Но при наблюдении спектра Солнца были замечены линии, казалось бы, нарушающие эту формулу, так как они соответствовали полуцелым значениям n и k . После появления теории Бора стало ясно, что квантовые числа n и k все-таки должны быть целыми, а кажущиеся полуцелые значения можно объяснить по-другому. Действительно, из формулы (3.6) для частот, испускаемых водородоподобным атомом,следует, что

то есть наблюдавшиеся линии принадлежат иону элемента с Z = 2 . Как известно, этот элемент носит «солнечное» имя - гелий.
13.7. Атом водорода (водородоподобный атом) по теории Бора
13.7.3. Орбиты электрона в атоме
Согласно правилу квантования орбит ( принципу Зоммерфельда ) связь между энергией стационарных состояний электрона в атоме, радиусом его орбиты и скоростью на этой орбите задается формулой
mvr = n ℏ,
где m - масса электрона, m = 9,11 ⋅ 10 −31 кг; v - скорость электрона; r - радиус орбиты электрона; ℏ - приведенная постоянная Планка, ℏ = h /2π ≈ 1,055 ⋅ 10 −34 Дж ⋅ с; h - постоянная Планка, h = 6,626 ⋅ 10 −34 Дж ⋅ с; n - главное квантовое число.
Из правила квантования орбит следует, что стационарным состояниям электрона в атоме соответствуют только такие орбиты электронов, для которых выполняется условие
mv n r n = n ℏ,
где r n - радиус электрона на орбите с номером n ; v n - скорость электрона на орбите с номером n ; m - масса электрона, m = 9,11 ⋅ 10 −31 кг; ℏ - приведенная постоянная Планка, ℏ = h /2π ≈ 1,055 ⋅ 10 −34 Дж ⋅ с; h - постоянная Планка, h = 6,626 ⋅ 10 −34 Дж ⋅ с; n - главное квантовое число.
Радиус стационарной орбиты электрона
r n = ℏ 2 n 2 k Z e 2 m ,
где k = 1/4πε 0 ≈ 9 ⋅ 10 9 Н ⋅ м 2 /Кл 2 ; ε 0 - электрическая постоянная, ε 0 = 8,85 ⋅ 10 −12 Ф/м; Z - порядковый номер элемента; e - заряд электрона, e = −1,6 ⋅ 10 −19 Кл; m - масса электрона, m = 9,11 ⋅ 10 −31 кг; ℏ - приведенная постоянная Планка, ℏ = h /2π ≈ 1,055 ⋅ 10 −34 Дж ⋅ с; h - постоянная Планка, h = 6,626 ⋅ 10 −34 Дж ⋅ с; n - главное квантовое число.
Радиус первой орбиты электрона в атоме водорода (Z = 1 и n = 1) равен
r 1 = ℏ 2 k e 2 m = 0,53 ⋅ 10 − 10 м
и называется первым боровским радиусом .
Для упрощения вычислений радиуса n-й орбиты электрона в водородоподобном атоме применяют формулу
r (Å) = 0,53 ⋅ n 2 Z ,
где r (Å) - радиус в ангстремах (1 Å = 1,0 ⋅ 10 −10 м); Z - порядковый номер химического элемента в Периодической системе элементов Д.И. Менделеева; n = 1, 2, 3, … - главное квантовое число.
Скорость электрона на стационарной орбите в водородоподобном атоме определяется формулой
v n = k Z e 2 n ℏ ,
где k = 1/4πε 0 ≈ 9 ⋅ 10 9 Н ⋅ м 2 /Кл 2 ; ε 0 - электрическая постоянная, ε 0 = 8,85 ⋅ 10 −12 Ф/м; Z - порядковый номер элемента; e - заряд электрона, e = −1,6 ⋅ 10 −19 Кл; ℏ - приведенная постоянная Планка, ℏ = = h /2π ≈ 1,055 ⋅ 10 −34 Дж ⋅ с; h - постоянная Планка, h = 6,626 ⋅ 10 −34 Дж ⋅ с; n - главное квантовое число.
Скорость электрона на первой орбите в атоме водорода (Z = 1 и n = 1) равна
v n = k e 2 ℏ = 2,2 ⋅ 10 6 м/с.
Для упрощения вычислений величины скорости электрона на n-й орбите в водородоподобном атоме применяют формулу
v (м/с) = 2,2 ⋅ 10 6 ⋅ Z n ,
где v (м/с) - модуль скорости в м/с; Z - порядковый номер химического элемента в Периодической системе элементов Д.И. Менделеева; n = 1, 2, 3, … - главное квантовое число.
Пример 21. Электрон в атоме гелия переходит с первой орбиты на орбиту, радиус которой в 9 раз больше. Найти энергию, поглощенную атомом.
Решение . Энергия, поглощенная атомом гелия, равна разности энергий:
∆E = E 2 − E 1 ,
где E 1 - энергия электрона, соответствующая радиусу орбиты r 1 ; E 2 - энергия электрона, соответствующая радиусу орбиты r 2 .
Энергии электрона в атоме гелия (Z = 2) определяются следующими формулами:
- в состоянии с главным квантовым числом n 1 = 1 -
E 1 (эВ) = − 13,6 Z 2 n 1 2 = − 54,4 эВ;
- состоянии с главным квантовым числом n 2 -
E 2 (эВ) = − 54,4 n 2 2 .
Для определения энергии E 2 воспользуемся выражением для радиусов соответствующих орбит:
- для орбиты с главным квантовым числом n 1 = 1 -
r 1 (Å) ≈ 0,53 n 1 2 Z = 0,265 Å ;
- орбиты с главным квантовым числом n 2 -
r 2 (Å) ≈ 0,265 n 2 2 .
Отношение радиусов
r 2 (Å) r 1 (Å) = 0,265 n 2 2 0,265 = n 2 2
позволяет определить главное квантовое число второго состояния:
n 2 = r 2 (Å) r 1 (Å) = 9 = 3 ,
где r 2 /r 1 - заданное в условии отношение радиусов орбит, r 2 /r 1 = 9.
Из отношения энергий
E 2 E 1 = 1 n 2 2
следует, что энергия электрона в атоме гелия во втором состоянии
E 2 = E 1 n 2 2 = − 54,4 эВ 3 2 = − 6,04 эВ.
Энергия, поглощенная атомом при указанном переходе, является разностью
∆E = E 2 − E 1 = −6,04 − (−54,4) = 48,4 эВ.
Следовательно, при указанном переходе атом поглотил энергию, равную 48,4 эВ.
Выход из тупика был найден датским ученым Нильсом Бором в 1913 году, получившим Нобелевскую премию в 1922 году.
Бор высказал предположения, которые были названы постулатами Бора .
· Первый постулат (постулат стационарных состояний ): электроны движутся только по определенным (стационарным ) орбитам. При этом , даже двигаясь с ускорением , они не излучают энергию.
· Второй постулат (правило частот ): излучение и поглощение энергии в виде кванта света (h n ) происходит лишь при переходе электрона из одного стационарного состояния в другое. Величина светового кванта равна разности энергий тех стационарных состояний , между которыми совершается скачок электрона: .
Отсюда следует, что изменение энергии атома, связанное с излучением при поглощении фотона, пропорционально частоте ν:
Правило квантования орбит : из всех орбит электрона возможны только те , для которых момент импульса равен целому кратному постоянной Планка:
| , | (6.3.2) |
где n = 1, 2, 3,… – главное квантовое число.
Получим выражение для энергии электрона в атоме.
Рассмотрим электрон (рис. 6.6,а), движущийся со скоростью в поле атомного ядра с зарядом Ze (при Z = 1 – атом водорода).
 | |||
| а | б |
Уравнение движения электрона имеет вид:
|
|
(6.3.3) |
Из формулы (6.3.3) видно, что центробежная сила равна кулоновской силе, где .
Подставим значение υ из (6.3.2) в (6.3.3) и получим выражение для радиусов стационарных орбит (рис.6.6,б):
| . | (6.3.4) |
Радиус первой орбиты водородного атома называют боровским радиусом . При n =1, Z = 1 для водорода имеем:
![]() Å = 0,529·10 –10 м.
Å = 0,529·10 –10 м.
Внутренняя энергия атома слагается из кинетической энергии электрона (ядро неподвижно) и потенциальной энергией взаимодействия электрона с ядром:
![]() .
.
Из уравнения движения электрона следует, что , т.е. кинетическая энергия равна потенциальной. Тогда можно записать:
![]() .
.
Подставим сюда выражение для радиуса первой орбиты и получим:
|
|
(6.3.5) |
Здесь учтено, что постоянная Планка , т.е. .
Для атома водорода при Z = 1 имеем:
|
|
(6.3.6) |
Из формулы (6.3.6) видно, что принимает только дискретные значения энергии, т.к. n = 1, 2, 3….
Схема энергетических уровней, определяемых уравнением (6.3.6) показана на рис. 6.1 и 6.7.


При переходе электрона в атоме водорода из состояния n в состояние k излучается фотон с энергией:
![]() .
.
Частота излучения:
![]() .
.
Получена обобщенная формула Бальмера, которая хорошо согласуется с экспериментом. Выражение перед скобками, как уже было сказано, носит название постоянной Ридберга :
![]() .
.
Серьезным успехом теории Бора явилось вычисление постоянной Ридберга для водородоподобных систем и объяснение структуры их линейчатых спектров. Бору удалось объяснить линии спектра ионизованного гелия. Он теоретически вычислил отношение массы протона к массе электрона , что находилось в соответствии с экспериментом, является важным подтверждением основных идей, содержащихся в его теории. Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913–1925) были сделаны важные открытия, навсегда вошедшие в сокровищницу мировой науки.
Однако, наряду с успехами, в теории Бора с самого начала обнаружились существенные недостатки. Главнейшим из них была внутренняя противоречивость теории: механическое соединение классической физики с квантовыми постулатами. Теория не могла объяснить вопрос об интенсивностях спектральных линий. Серьезной неудачей являлась абсолютная невозможность применить теорию для объяснения спектров атома гелия, содержащего два электрона на орбите и тем более для многоэлектронных атомов (рис. 6.8).

Стало ясно, что теория Бора является лишь переходным этапом на пути создания более общей и правильной теории. Такой теорией и явилась квантовая механика.
Для просмотра демонстраций щелкните по соответствующей гиперссылке: