Технологии очистки
Направления деятельности
Применяемое оборудование
Задать вопрос специалисту
Традиционно показатели качества воды подразделяют на физические (температура, цветность, вкус, запах, мутность и т.д.), химические (водородный показатель воды pH, щелочность, жесткость, окисляемость, общая минерализация (сухой остаток) и т.д.) и санитарно-бактериологические (общая бактериальная загрязненность воды, коли-индекс, содержание в воде токсичных и радиоактивных компонентов и др.).
Для определения, насколько вода соответствует требуемым нормам, документально устанавливаются численные значения показателей качества воды, с которыми производится сравнение измеренных показателей.
Нормативно-техническая литература, составляющая водно-санитарное законодательство, предъявляет конкретные требования к качеству воды - в зависимости от ее назначения. К таким документам относятся ГОСТ 2874-82 «Вода питьевая», СанПиН 2.1.4.559-96 «Питьевая вода», «Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения», СанПиН 2.1.4.1116-02 «Питьевая вода. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества», СанПиН 2.1.4.1175-02 «Гигиенические требования к качеству воды нецентрализованного водоснабжения. Санитарная охрана источников».
Согласно требованиям СанПин питьевая вода должна быть безвредной по своему химическому составу, безопасной в радиационном и эпидемиологическом отношении, а также обладать приятным вкусом и запахом. Поэтому для сохранения собственного здоровья так важно знать, что за воду вы пьете. Для этого ее надо сдать на анализ – проверить, насколько вода соответствует требованиям санитарных норм и правил.
Рассмотрим подробно параметры, по которым оценивается качество воды.
Физические показатели качества воды
Температура воды поверхностных источников определяется температурой воздуха, его влажностью, скоростью и характером движения воды (а также рядом других факторов). В зависимости от времени года она может претерпевать значительные изменения (от 0,1 до 30º С). Для подземных источников температура воды отличается большей стабильностью (8-12 º С).
Оптимальная температура воды для питьевых целей составляет 7-11 ºС.
Стоит отметить, что этот параметр воды имеет большое значение для некоторых производств (например, для систем охлаждения и конденсации пара).
Мутность – показатель содержания в воде различных взвешенных веществ (минерального происхождения – частиц глины, песка, ила; неорганического происхождения – карбонатов различных металлов, гидроокиси железа; органического происхождения - планктона, водорослей и др.). Попадание взвешенных веществ в воду происходит вследствие размыва берегов и дна реки, поступления их с талыми, дождевыми и сточными водами.
Подземные источники имеют, как правило, небольшую мутность воды за счет наличия в ней взвеси гидрооксида железа. Для поверхностных вод мутность чаще обуславливается присутствием зоо- и фитопланктона, илистых или глинистых частиц; ее величина колеблется в течение года.
Мутность воды обычно выражается в миллиграммах на литр (мг/л); ее величина для питьевой воды по нормам СанПиН 2.1.4.559-96 не должна превышать 1,5 мг/л. Для ряда производств пищевой, медицинской, химической, электронной промышленности используется вода такого же или более высокого качества. В то же время во многих производственных процессах допустимо использование воды с повышенным содержанием взвешенных веществ.
Цветность воды - показатель, характеризующий интенсивность окраски воды. Он измеряется в градусах по платиново-кобальтовой шкале, при этом исследуемая проба воды сравнивается по окраске с эталонными растворами. Цветность воды обуславливается присутствием в ней примесей как органической, так и неорганической природы. Сильно влияет на эту характеристику наличие в воде вымываемых из почвы органических веществ (гуминовых и фульвовых кислот, в основном); железа и других металлов; техногенных загрязнений из промышленных сточных вод. Требование СанПиН 2.1.4.559-96 – цветность питьевой воды должна быть не более 20º. Отдельные виды промышленности ужесточают требования к величине цветности воды.
Запах и привкус воды – эта характеристика определяется органолептически (с помощью органов чувств), поэтому она достаточно субъективна.
Запахи и привкус, которыми может обладать вода, появляются за счет присутствия в ней растворенных газов, органических веществ, минеральных солей, химических техногенных загрязнений. Интенсивность запахов и привкусов определяются по пятибалльной шкале или по «порогу разбавления» испытуемой пробы воды дистиллированной водой. При этом устанавливается кратность разбавления, необходимая для исчезновения запаха или привкуса. Определение запаха и вкуса происходит с помощью непосредственного дегустирования при комнатной температуре, а также при температуре 60º С, вызывающей их усиление. Питьевая вода при 60º С не должна иметь привкус и запах более 2-х баллов (требования ГОСТ 2874-82).
В соответствии с 5-ти бальной шкалой: при 0 баллов - запах и привкус не обнаруживается;
при 1 балле вода имеет очень слабые запах или привкус, обнаруживаемые только опытным исследователем;
при 2-х баллах имеются слабые запах или привкус, очевидные и для неспециалиста;
при 3-х баллах легко обнаруживаются заметные запах или привкус (что и является причиной жалоб на качество воды);
при 4-х баллах различаются отчётливые запах или привкус, могущие заставить воздержаться от употребления воды;
при 5-ти баллах вода имеет такие сильные запах или привкус, что становится совершенно непригодной для питья.
Вкус воды обусловлен наличием в ней растворенных веществ, придающий ей определенный привкус, который может быть солоноватым, горьковатым, сладковатым и кисловатым. Природные воды имеют, как правило, только солоноватый и горьковатый привкус. Причем солоноватый привкус появляется у воды, содержащей хлорид натрия, а горьковатый привкус дает избыток сульфата магния. Вода с большим количеством растворённой углекислоты (т.н. минеральные воды) имеет кислый вкус. Вода с чернильным или железистым привкусом насыщена солями железа и марганца; вяжущий привкус ей придает сульфат кальция, перманганат калия; щелочной привкус вызывается содержанием в воде соды, поташи, щелочи. Привкус может иметь естественное происхождение (присутствие марганца, железа, метана, сероводорода и т.д.) и искусственное происхождение (при сбросе промышленных стоков). Требования СанПиН 2.1.4.559-9 к питьевой воде - привкус не более 2 баллов.
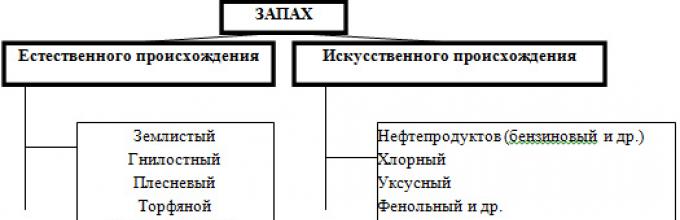
Запахи воде придают различные живущие и отмершие организмы, растительные остатки, специфические веществами, выделяемые некоторыми водорослями и микроорганизмами, а также присутствие в воде растворенных газов, таких как хлор, аммиак, сероводород, меркаптаны или органических и хлорорганических загрязнений. Запахи бывают природного (естественного) и искусственного происхождения. К первым относятся такие запахи, как древесный, ароматический, землистый, болотный, плесневый, гнилостный, травянистый, рыбный, неопределённый и сероводородный и др. Запахи искусственного происхождения получают свое название по определяющим их веществам: камфорный, фенольный, хлорный, смолистый, аптечный, хлор-фенольный, запах нефтепродуктов и т. д.
Требования СанПиН 2.1.4.559-9 к питьевой воде - запах не более 2 баллов.
Химические показатели качества воды
Общая минерализация (сухой остаток). Общая минерализация - количественный показатель растворенных в 1 л воды веществ (неорганических солей, органических веществ - кроме газов). Этот показатель также называют общим солесодержанием. Его характеристикой является сухой остаток, получаемый в результате выпаривания профильтрованной воды и высушивании задержанного остатка до постоянной массы. Российскими нормативами допускается минерализация воды, используемой для хозяйственно-питьевых целей, не более 1000 - 1500 мг/л. Сухой остаток для питьевой воды не должен превышать 1000 мг/л.
Активная реакция воды (степень её кислотности или щёлочности) определяется соотношением существующих в ней кислых (водородных) и щелочных (гидроксильных) ионов. При ее характеристике пользуются рН – водородным и гидроксильным показателями, определяющими, соответственно, кислотность и щелочность воды. Величина водородного показателя pH равна отрицательному десятичному логарифму концентрации водородных ионов в воде. При равном количестве кислотных и щелочных ионов, реакция воды нейтральная, а значение pH=7. При рН<7,0 вода имеет кислую реакцию; при рН>7,0 – щелочную. Нормы СанПиН 2.1.4.559-96 требуют, чтобы значение рН питьевой воды находилось в пределах 6,0...9,0. Большинство природных источников имеют значение рН в указанных пределах. Однако может вызвать существенное изменение значения рН. Правильная оценка качества воды и точный выбор способа ее очистки предполагает знание рН воды источников в различные периоды года. Вода с низкими значениями рН оказывает сильное коррозирующее воздействие на сталь и бетон.
Часто качество воды описывается через такой термин, как жесткость. Требования к качеству воды по показателю жесткости в России и Европе очень сильно различаются: 7 мг-экв/л (по российским нормам) и 1 мг-экв/л (директива Совета ЕС). Повышенная жесткость представляет собой самую распространенную проблему качества воды.
Жесткость воды – показатель, характеризующий содержание в воде солей жесткости (главным образом, кальция и магния). Он измеряется в миллиграмм-эквивалентах на литр (мг-экв/л). Различают такие понятия как карбонатная (временная) жесткость, некарбонатная (постоянная) жесткость и общая жесткость воды.
Карбонатная жесткость (устранимая) – показатель наличия в воде гидрокарбоната кальция и магния. При кипячении воды происходит его разложение с образованием малорастворимых солей и углекислого газа.
Некарбонатная или постоянная жесткость определяется содержанием в воде некарбонатных солей кальция и магния - сульфатов, хлоридов, нитратов. При кипячении воды они не выпадают в осадок и остаются в растворе.
Общая жесткость – суммарная величина содержания в воде солей кальция и магния; представляет собой сумму карбонатной и некарбонатной жесткости.
В зависимости от величины жесткости вода характеризуется как:
Величина жесткости воды значительно варьирует в зависимости от того, какие типы пород и почв слагают бассейн водосбора; от погодных условий и сезона года. Так, в поверхностных источниках вода, как правило, относительно мягкая (3...6 мг-экв/л) и зависит от расположения - чем южнее, тем выше жесткость воды. Жесткость подземных вод меняется в зависимости от глубины и расположения горизонта водоносного слоя и величины годового объема осадков. В слое известняка жесткость воды обычно составляет 6 мг-экв/л и более.
Жесткость питьевой воды (по нормам СанПиН 2.1.4.559-96) не должна превышать 7,0 мг-экв/л.
Жесткая вода из-за избытка кальция обладает неприятным вкусом. Опасность постоянного употребления воды с повышенной жесткостью - в снижении моторики желудка, накоплении солей в организме, риске заболевания суставов (артриты, полиартриты) и образования камней в почках и желчных путях. Правда, очень мягкая вода также не полезна. Мягкая вода, обладающая большой активностью, способна вымывать кальций из костей, что ведет к их ломкости; развитию рахита у детей. Еще одним неприятным свойством мягкой воды является ее способность при прохождении через пищеварительный тракт вымывать также полезные органические вещества, в том числе и полезные бактерии. Оптимальный вариант - вода жесткостью 1,5-2 мг-экв/л.
Уже общеизвестно, что нежелательно использовать жесткую воду для хозяйственных целей. Такие последствия, как налет на сантехнических приборах и арматуре, образование накипи в водонагревательных системах и приборах – очевидны! Образование осадка кальциевых и магниевых солей жирных кислот при хозяйственно-бытовом использовании жесткой воды приводит к значительному росту расхода моющих средств и замедлению процесса приготовления пищи, что проблемно для пищевой промышленности. В ряде случаев использование жесткой воды в производственных целях (в текстильной бумажной промышленности, на предприятиях искусственного волокна, для питания паровых котлов и др.) запрещается из-за нежелательных последствий.
Использование жесткой воды уменьшает срок службы водонагревательной техники (бойлеров, батарей центрального водоснабжения и др.). Отложение солей жесткости (гидрокарбонатов Ca и Mg) на внутренних стенках труб, накипные отложения в водонагревательных и охлаждающих системах уменьшают проходное сечение, снижают теплоотдачу. В системах оборотного водоснабжения не допускается использовать воду с высокой карбонатной жесткостью.
Щёлочность воды . Общая щёлочность воды – это сумма содержащихся в ней гидратов и анионов слабых кислот (кремниевой, угольной, фосфорной и т.д.). При характеристике подземных вод в подавляющем большинстве случаев используют гидрокарбонатную щёлочность, то есть содержание в воде гидрокарбонатов. Формы щелочности: бикарбонатная, карбонатная и гидратная. Определение щелочности (мг-экв/л) производится в целях контроля качества питьевой воды; для определения пригодности воды для полива; для расчета содержания карбонатов, для последующей очистки сточных вод.
ПДК по щелочности 0,5 - 6,5 ммоль / дм3.
Хлориды – их присутствие наблюдается практически во всех водах. Их наличие в воде объясняется вымыванием из горных пород хлорида натрия (поваренной соли), очень распространённой на Земле соли. Значительное количество хлоридов натрия содержится в морской воде, а также в воде некоторых озер и подземных источников.
В зависимости от стандарта ПДК хлоридов в питьевой воде равняется 300...350 мг/л.
Повышенное содержание хлоридов с одновременным присутствием в воде нитритов, нитратов и аммиака встречается в случае загрязнённости источника бытовыми сточными водами.
Сульфаты наличествуют в подземных водах, как результат растворения гипса, имеющегося в пластах. При избыточном содержании сульфатов в воде у человека возникает расстройство желудочно-кишечного тракта (эти соли обладают слабящим эффектом).
ПДК сульфатов в питьевой воде составляет 500 мг/л.
Содержание кремниевых кислот . Кремниевые кислоты различной формы (от коллоидной до ионодисперсной) встречаются в воде подземных и поверхностных источников. Кремний имеет малую растворимость, и его содержание в воде, как правило, невелико. Попадание кремния в воду происходит также с промышленными стоками предприятий, осуществляющих производство керамики, цемента, стекольных изделий, силикатных красок.
ПДК кремния составляет 10 мг/л. Использование воды, содержащей кремниевые кислоты, запрещено для питания котлов высокого давления – из-за образования силикатной накипи на стенках.
Фосфатов в воде обычно немного, поэтому их повышенное содержание сигналит о возможном загрязнении промышленными стоками или стоками с сельскохозяйственных полей. При повышенном содержании фосфатов усиленно развиваются сине-зелёные водоросли, выделяющие токсины в воду при отмирании.
ПДК соединений фосфора в питьевой воде - 3,5 мг/л.
Фториды и йодиды . Фториды и йодиды имеют некоторую схожесть. Недостаток или избыток этих элементов в организме человека приводит к серьёзным заболеваниям. Например, недостаток (избыток) йода провоцирует заболевания щитовидной железы ("зоб"), развивающиеся, когда суточный рацион йода менее 0,003 мг или более 0,01 мг. Фториды содержатся в минералах - солях фтора. Содержание фтора в питьевой воде для сохранения здоровья человека должно находиться в пределах 0,7 - 1,5 мг/л (зависит от климата).
Поверхностные источники имеют, преимущественно, низкое содержание фтора (0,3-0,4 мг/л). Содержание фтора в поверхностных водах повышается следствие сброса промышленных фторсодержащих сточных вод или при контакте вод с почвами, насыщенными соединениями фтора. Так, артезианские и минеральные воды, контактирующие со фторсодержащими водовмещающими породами, имеют максимальную концентрацию фтора 5-27 мг/л и более. Важной характеристикой для здоровья человека является количество фтора в его суточном рационе. Обычно содержание фтора в суточном рационе составляет от 0,54 до 1,6 мг фтора (усреднено - 0,81 мг). Стоит отметить, что в организм человека с пищевыми продуктами поступает в 4-6 раз меньше фтора, чем с питьевой водой, имеющей оптимальное его содержание (1 мг/л).
При повышенном содержании фтора в воде (более 1,5 мг/л) появляется опасность развития у населения эндемического флюороза (т.н. "пятнистой эмали зубов"), рахита и малокровия. Эти заболевания сопровождаются характерным поражением зубов, нарушением процессов окостенения скелета, истощением организма. Поэтому в питьевой воде содержание фтора лимитируется. Фактом является и то, некоторое содержание фтора в воде необходимо для снижения уровня заболеваний, определяемых последствиями одонтогенной инфекции (сердечно-сосудистая патология, ревматизм, заболевания почек и др.). При употреблении воды с содержанием фтора менее 0,5 мг/л развивается кариес зубов, поэтому в таких случаях врачи рекомендуют пользоваться фторсодержащей зубной пастой. Фтор лучше усваивается организмом из воды. Исходя из вышеизложенного, оптимальной дозой фтора в питьевой воде является величина 0,7...1,2 мг/л.
ПДК фтора - 1,5 мг/л.
Окисляемость перманганатная – параметр, обусловленный присутствием в воде органических веществ; отчасти он может сигнализировать о загрязнённости источника сточными водами. В зависимости от того, какой окислитель используется при , различается окисляемость перманганатная и окисляемость бихроматная (или ХПК - химическая потребность в кислороде). Перманганатная окисляемость является характеристикой содержания легкоокисляемой органики, бихроматная - общего содержания органических веществ в воде. Количественное значение этих показателей и их соотношение позволяет косвенно судить о природе присутствующих в воде органических веществ, а также о способах и эффективности очистки воды.
По требованиям СанПиН: величина перманганатной окисляемости воды не должна превышать 5,0 мг О 2 /л. Вода с перманганатной окисляемостью менее 5 мг О 2 /л считается чистой, более 5 мг О 2 /л - грязной.
В истинно растворённом виде (двухвалентное железо Fe2+). Содержится обычно в артезианских скважинах (отсутствует растворенный кислород). Вода прозрачная бесцветная. Если содержание такого железа в ней высокое, то при отстаивании или нагреве вода становится желтовато-бурой;
В нерастворённом виде (трёхвалентное железо Fe3+) содержится в поверхностных источниках водоснабжения. Вода прозрачная - с коричневато-бурым осадком или ярко выраженными хлопьями;
В коллоидном состоянии или виде тонкодисперсной взвеси. Вода мутная, окрашенная, желтовато-коричневая опалесцирующая. Коллоидные частицы, находясь во взвешенном состоянии, не выпадают в осадок даже при длительном отстаивании;
В виде так называемой железоорганики - солей железа и гуминовых и фульвокислот. Вода прозрачная, желтовато-коричневая;
Железобактерии, образующие коричневую слизь на водопроводных трубах.
Содержание железа в поверхностных водах средней полосы России - от 0,1 до 1,0 мг/дм 3 железа; в подземных водах эта величина достигает 15-20 мг/дм 3 и более. Важно проведение анализа на содержание железа в сточных водах. Особенно «засоряют» водоемы железом сточные воды предприятий металлообрабатывающей, металлургической, лакокрасочной промышленности, текстильной, а также сельскохозяйственные стоки. На концентрацию железа в воде влияют величина рН и содержание кислорода в воде. В колодезной и скважинной воде железо может находиться в окисленной и в восстановленной форме, однако при отстаивании воды оно всегда окисляется и может выпадать в осадок.
СанПиН 2.1.4.559-96 допускают общее содержание железа не более 0,3 мг/л.
Считается, что железо не токсично для человеческого организма, но при длительном употреблении воды с избыточным содержанием железа может произойти отложение его соединений в тканях и органах человека. Вода, загрязненная железом, имеет неприятный вкус, приносит неудобства в быту. На ряде промышленных предприятий, использующих воду для промывки продукта при его изготовлении, например, в текстильной промышленности, даже небольшое содержание железа в воде значительно снижает качество продукции.
Марганец встречается в воде в аналогичных модификациях. Марганец – это металл, активизирующий ряд ферментов, участвующий в процессах дыхания, фотосинтеза, влияющий на кроветворение и минеральный обмен. При недостатке марганца в почве у растений наблюдаются хлорозы, некрозы, пятнистости. Поэтому почвы, бедные марганцем (карбонатные и переизвесткованные), обогащаются марганцевыми удобрениями. Для животных недостаток этого элемента в кормах приводит к замедлению роста и развития, нарушению минерального обмена, развитию анемии. Человек страдает как от недостатка, так и от переизбытка марганца.
Нормы СанПиН 2.1.4.559-96 допускают содержание марганца в питьевой воде не более 0,1 мг/л.
Переизбыток марганца в воде может вызвать заболевание костной системы человека. Такая вода имеет неприятный металлический привкус. Ее длительное употребление приводит к отложению марганца в печени. Присутствие в воде марганца и железа способствует образованию железистых и марганцевых бактерий, продукты жизнедеятельности которых в трубах и теплообменных аппаратах вызывают уменьшение их сечения, иногда и полную их закупорку. Вода, используемая в пищевой, текстильной промышленности, при производстве пластмасс и др., должна содержать строго ограниченное количество железа и марганца.
Также переизбыток марганца приводит к окрашиванию белья при стирке, образованию черных пятен на сантехнике и посуде.
Натрий и калий - попадание этих элементов в подземные воды происходит в процессе растворения коренных пород. Основной источник натрия в природных водах - залежи поваренной соли NaCl, возникшие в местах нахождения древних морей. Калий в водах встречается реже – из-за его поглощения почвой и растениями.
Натрий играет важную биологическую роль для большинства форм жизни на Земле, в том числе и для человека. Человеческий организм содержит примерно 100 г натрия. Ионами натрия выполняется задача активизации ферментативного обмена в организме человека.
По нормам СанПиН 2.1.4.559-96 ПДК натрия - 200 мг/л. Избыток натрия в воде и пище провоцирует у человека развитие гипертензии и гипертонии.
Калий способствует усилению выведения воды из организма. Это его свойство используется для облегчения функционирования сердечно-сосудистой системы при ее недостаточности, исчезновения или существенного уменьшения отеков. Недостаток калия в организме приводит к нарушениям функций нервно-мышечной (параличи и парезы) и сердечно-сосудистой систем и способствует депрессии, дискоординации движений, мышечной гипотонии, судорогам, артериальной гипотонии, изменениям на ЭКГ, нефритам, энтеритам и др. ПДК калия - 20 мг/л.
Медь, цинк, кадмий, мышьяк, свинец, никель, хром и ртуть – попадание этих элементов в источники водоснабжения происходит преимущественно с промышленными стоками. Рост содержания меди и цинка может также являться следствием коррозии оцинкованных и медных водопроводных труб в случае повышенного содержания агрессивной углекислоты.
По нормам СанПиН ПДК этих элементов составляет: для меди - 1,0 мг/л; цинка - 5,0 мг/л; свинца - 0,03 мг/л; кадмия - 0,001 мг/л; никеля - 0,1 мг/л (в странах ЕС - 0,05 мг/л), мышьяка - 0,05 мг/л; хрома Cr3+ - 0,5 мг/л, ртути - 0,0005 мг/л; хрома Cr4+ - 0,05 мг/л.
Все эти соединения - тяжёлые металлы, обладающие кумулятивным действием, то есть они имеют свойство накапливаться в организме.
Кадмий очень токсичен. Накопление кадмия в организме может приводить к таким заболеваниям, как анемия, поражение печени, почек и легких, кардиопатия, эмфизема легких, остеопороз, деформация скелета, гипертония. Избыток этого элемента провоцирует и усиливает дефицит Se и Zn. Симптомами кадмиевого отравления являются поражение центральной нервной системы, белок в моче, острые костные боли, дисфункция половых органов. Все химические формы кадмия представляют опасность.
Алюминий – легкий металл серебристо-белого цвета. В первую очередь его попадание в воду происходит в процессе водоподготовки - в составе коагулянтов и при сбросе сточных вод переработки бокситов.
В воде ПДК солей алюминия составляет 0,5 мг/л.
При избытке алюминия в воде происходит повреждение центральной нервной системы человека.
Бор и селен – присутствие этих элементов в некоторых природных водах обнаруживается в весьма незначительной концентрации. Необходимо помнить, что их повышенная концентрация приводит к серьёзному отравлению.
Кислород пребывает в воде в растворенном виде. В подземных водах растворенный кислород отсутствует. Его содержание в поверхностных водах зависит от температуры воды, а также определяется интенсивностью процессов обогащения или обеднения воды кислородом, достигая до 14 мг/л.
Даже значительное содержание кислорода и двуокиси углерода не ухудшает качество питьевой воды, способствуя, в то же время, росту коррозии металла. Повышение температуры воды, а также ее подвижность усиливают процесс коррозии. Повышенное содержание в воде агрессивной двуокиси углерода делает подверженными коррозии также стенки бетонных труб и резервуаров. Присутствие кислорода не допустимо в питательной воде паровых котлов среднего и высокого давления. Сероводород имеет свойство придавать воде характерный неприятный запах и вызывать коррозию металлических стенок котлов, баков и труб. Из-за этого не допускается присутствие сероводорода в воде хозяйственно-питьевого назначения и в воде для большинства производственных нужд.
Соединения азота. К азотосодержащим веществам относятся нитриты NO 2 - , нитраты NO 3 - и аммонийные соли NH 4 + , почти всегда присутствующие во всех водах, в том числе подземных. Их наличие свидетельствует о том, что в воде имеются органические вещества животного происхождения. Эти вещества образуются в результате распада органических примесей, преимущественно - мочевины и белков, которые попадают в воду с бытовыми сточными водами. Рассматриваемая группа ионов находится в тесной взаимосвязи.
Первый продукт распада - аммиак (аммонийный азот) , образуется в результате распада белков и является показателем свежего фекального загрязнения. Окисление ионов аммония до нитратов и нитритов в природной воде осуществляется бактериями Nitrobacter и Nitrosomonas. Нитриты - лучший показатель свежего фекального загрязнения воды, особенно если одновременно повышенно содержание аммиака и нитритов. Нитраты -показатель более давнего органического фекального загрязнения воды. Содержание нитратов вместе с аммиаком и нитритами недопустимо.
Таким образом, наличие, количество и соотношение в воде азотсодержащих соединений позволяет судить о том, как сильно и как давно вода заражена продуктами жизнедеятельности человека. При отсутствии в воде аммиака и, в то же время, наличии нитритов и особенно нитратов можно сделать вывод, что водоем подвергся загрязнению давно, и за это время произошло самоочищение воды. Если в водоеме присутствует аммиак и нет нитратов, значит, загрязнение воды органическими веществами случилось недавно. В питьевой воде не допускается содержание аммиака и нитритов.
ПДК в воде: аммоний - 2,0 мг/л; нитриты - 3,0 мг/л; нитраты - 45,0 мг/л.
Если концентрация иона аммония в воде превышает фоновые значения, значит, загрязнение произошло недавно, а источник загрязнения находится близко. Это могут быть животноводческие фермы, коммунальные очистные сооружения, скопления азотных удобрений, навоза, поселения, отстойники промышленных отходов и др.
При употреблении воды с повышенным содержанием нитратов и нитритов у человека нарушается окислительная функция крови.
Хлор вводится в питьевую воду при её . Обеззараживающее действие хлор проявляет, окисляя или хлорируя (замещая) молекулы веществ, входящие в состав цитоплазмы клеток бактерий, в результате чего бактерии гибнут. Чрезвычайно чувствительными к хлору являются возбудители дизентерии, брюшного тифа, холеры и паратифов. Сравнительно малые дозы хлора дезинфицируют даже сильно заражённую бактериями воду. Однако не происходит полной стерилизации воды из-за сохраняющих жизнеспособность отдельных хлоррезистентных особей.
Свободный хлор - вредное для здоровья человека вещество, поэтому в питьевой воде централизованного водоснабжения гигиеническими нормами СанПиН строго регламентируется содержание остаточного свободного хлора. СанПиН устанавливает верхнюю и минимально-допустимую границы содержания свободного остаточного хлора. Проблема в том, что, хотя воду и обеззараживают на станции водоочистки, на пути к потребителю она подвергается риску вторичного заражения. Например, в стальной подземной магистрали могут быть свищи, через которые в магистральную воду попадают почвенные загрязнения.
Поэтому нормы СанПиН 2.1.4.559-96 предусматривают содержание остаточного хлора в водопроводной воде не менее 0,3 мг/л и не более 0,5 мг/л.
Хлор токсичен и является сильным аллергиком, поэтому хлорированная вода оказывает неблагоприятное воздействие на кожу и слизистые оболочки. Это и покраснения различных участков кожи, и проявления аллергического конъюктевита (отек век, жжение, слезотечение, болевые ощущения в области глаз). Хлор также вредно воздействует на дыхательную систему: в результате пребывания в бассейне с хлорированной водой в течение нескольких минут у 60% пловцов наблюдается проявление бронхоспазма.
Около 10% хлора, применяющегося при хлорировании воды, образуют хлорсодержащие соединения, такие как хлороформ, дихлорэтан, четырёххлористый углерод, тетрахлоэтилен, трихлорэтан. 70 - 90 % образующихся при водоподготовке хлорсодержащих веществ составляет хлороформ. Хлороформ способствует профессиональным хроническим отравлениям с преимущественным поражением печени и центральной нервной системы.
Также при хлорировании существует вероятность образования диоксинов, являющихся чрезвычайно токсичными соединениями. Высокая степень токсичности хлорированной воды многократно увеличивает риск развития онкологии. Так, американские эксперты считают хлорсодержащие вещества в питьевой воде косвенно или непосредственно виновными в 20 онкозаболеваниях на 1 млн. жителей.
Сероводород встречается в подземных водах и имеет преимущественно неорганическое происхождение.
В природе происходит постоянное образование этого газа при разложении белковых веществ. Он имеет характерный неприятный запах; провоцирует коррозию металлических стенок баков, котлов и труб; является общеклеточным и каталитическим ядом. При соединении с железом образует черный осадок сернистого железа FeS. Все вышесказанное является основанием для полного удаления сероводорода из воды хозяйственно-питьевого назначения (см. ГОСТ 2874-82 "Вода питьевая").
Стоит отметить, что СанПиН 2.1.4.559-96 допускает присутствие сероводорода в воде до 0,003 мг/л. Вопрос – не опечатка ли это в нормативном документе?!
Микробиологические показатели. Общее микробное число (ОМЧ) определяется количеством бактерий, содержащихся в 1 мл воды. Согласно требованиям ГОСТ, в питьевой воде не должно содержаться более 100 бактерий в 1 мл.
Количество бактерий группы кишечной палочки представляет особую важность для санитарной оценки воды. Наличие в воде кишечной палочки - свидетельство загрязнении ее фекальными стоками и, как следствие, риска попадания в нее болезнетворных бактерий. Определение наличия патогенных бактерий при биологическом анализе воды затруднено, и бактериологические исследования сводятся к определению общего числа бактерий в 1 мл воды, растущих при 37ºС, и кишечной палочки - бактерии коли. Наличие последней сигнализирует о загрязнении воды выделениями людей, животных и т.п. Минимальный объем испытуемой воды, мл, приходящейся на одну кишечную палочку, называется колититром, а количество кишечных палочек в 1 л воды - коли-индексом. По ГОСТ 2874-82 допускается коли-индекс до 3, колититр - не менее 300, а общее число бактерий в 1 мл - до 100.
По нормам СанПиН 2.1.4.559-96 допустимо общее микробное число 50 КОЕ/мл, общие колиформные бактерии (ОКБ) КОЕ/100мл и термотолетарные колиформные бактерии (ТКБ) КОЕ/100мл - не допускаются.
Патогенные бактерии и вирусы, находящиеся в воде, могут вызвать заболевания дизентерией, брюшным тифом, парафитом, амебиазом, холерой, диареей, бруцеллезом, инфекционным гепатитом, туберкулезом, острым гастроэнтеритом, сибирской язвой, полиомиелитом, туляремией и др.
КомпанияWaterman предлагает Вам профессиональное решение задачи очистки воды от соединений, содержание которых в воде выше нормативного. Наши специалисты проконсультируют по возникшим вопросам и помогут в выборе и внедренииоптимальной схемы водоочистки, исходя из конкретных исходных данных.
Относительное содержание кислорода в воде, выраженное в процентах его нормального содержания, называется степенью насыщения кислородом. Эта величина зависит от температуры воды, атмосферного
давления и солености. Вычисляется по формуле:
Где
M - степень насыщения воды кислородом, %;
а - концентрация кислорода, мг/дм 3 ;
Р - атмосферное давление в данной местности, Па;
N - нормальная концентрация кислорода при данной температуре, минерализации (солености) и общем давлении 101308 Па.
Щелочность (рН)
Под щелочностью природных или очищенных вод понимают способность некоторых их компонентов связывать эквивалентное количество сильных кислот. Щелочность обусловлена наличием в воде анионов слабых кислот (карбонатов, гидрокарбонатов, силикатов, боратов, сульфитов, гидросульфитов, сульфидов, гидросульфидов, анионов гуминовых кислот, фосфатов). Их сумма называетсяобщей щелочностью . Ввиду незначительной концентрации трех последних ионов общая щелочность воды обычно определяется только анионами угольной кислоты (карбонатная щелочность). Анионы, гидролизуясь, образуют гидроксид-ионы:
CO 3 2- + H 2 O Û HCO 3 - + OH - ;
HCO 3 - + H 2 O Û H 2 CO 3 + OH - .
Щелочность определяется количеством сильной кислоты, необходимой для нейтрализации 1 дм 3 воды. Щелочность большинства природных вод определяется только гидрокарбонатами кальция и магния,pH этих вод не превышает 8,3.
Определение щелочности полезно при дозировании химических веществ, необходимых на обработку вод для водоснабжения, а также при реагентной очистке некоторых сточных вод. Определение щелочности при избыточных концентрациях щелочноземельных металлов важно для установлении пригодности воды для ирригации. Вместе со значениями рН щелочность воды служит для расчета содержания карбонатов и баланса угольной кислоты в воде.
Водородный показатель (рН)
CO 2 + H 2 0 Û H + + HCO 3 - Û 2 H + + CO 3 2- .
Для удобства выражения содержания водородных ионов была введена величина, представляющая собой логарифм их концентрации, взятый с обратным знаком:
pH = -lg.
Для поверхностных вод, содержащих небольшие количества диоксида углерода, характерна щелочная реакция. ИзмененияpH тесно связаны с процессами фотосинтеза (при потребленииCO 2 воднойрастительностью высвобождаются ионыОН -). Источником ионов водорода являются также гумусовые кислоты, присутствующие в почвах. Гидролиз солей тяжелых металлов играет роль в тех случаях, когда в воду попадают значительные количества сульфатов железа, алюминия, меди и других металлов:
Fe 2+ + 2H 2 O Þ Fe(OH) 2 + 2H + .
ЗначениеpH в речных водах обычно варьирует в пределах 6,5-8,5, в атмосферных осадках 4,6-6,1, в болотах 5,5-6,0, в морских водах 7,9-8,3. Концентрация ионов водорода подвержена сезонным колебаниям. Зимой величинаpH для большинства речных вод составляет 6,8-7,4, летом 7,4-8,2. ВеличинаpH природных вод определяется в некоторой степени геологией водосборного бассейна.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования, воды водных объектов в зонах рекреации, а также воды водоемов рыбохозяйственного назначения, величина pH не должна выходить за пределы интервала значений 6,5-8,5.
ВеличинаpH воды - один из важнейших показателей качества вод. Величина концентрации ионов водорода имеет большое значение для химических и биологических процессов, происходящих в природных водах. От величиныpH зависит развитие и жизнедеятельность водных растений, устойчивость различных форм миграции элементов, агрессивное действие воды на металлы и бетон. ВеличинаpH воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ.
В водоеме можно выделить несколько этапов процесса его закисления. На первом этаперН практически не меняется (ионы бикарбоната успевают полностью нейтрализовать ионыН + ). Так продолжается до тех пор, пока общая щелочность в водоеме не упадет примерно в 10 раз до величины менее 0,1 моль/дм 3 .
На втором этапе закисления водоемарН воды обычно не поднимается выше 5,5 в течение всего года. О таких водоемах говорят как об умеренно кислых. На этом этапе закисления происходят значительные изменения в видовом составе живых организмов.
На третьем этапе закисления водоемарН стабилизируется на значенияхрН <5 (обычнорН 4,5), даже если атмосферные осадки имеют более высокие значениярН . Это связано с присутствием гумусовых веществ и соединений алюминия в водоеме и почвенном слое.
Природные воды в зависимости от рН рационально делить на семь групп (табл. 3.3).
Показатели индексов загрязненности (по различным параметрам: эвтрофикация, токсикация, минерализация и т.д.) невысоки; степень изменения качества вод в этой части озера.также достаточно невысока .[ ...]
Показатели, степени загрязнения производственных сточных вод определяются особенностями производственного процесса. Наряду с указанными наибольшее значение имеют показатели: pH, кислотность, щелочность, содержание тяжелых металлов и других токсичных примесей, цветность, взвешенные вещества и плавающие примеси, запах воды и др.[ ...]
Показатель суммарного индекса сапробности равен 1,530 для 200 подсчитанных створок и 1,528 для 1000. Это один из самых высоких показателей для данного озера. Показатели индексов загрязненности (по иным параметрам: токсификация, минерализация, термофикация), напротив, невысоки. Степень изменения качества вод в этой части озера также достаточно невысока .[ ...]
Степень химического загрязнения почв определяется отклонением величины концентраций загрязняющих веществ от нормативного показателя (ПДК)1. Результатом такой оценки может явиться схема районирования территории города (М 1:25 ООО) по степени загрязненности почвы с выделением участков наиболее опасных ареалов загрязнения (сады, огороды, детские площадки и другие участки, где наблюдается наибольший контакт людей с почвой). Также выделяются зоны влияния загрязненного почвенного покрова на растительность и материально-технические объекты города, в отдельных случаях - на поверхностные и грунтовые воды.[ ...]
Загрязнение водных объектов. В качестве основных показателей оценки состояния поверхностных вод выбраны токсичные, приоритетные загрязняющие вещества, в том числе обладающие свойствами накопления в органах и тканях гидробионтов. Критерии оценки степени химического загрязнения поверхностных вод при стабильном сохранении химического загрязнения в течение трех лет приведены в табл. 6.4. Широко применяется ПХЗ-10 - формализованный суммарный показатель химического загрязнения вод. Он рассчитывается как сумма значений концентраций, нормированных на ПДК рыбохозяйственных водоемов, для 10 загрязняющих веществ с максимальным превышением ПДК.[ ...]
Степень загрязнения поверхностных и подземных вод, донных осадков, почвенных покровов и литосферы базируется также на большом количестве нормативных показателей, основанных на прямых экогеологических (гидрогеохимических, геохимических и геофизических и др.) критериях оценки.[ ...]
Показатели, характеризующие загрязнение водоисточников и питьевой воды веществами, отнесенными к III и IV классам опасности, а также физико-химическими свойствами и органолептическими характеристиками воды, относятся к дополнительным. Эти показатели используют для подтверждения степени интенсивного антропогенного загрязнения водоисточников, определенного но основным показателям.[ ...]
Загрязнения, содержащиеся в сточных водах б ают минерального, органического и бактериального происхождения и могут находиться в растворенном, коллоидном и нерастворензом состояниях. Степень загрязненности сточных вод определяют по ряду показателей санитарно-химического анализа.[ ...]
Показатель концентрации водородных ионов в промышленных сточных водах является одной из важнейших качественных характеристик процесса их очистки. Величина pH обеспечивает наиболее достоверную информацию о степени загрязненности кислотами и щелочами (или о степени очистки от них) воды, сбрасываемой в канализацию или возвращаемой в производство. Скорость и- направление реакций, протекающих при обработке промышленных стоков химическими реагентами, во многих случаях зависят от величины pH. Поддерживая концентрацию водородных ионов в очищаемых стоках на определенном уровне, можно создать оптимальные условия для выделения из воды многих неорганических веществ. Благодаря современной аппаратуре для непрерывного измерения величины pH в растворах и пульпах именно по этому параметру стало весьма удобно вести регулирование различных процессов в химической технологии, энергетике и в процессах очистки промышленных сточных вод.[ ...]
В воде р. Уфы ограниченно присутствуют техногенные загрязнения, что связано с высокой концентрацией предприятий нефтеперерабатывающего, нефтехимического и химического профиля. Наиболее опасный среди них -бенз(ос)пирен (Б(ос)П) - является глобальным загрязнителем, характерным для урбанизированных территорий. В этой связи представляется целесообразным сопоставить изменения природных загрязнений, характеризуемых показателями мутности и окисляемости с содержанием Б(ос)П в воде водоисточника и сравнить степень очистки от Б(ос)П с эффективностью очистки от природных загрязнений. Сравнение проведено по детерминированным компонентам мутности, окисляемости, концентрации Б(а)П в водоисточнике и в питьевой воде.[ ...]
Под «загрязненными» водами понимаются воды, которые в процессе их использования загрязняются различными компонентами и сбрасываются в водоемы без очистки или степень их очистки ниже установленной местными органами по регулированию использования и охране вод системы Минводхоза СССР и органами Минздрава СССР. Шахтные, рудничные и другие аналогичные воды также относятся к загрязненным водам, если их минерализация и другие показатели загрязнения превышают нормативы, установленные для воды, допускаемой к сбросу без очистки.[ ...]
К общим показателям загрязненности сточных вод следует отнести показатели, характеризующие общие свойства воды (органолептические, физико-химические), нерастворенные примеси (содержание взвешенных веществ и их зольность), растворенные вещества (общее содержание неорганических и органических примесей, «органического» углерода, определение перманганатной и би-хроматной окисляемости, биохимического потребления кислорода и др.). Эти показатели позволяют судить об общей загрязненности воды, степени загрязненности неорганическими и органическими веществами, в том числе биологически окисляемыми и т. д.[ ...]
Качество воды -это характеристика состава и свойств воды, определяющая ее пригодность для конкретных видов водопользования. Качество воды оценивается комплексом разнообразных показателей. Большинство показателей применяется для оценки любого происхождения и назначения.Однако в зависимости от степени загрязненности воды и вида водопользования число и набор показателей, достаточных для характеристики ее качества, может существенно изменяться. Основными показателями качества воды являются ионный состав, общее солесодержание, цветность, запах и вкус, жесткость, щелочность, содержание железа, марганца и некоторых других элементов.[ ...]
Суммарный показатель загрязненности вод превышает ПДК в 300 раз. Вполне понятно, что сброс таких шахтных вод сильно загрязняет речной сток и опасен в экологическом отношении для малых рек. Ликвидированная шахта в гораздо большей степени влияет на экологические условия окружающей среды, и на этом основании делается вывод о необходимости организации очистки сточных вод затопленных шахт.[ ...]
Критерием степени пригодности биохимического окисления для обезвреживания органических загрязнений в сточных водах является биохимический показатель. Этот показатель определяется как отношение полной биохимической потребности в кислороде (БПКполн) к химической потребности в кислороде (ХПК).[ ...]
До настоящего времени организмы - индикаторы сапробности не потеряли своего значения при мониторинге (Schroevers, 1988), но такая информация недостаточна для оценки состояния водоемов при токсическом, «тепловом», радиационном загрязнении, закислении. Так например, для оценки качества воды по зообентосу насчитывалось более 60 методов (Bakanov, 1994; Баканов, 2000), каждый из которых дает ценную информацию о водоеме. Комплексные методы трудоемки, требуют участия специалистов разного профиля.[ ...]
Все сточные воды, отводимые в канализацию и затем сбрасываемые в водоемы или в подземные горизонты, по степени загрязнения делятся на три вида: загрязненные, сброс которых в водоприемник может быть допущен только после соответствующей очистки; нормативно-очищенные, которые прошли очистку до требуемых в данных конкретных условиях показателей остаточных загрязнений; нормативно-чистые, которые по условиям приемника могут быть сброшены без очистки. Отнесение сточных вод к тому или другому виду производится органами по регулированию использования и охране вод.[ ...]
Анализ проб воды, забираемых в месте проектируемого спуска сточных вод, должен выявить степень загрязнения воды в водоеме в результате возможно существующих спусков сточных вод выше по течению. Кроме того, он позволяет установить величины тех показателей состава воды (pH, щелочность, растворенный кислород, БПК, специфические вредные вещества промышленных стоков), которые непосредственно используются при расчетах по спуску сточных вод применительно к правилам санитарной охраны водоемов.[ ...]
Необходимая степень очистки сточных вод определяется: расчетами разбавления сточных вод в водоеме; допустимой нагрузкой па водоем для отдельных показателей загрязнения (растворенных органических соединений и взвешенных веществ); допустимым изменением реакции водоема (величиной pH). Пр именяются также расчеты по нейтрализующей способности водоема, содержанию растворенного кислорода в воде водоема, по температуре воды в нем.[ ...]
В результате загрязнения нефтепродуктов изменяются физико-химические показатели качества товарной продукции: плотность, вязкость, содержание воды, механических примесей, температура вспышки, кислотность и т. д. В зависимости от вида и степени загрязненности предлагается их подразделять на загрязненные и отработанные.[ ...]
Обнаружение в воде бактерий группы кишечных палочек следует рассматривать как показатель фекального загрязнения воды, а их количество позволяет судить о степени этого загрязнения.[ ...]
Кроме обычных загрязнений, характеризуемых общесанитарными показателями, производственные сточные воды многих отраслей промышленности содержат специфические примеси, обладающие значительной степенью токсичности, причем одни и те же вещества часто находятся в сточных водах разных производств. Особенно большим разнообразием токсичных примесей отличаются, например, воды от обогащения руд цветных металлов, от травления металлов и от гальванопокрытий, воды предприятий химической и химико-фармацевтической промышленности и др.[ ...]
Прозрачность - показатель степени общей загрязненности воды. Прозрачность городских сточных вод обычно не превышает 3 - 5 см. Сточные воды после биологической очистки имеют прозрачность более 15 см. Прозрачность сточных вод определяется по шрифту.[ ...]
При определении степени уменьшения следует исходить из того, что эффект суммарного действия вредных веществ одной и той же группы по лимитирующему признаку вредности суммируется по простой схеме нумерического сложения. Правильность этого подкрепляется данными физиологии органов чувств (А. И. Бронштейн) и результатами специально поставленных опытов в отношении веществ с органолептическим признаком вредности (М. Н. Рублева, С. Д. Замыслова, Н. В. Грин и др.).[ ...]
После усреднителя вода выходит с концентрацией загрязнений по всем показателям значительно более низкой, чем в исходной сточной воде. Из этого можно заключить, что для исходной сточной воды показаны значения максимальных (а не средних) концентраций, колебания степени загрязненности воды очень велики и метод усреднения, безусловно, целесообразен.[ ...]
Бактериологические показатели качества воды являются частью-исследования свойств вод любого состава, происхождения и бактериальной загрязненности. Бактериологические показатели более чувствительны при определении степени загрязнения водоема бытовыми сточными водами, чем результаты химического исследования. Так, по содержанию бактерий-сапрофитов можно обнаружить загрязнение воды органическими биологическими разлагаемыми соединениями при разбавлении в десятки и сотни тысяч раз. Высокая чувствительность микробиологических методов исследования имеет большое значение в деле охраны водной среды от загрязнения.[ ...]
Индексы сапробности, показатели продукции фитопланктона и его биомассы характеризуют состояние воды по ее биоте. Это направление оценки качества водных систем относится к биоиндикации. Его достоинством является возможность комплексной оценки степени загрязненности вод (степени токсичности) даже в отсутствии информации о структуре загрязнителей.[ ...]
Наиболее характерный показатель экологического состояния морей - степень их загрязнения. Согласно международной терминологии загрязнение моря - это введение человеком прямо или косвенно в морскую среду веществ, наносящих вред животным и растениям, вызывающих опасность для здоровья людей, ухудшающих качество морской среды, уменьшающих ее полезные свойства. Степень загрязнения воды в море характеризуется ПДК загрязняющих веществ (ЗВ). На основании ПДК осуществляется контроль за состоянием и качеством морской среды. Превышение ПДК, особенно многократное, означает неблагополучное и даже кризисное состояние морской среды.[ ...]
Качество поверхностных вод территории Варандейского нефтяного месторождения относительно улучшилось, при этом изменился классификационный разряд степени загрязненности вод с 3-го класса (разряд А) «весьма загрязненные» на 2-й класс «слабо загрязненные». По сравнению с результатами обследования, полученными в 1999 г., в 2001 г. в поверхностных водах территории месторождений заметно снизилась загрязненность НУ, ПАУ, медью, цинком, кобальтом и свинцом. Улучшилось качество вод по показателям БПК, ХПК и содержанию СПАВ. Загрязненность фенолами, железом, марганцем, оловом, никелем, кадмием и ртутью осталась практически на прежнем уровне. В то же время в водах ряда тундровых озер отмечено увеличение уровней содержания фосфатов.[ ...]
Глубокая очистка сточных вод может исключить попадание N и Р в водоемы, поскольку при механической очистке содержание этих элементов снижается на 8-10%, при биологической - на 35-50 % и при глубокой очистке - на 98-99 %. Кроме того, разработан ряд мероприятий, позволяющих бороться с процессом эвтрофикации непосредственно в водоемах, например искусственное увеличение содержания кислорода с помощью аэрационных установок. Такие установки работают в настоящее время в СССР, ПНР, Швеции и других странах. Для снижения роста водорослей в водоемах используют различные гербициды. Однако установлено, что для условий Великобритании стоимость глубокой очистки сточных вод от биогенных веществ будет ниже, чем стоимость гербицидов, затраченных на снижение роста водорослей в водоемах. Существенным для последних является.снижение концентрации нитратов, представляющих опасность для здоровья человека. Всемирной организацией здравоохранения предельно допустимая концентрация нитратов в питьевой воде принята равной 45 мг/л или в пересчете на азот 10 мг/л, такая же величина принята по санитарным нормам для воды водоемов. Количество и характер соединений азота и фосфора влияют на общую продуктивность водоемов, вследствие чего они включены в число главных показателей при оценке степени загрязнения водоисточников.[ ...]
Количество бактерий в сточных водах бывает довольно значительное. Оно может достигнуть многих миллионов в 1 мл. Объем бактериальной массы (содержащей 85% воды) при количестве 100 млн. бактерий в 1 мл составляет 0,04% от объема сточных вод. Наличие большого количества бактерий в сточных водах характеризует степень их загрязненности. Однако этот показатель не является исчерпывающим. Во-первых, могут быть очень загрязненные воды, не имеющие бактерий, но содержащие токсичные вещества, во-вторых, помимо патогенных бактерий, бывают и сапрофитные, т. е. полезные. Поэтому, кроме определения количества бактерий в мл сточных вод, важно знать, какое количество кишечных палочек (бактерий «коли») присутствует в сточных водах. Наличие кишечных палочек в воде еще не говорит о зараженности ее инфекционными началами, например брюшного тифа. Но факт обнаружения кишечной палочки свидетельствует о нахождении в воде выделений человека и животных, что является отрицательным санитарным показателем. Бактериальную загрязненность сточных вод характеризуют величиной коли-титра, т. е. наименьшим объемом воды в мл, в котором содержится одна кишечная палочка. Так, если коли-титр равен 10, то это значит, что в 10 мл найдена 1 кишечная палочка; при коли-титре, равном 0,001, в 1 мл обнаруживается 1000 кишечных палочек. Коли-индекс означает количество кишечных палочек в 1 л жидкости. В сточных водах коли-титр может быть 0,000001 и даже меньше.[ ...]
При проведении опытов по влиянию воды из природных водоемов на Daphnia magna следует учитывать, что получаемые различия в состоянии дафний в разных пробах воды зависят не только от загрязнений которые могут присутствовать в пробах, но и от ряда других условий, как кормность на данном участке, естественный состав ©оды и т. п. С другой стороны, D. magna наиболее хорошо чувствует себя в (ß-мезосапробной зоне, поэтому небольшие и умеренные степени загрязнения воды разлагающимися веществами могут вызывать улучшение основных показателей состояния дафний. В условиях европейской части СССР в большинстве равнинных рек вода носит в норме переходный характер от олигосапробной к ß-мезосапробной. В воде рек и озер Севера условия, как правило, бывают типичными олигосапробными, D. magna при выдерживании в такой воде бледнеют и могут даже погибнуть от голода через 5-10 суток.[ ...]
Дифференцированные ставки платы за загрязнение определяются умножением базовых нормативов платы на коэффициенты, учитывающие экологические факторы по территориям и бассейнам рек. Коэффициенты экологической ситуации и экологической значимости состояния атмосферного воздуха и почвы рассчитаны по данным оценки лаборатории мониторинга природной среды и климата Госкомгид-ростата РФ и Академии наук. В их основу положен показатель степени загрязнения и деградации природной среды на территории экономических районов РФ в результате присущих этим районам выбросов в атмосферу и образующихся и размещаемых на их территории отходов. Коэффициенты экологической ситуации и экологической значимости состояния водных объектов рассчитаны на основании данных о количестве сброшенных загрязненных сточных вод и категории водного объекта.[ ...]
Растворенный кислород. Растворенный в воде кислород участвует в биологическом распаде органических веществ. В загрязненных поверхностных водных источниках количество растворенного кислорода значительно меньше, чем при предельном насыщении, показанном в табл. 2.5. Так как рыбы и большинство других обитающих в воде живых организмов и растений не могут существовать без кислорода, количество растворенного в воде кислорода представляет наиболее важный показатель степени загрязнения водоема. Во время аэробной обработки воды для сохранения оптимальных условий и предотвращения потерь энергии при избыточной аэрации степень аэрации регулируют, руководствуясь результатами определения количества растворенного в воде кислорода. Анализы на содержание растворенного кислорода используют также при определении биохимической потребности сточных вод в кислороде (ВПК). Небольшие пробы сточной воды смешивают с разбавляющей водой и помещают в колбу для проведения анализов на растворенный кислород через различные интервалы времени.[ ...]
Санитарно-гигиеническая оценка качества вод водных объектов основывается на данных физико-химических, бактериологических и гидробиологических анализов проб воды. С целью составления характеристики степени загрязнения вод проводится отбор наиболее важных и специфических показателей качества вод, учитывающих производственный профиль градообразующей базы не только в исследуемом городе, но и в пригородной зоне .[ ...]
Таким образом, по величине УКИЗВ поверхностные воды обследованной территории относятся к 3-му классу классификации степени загрязненности воды - разряд Б, «очень загрязненная».[ ...]
Примечания: 1. Временно, до разработки специальных санитарных показателей и нормативов для хозяйственно-питьевого н лечебного использования морских вод, требования и нормативы настоящих Правил распространяются на состав и свойства морской воды в местах расположения водозаборов опреснительных установок, водолечебниц и ванн. В местах водозаборов плавательных бассейнов с морской водой, количество бактерий группы кишечных палочек и энтерококков не должно превышать 100/л и 50/л соответственно. 2. При систематическом сезонном развитии и скоплении водорослей должны предусматриваться мероприятия по очистке от них района водопользования. 3. При органическом загрязнении, превышающем установленный норматив, оценка степени и характера загрязнения производится с учетом санитарной ситуации и других прямых и косвенных санитарных показателей загрязнения морской воды (включая БПКполное). 4. Для определения в морской воде патогенных микроорганизмов применяются мето’Ды, рекомендованные «Инструктивно-методическими указаниями по обнаружению в воде возбудителей кишечных инфекций» № 1150-74. 5. В местах массового купания дополнительным показателем загрязнения является количество стафилококков в воде. Сигнальное значение для регламентации нагрузки на пляжи имеет повышение их количества более 100 в 1 л. 6. Условия отведения, степень очистки и обеззараживания сточных вод при спуске их в пределах I пояса зоны санитарной охраны должны обеспечивать коли-индекс сточных вод не более 1000 при концентрации свободного хлора не менее 1,5 мг/л. При отведении сточных вод с берега за пределы I пояса зоны санитарной охраны, мнкробное загрязнение морской воды на границе I -II поясов зоны не должны превышать по коли-индексу I млн. 7. Предельно допустимые концентрации (ПДК) вредных веществ, принятые в «Правилах охраны поверхностных вод от загрязнения сточными водами» № 1166-74, временно распространяются на водозаборы хозяйственно-питьевого и оздоровительно-лечебного использования морских вод и районы морского водопользования впредь до разработки специальных нормативов для прибрежных вод морей.[ ...]
Данные гидрохимического анализа указывают на исключительную загрязненность вод этого озера тяжелыми металллами (Ni - 2818, Си - 53 мкг/л и т.д.). Степень минерализации озера средняя. Показатель pH придонных вод близок к нейтральному (7,01). Поверхностные осадки озера носят мезотрофный характер.[ ...]
Известна роль водных грибов в качестве индикаторов разных типов и степеней загрязнения воды в водоемах.[ ...]
Аэробные сапрофиты составляют только часть общего числа микробов в воде, но являются важным санитарным показателем качества воды, так как между степенью загрязнения ее органическими веществами и микробным числом существует прямая зависимость. Кроме того, полагают, что чем выше микробное число, тем больше вероятность присутствия в воде патогенных микроорганизмов. Микробное число водопроводной воды не должно превышать 100. В природных водах этот показатель изменяется в очень широких пределах для разных водоемов и по сезонам года для одного и того же водоема. В чистых водоемах число аэробных сапрофитов может исчисляться десятками или сотнями, а в загрязненных и грязных водоемах составлять десяти тысяч и миллионы.[ ...]
Одним из показателей оценки загрязнения разных сред (продукты, вода, воздух) является количество пестицидов, которое может поступить в организм человека при контакте с этими средами. Почва занимает особое место среди других сред. Опасность содержания в почве того или иного пестицида оценивают с учетом степени перехода в контактирующие с почвой среды - растения, воду и воздух, а также влияния на общесанитарные показатели почвы. Результаты проведенных исследований позволили рекомендовать следующие предельно допустимые уровни содержания исследуемых пестицидов в почве (в мг/кг): севина-1,05, ПХП и ПХК - 0,5, ГХЦГ и у-ГХЦГ - 1.[ ...]
Основная стратегия снижения водопотребления в промышленности - увеличение степени оборачиваемости воды в производственном цикле. Заметим, что в конечном итоге, после многих циклов использования в технологическом процессе, остается чрезвычайно загрязненная вода, и вопрос, что с ней делать, далеко не тривиален и не имеет одйорнда;ноЕонжвэз]шше потребляет не более 10 % всего объема забираемой воды, но это очень дорогая вода, потому что строительство и эксплуатация весьма сложных систем водоснабжения обходится весьма дорого. Несмотря на это, типичная величина потерь воды в городских сетях составляет 50 %. В крупных городах развивающихся стран потери воды составляют: Манила (Филиппины) - 55-65%, Джакарта (Индонезия) - 50%, Мехико (Мексика) - 50%, Каир (Египет) - 47%, Бангкок (Таиланд) - 32%.[ ...]
В городских промышленных районах, где неизбежно возникают проблемы, связанные с загрязнением воды, необходимо проводить мероприятия по рациональному планированию на широкой основе. Агентство по охране окружающей среды обязывает каждый штат разработать региональные планы для контроля над качеством воды. Для получения правительственного разрешения на строительство какого-либо объекта его владельцы должны увязать свои планы с планами всего района (местности). Это подразумевает подготовку информации о влиянии объекта на окружающую среду, чтобы установить, не будет ли предлагаемый объект плохо влиять на здоровье и благосостояние людей, а также на окружающую среду. К тому же штатные стандарты имеют так называемый «антидеградационный» пункт, по которому с целью сохранения высокого качества некоторых природных вод их показатели могут быть установлены более высокими, чем показатели, соответствующие данному классу водных источников. Эта чистота природных водоемов должна сохраняться, если только не будет доказано, что другие виды использования воды и другие стандарты являются оправданными для экономического и социального развития. Поэтому для сохранения высокого качества воды на всех объектах, которые могут быть источниками загрязнений, должна быть обеспечена необходимая степень очистки стоков.[ ...]
На основе жизненного опыта человек с давних пор знал, что наибольшую опасность для питьевой воды представляют загрязнения сточными водами и фекалиями человека и животных [ 1 ]. Недоброкачественность питьевой воды является источником заболеваемости населения кишечными инфекциями и вирусным гепатитом. Основным источником загрязнения водоемов водоснабжения являются сельскохозяйственные предприятия. Во время паводков и сильных дождей навоз с полей, дорог и территорий ферм смывается в овраги и ручьи. В последнее время в водоохранной зоне крупных городов активизировалось дачное строительство, вызывающее неконтролируемое загрязнение источников питьевого водоснабжения. Так, в Москве-реке весной все санитарнобактериологические показатели превышают допустимые и фоновые величины. Интенсивная степень загрязнения воды характеризовалась свежим фекальным загрязнением . Это является следствием поступления в водоисточники бытовых и навозосодержащих поверхностных стоков. Только на территории Московской области весной скапливается более 2,5 млн. тонн навоза. Из-за отсутствия навозохранилищ достаточной емкости, специальных механизированных средств внесения навоза под запашку навоз вывозится зимой на поля, а в результате снеготаяния в больших количествах смывается и попадает в водоисточники . Все эти факторы способствуют повышению эпидемиологической опасности питьевой воды.[ ...]
Практикой установлено, что в системе мероприятий, направленных на предупреждение или уменьшение загрязнения водоемов сточными водами, наиболее желательными и эффективными являются меры по рационализации технологических процессов, сопровождающиеся сокращением сброса вредных веществ и утилизацией ценных веществ сточных вод или использованием сточных вод в оборотной системе водоснабжения. Когда эти мероприятия оказываются недостаточными по степени обезвреживания или недоступными по техническим или экономическим соображениям, возникает необходимость в специальных санитарно-технических мероприятиях для очистки и обезвреживания сточных вод. Поэтому проблема сокращения сброса в водоем сточных вод, как проблема технологическая и санитарно-техническая, оказывается неразрывно связанной с проблемой охраны водоемов от загрязнения в санитарных и народнохозяйственных интересах населения. В связи с этим большое значение приобрели исследования, дающие представление о тех показателях состава и свойств воды водоема, по которым можно было судить о степени загрязнения водоемов.- Известный уровень этих показателей состава воды водоемов, по существу, указывает на предел допустимого загрязнения водоемов, который,не должен превышаться, чтобы не нарушить нормальные условия водопользования и не нанести ущерб санитарно-быто-вым и хозяйственным интересам населения.[ ...]
Доминирующей группой по количеству и разнообразию на всех станциях являются личинки хирономид. Он основан на смене видового состава хирономид и закономерном изменении соотношения численности личинок, принадлежащих к подсемействам Orthocladiinae, Chironominae, Tanypodinae, что происходит из-за роста уровня загрязнения. В результате обработки данных получены следующие значения индекса Балушкиной: пос. Метелево - 1,53, р-н Лесобазы - 2,40, д. Мальково - 1,92. Согласно литературным данным, значение индекса, лежащее в диапазоне 1,08-6,5, характеризует поверхностные воды как умеренно загрязненные. Таким образом, все три участка реки попадают под эту категорию. Однако пос. Метелево имеет самый маленький индекс, что характеризует его как самый чистый участок из представленных. В то же время участок в районе Лесобазы имеет самый высокий показатель хирономидного индекса, что указывает на более сильное антропогенное загрязнение в этом районе. Участок реки в районе д. Мальково лежит ниже по течению. Значение индекса здесь снижается, что, вероятно, происходит вследствие процессов самоочищения. Для более объективной оценки качества воды в данной работе были также использованы биотический индекс Вудивисса и метод Наглшмидта. В основу первого метода положена закономерность упрощения таксономической структуры биоценоза по мере повышения уровня загрязнения вод. На всех станциях значения индекса Вудивисса были равны 5. По классификатору качества вод Росгидромета полученное значение соответствует умеренно загрязненным водам (третий класс качества). Таким образом, в данном случае индекс Вудивисса и индекс Балушкиной указывают на одинаковую степень загрязнения воды. Следует отметить, что индекс Балушкиной по сравнению с индексом Вудивисса позволяет оценить не только класс качества воды, но также показывает градацию уровня загрязнености в числовом выражении. Его отличие заключается в том, что подсчитывается общее количество видов, а не групп организмов, как у Вудивисса. При этом также не требуется точного определения до вида, достаточно определить сколько видов присутствует. Метод Наглшмидта учитывает не только качественный, но и количественный состав организмов.[ ...]
Изучение этой группы животных имеет существенное значение также потому, что тубифициды входят в систему сапробных организмов и при массовом развитии являются прекрасными показателями степени загрязнения воды и донных отложений. Однако известно, что принятая система сапробных организмов, лежащая в основе биологического анализа воды, при помощи которого приходится решать подчас чрезвычайно важные и ответственные вопросы санитарно-технической практики, далека от совершенства.[ ...]
На основе обработки литературных и экспериментальных данных, а также современных требований по созданию экологически безопасных производств оценку различных методов обезвреживания рекомендовано осуществлять с учетом показателей степени воздействия на окружающую среду (водоемы, почву, воздух); возможности комплексного использования продуктов, получаемых в процессе очистки; технологичности процесса (степень автоматизации, использования типового оборудования); степени опасности (взрывоопасность, токсичность применяемых реагентов); экономического эффекта от применения полученных продуктов . Причем отдельно рассматривается малотоннажное, среднетоннажное и крупно-тоннажное производство. Так, например, при применении термического метода обезвреживания серосодержащих сточных вод показатель качества "Степень воздействия на окружающую среду" оценивался в баллах в соответствии с отметкой на шкале желательности по следующим соображениям. В результате применения термического метода обезвреживания стока образуются газообразные и твердые отходы, использование которых не представляется возможным, так как образуется плав различных солей, которым практически невозможно найти применение. Утилизация газовых выбросов также является сложной технической задачей. Поэтому отходы выбрасываются в окружающую среду и являются источником загрязнения почвы, воздуха, водоемов. Степень экологической опасности возрастает с увеличением тоннажности целевого продукта установки. В связи с этим метод термического обезвреживания сточных вод крупнотоннажного производства серосодержащих присадок по данному показателю соответствует оценке "Очень плохо по шкале желательности.[ ...]
Кишечная палочка заселяет кишечник домашних животных, а также диких - млекопитающих и птиц, рептилий, земноводных, рыб и многих беспозвоночных животных, обитающих вблизи поселений человека, т. е. в пределах зоны фекального загрязнения природы человеком. Естественно, что в пределах этой же зоны кишечная палочка постоянно обнаруживается в воде и почве. Поэтому показателем степени фекального загрязнения воды является не самый факт присутствия кишечной палочки, а количество ее в определенном объеме воды.
Величина, характеризующая содержание в воде органических и минеральных веществ, окисляемых одним из сильных химических окислителей при определенных условиях, называется окисляемостью. Существует несколько видов окисляемости воды: перманганатная, бихроматная, иодатная, цериевая. Наиболее высокая степень окисления достигается методами бихроматной и иодатной окисляемости воды.
Окисляемость выражается в миллиграммах кислорода, пошедшего на окисление органических веществ, содержащихся в 1 дм 3 воды.
Состав органических веществ в природных водах формируется под влиянием многих факторов. К числу важнейших относятся внутриводоемные биохимические процессы продуцирования и трансформации, поступления из других водных объектов,с поверхностными и подземными стоками, с атмосферными осадками, с промышленными и хозяйственно-бытовыми сточными водами. Образующиеся в водоеме и поступающие в него извне органические вещества весьма разнообразны по своей природе и химическим свойствам, в том числе по устойчивости к действию разных окислителей.
Соотношение содержащихся в воде легко-и трудноокисляемых веществ в значительной мере влияет на окисляемость воды в условиях того или иного метода ее определения.
В поверхностных водах органические вещества находятся в растворенном, взвешенном и коллоидном состояниях. Последние в рутинном анализе отдельно не учитываются, поэтому различают окисляемость фильтрованных (растворенное органическое вещество) и нефильтрованных (общее содержание органических веществ) проб.
Величины окисляемости природных вод изменяются в пределах от долей миллиграммов до десятков миллиграммов в литре в зависимости от общей биологической продуктивности водоемов, степени загрязненности органическими веществами и соединениями биогенных элементов, а также от влияния органических веществ естественного происхождения, поступающих из болот, торфяников и т.п. Поверхностные воды имеют более высокую окисляемость по сравнению с подземными (десятые и сотые доли миллиграмма на 1 дм 3), исключение составляют воды нефтяных месторождений и грунтовые воды, питающиеся за счет болот. Горные реки и озера характеризуются окисляемостью 2-3 мг О/дм 3 , реки равнинные - 5-12 мг О/дм 3 , реки с болотным питанием - десятки миллиграммов на 1 дм 3 .
Окисляемость незагрязненных поверхностных вод проявляет довольно отчетливую физико-географическую зональность (табл. 1).
Таблица 1. Физико-географическая зональность природных вод
Окисляемость подвержена закономерным сезонным колебаниям. Их характер определяется, с одной стороны, гидрологическим режимом и зависящим от него поступлением органических веществ с водосбора, с другой, - гидробиологическим режимом.
В водоемах и водотоках, подверженных сильному воздействию хозяйственной деятельности человека, изменение окисляемости выступает как характеристика, отражающая режим поступления сточных вод. Для природных малозагрязненных вод рекомендовано определять перманганатную окисляемость в более загрязненных водах определяют, как правило, бихроматную окисляемость (ХПК).
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования величина ХПК не должна превышать 15 мг О/дм 3 ; в зонах рекреации в водных объектах допускается величина ХПК до 30 мг О/дм 3 .
В программах мониторинга ХПК используется в качестве меры содержания органического вещества в пробе, которое подвержено окислению сильным химическим окислителем. ХПК применяют для характеристики состояния водотоков и водоемов, поступления бытовых и промышленных сточных вод (в том числе, и степени их очистки), а также поверхностного стока.
Таблица 2. Величины ХПК в водоемах с различной степенью загрязненности
Для вычисления концентрации углерода, содержащегося в органических веществах, значение ХПК (мг О/дм 3) умножается на 0,375 (коэффициент, равный отношению количества вещества эквивалента углерода к количеству вещества эквивалента кислорода).
Биохимическое потребление кислорода (БПК)
Степень загрязнения воды органическими соединениями определяют как количество кислорода, необходимое для их окисления микроорганизмами в аэробных условиях. Биохимическое окисление различных веществ происходит с различной скоростью. К легкоокисляющимся ("биологически мягким") веществам относят формальдегид, низшие алифатические спирты, фенол, фурфурол и др. Среднее положение занимают крезолы, нафтолы, ксиленолы, резорцин, пирокатехин, анионоактивные ПАВ и др. Медленно разрушаются "биологически жесткие" вещества, такие как гидрохинон, сульфонол, неионогенные ПАВ и др.
БПК 5
В лабораторных условиях наряду с БПК п определяется БПК 5 - биохимическая потребность в кислороде за 5 суток.
В поверхностных водах величины БПК 5 изменяются обычно в пределах 0,5-4 мг O 2 /дм 3 и подвержены сезонным и суточным колебаниям.
Сезонные колебания зависят в основном от изменения температуры и от исходной концентрации растворенного кислорода. Влияние температуры сказывается через ее воздействие на скорость процесса потребления, которая увеличивается в 2-3 раза при повышении температуры на 10 o C. Влияние начальной концентрации кислорода на процесс биохимического потребления кислорода связано с тем, что значительная часть микроорганизмов имеет свой кислородный оптимум для развития в целом и для физиологической и биохимической активности.
Суточные колебания величин БПК 5 также зависят от исходной концентрации растворенного кислорода, которая может в течение суток изменяться на 2,5 мг О 2 /дм 3 в зависимости от соотношения интенсивности процессов его продуцирования и потребления. Весьма значительны изменения величин БПК 5 в зависимости от степени загрязненности водоемов.
Таблица 3. Величины БПК 5 в водоемах с различной степенью загрязненности
Для водоемов, загрязненных преимущественно хозяйственно-бытовыми сточными водами, БПК 5 составляет обычно около 70% БПК п.
В зависимости от категории водоема величина БПК 5 регламентируется следующим образом: не более 3 мг O 2 /дм 3 для водоемов хозяйственно-питьевого водопользования и не более 6 мг O 2 /дм 3 для водоемов хозяйственно-бытового и культурного водопользования. Для морей (I и II категории рыбохозяйственного водопользования) пятисуточная потребность в кислороде (БПК 5) при 20 о С не должна превышать 2 мг O 2 /дм 3 .
Определение БПК 5 в поверхностных водах используется с целью оценки содержания биохимически окисляемых органических веществ, условий обитания гидробионтов и в качестве интегрального показателя загрязненности воды. Необходимо использовать величины БПК 5 при контролировании эффективности работы очистных сооружений.
БПК п
Полным биохимическим потреблением кислорода (БПК п) считается количество кислорода, требуемое для окисления органических примесей до начала процессов нитрификации. Количество кислорода, расходуемое для окисления аммонийного азота до нитритов и нитратов, при определении БПК не учитывается. Для бытовых сточных вод (без существенной примеси производственных) определяют БПК 20 , считая, что эта величина близка к БПК п.
Полная биологическая потребность в кислороде БПК п для внутренних водоемов рыбохозяйственного назначения (I и II категории) при 20 о С не должна превышать 3 мг O 2 /дм 3 .
Растворенный кислород
Растворенный кислород находится в природной воде в виде молекул O 2 . На его содержание в воде влияют две группы противоположно направленных процессов: одни увеличивают концентрацию кислорода, другие уменьшают ее. К первой группе процессов, обогащающих воду кислородом, следует отнести:
процесс абсорбции кислорода из атмосферы;
выделение кислорода водной растительностью в процессе фотосинтеза;
поступление в водоемы с дождевыми и снеговыми водами, которые обычно пересыщены кислородом.
Абсорбция кислорода из атмосферы происходит на поверхности водного объекта. Скорость этого процесса повышается с понижением температуры, с повышением давления и понижением минерализации. Аэрация - обогащение глубинных слоев воды кислородом - происходит в результате перемешивания водных масс, в том числе ветрового, вертикальной температурной циркуляции и т.д.
Фотосинтетическое выделение кислорода происходит при ассимиляции диоксида углерода водной
растительностью (прикрепленными, плавающими растениями и фитопланктоном). Процесс фотосинтеза протекает тем сильнее, чем выше температура воды, интенсивность солнечного освещения и больше биогенных (питательных) веществ (P ,N и др.) в воде. Продуцирование кислорода происходит в поверхностном слое водоема, глубина которого зависит от прозрачности воды (для каждого водоема и сезона может быть различной, от нескольких сантиметров до нескольких десятков метров).
К группе процессов, уменьшающих содержание кислорода в воде, относятся реакции потребления его на окисление органических веществ: биологическое (дыхание организмов), биохимическое (дыхание бактерий, расход кислорода при разложении органических веществ) и химическое (окисление Fe 2+ ,Mn 2+ ,NO 2 - ,NH 4 + ,CH 4 ,H 2 S ). Скорость потребления кислорода увеличивается с повышением температуры, количества бактерий и других водных организмов и веществ, подвергающихся химическому и биохимическому окислению. Кроме того, уменьшение содержания кислорода в воде может происходить вследствие выделения его в атмосферу из поверхностных слоев и только в том случае, если вода при данных температуре и давлении окажется пересыщенной кислородом.
В поверхностных водах содержание растворенного кислорода варьирует в широких пределах - от 0 до 14 мг/дм 3 - и подвержено сезонным и суточным колебаниям. Суточные колебания зависят от интенсивности процессов его продуцирования и потребления и могут достигать 2,5 мг/дм 3 растворенного кислорода. В зимний и летний периоды распределение кислорода носит характер стратификации. Дефицит кислорода чаще наблюдается в водных объектах с высокими концентрациями загрязняющих органических веществ и в эвтрофированных водоемах, содержащих большое количество биогенных и гумусовых веществ.
Концентрация кислорода определяет величину окислительно-восстановительного потенциала и в значительной мере направление и скорость процессов химического и биохимического окисления органических и неорганических соединений. Кислородный режим оказывает глубокое влияние на жизнь водоема. Минимальное содержание растворенного кислорода, обеспечивающее нормальное развитие рыб, составляет около 5 мг/дм 3 . Понижение его до 2 мг/дм 3 вызывает массовую гибель (замор) рыбы. Неблагоприятно сказывается на состоянии водного населения и пересыщение воды кислородом в результате процессов фотосинтеза при недостаточно интенсивном перемешивании слоев воды.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого и санитарного водопользования содержание растворенного кислорода в пробе, отобранной до 12 часов дня, не должно быть ниже 4 мг/дм 3 в любой период года; для водоемов рыбохозяйственного назначения концентрация растворенного в воде кислорода не должна быть ниже 4 мг/дм 3 в зимний период (при ледоставе) и 6 мг/дм 3 - в летний.
Определение кислорода в поверхностных водах включено в программы наблюдений с целью оценки условий обитания гидробионтов, в том числе рыб, а также как косвенная характеристика оценки качества поверхностных вод и регулирования процесса очистки стоков. Содержание растворенного кислорода существенно для аэробного дыхания и является индикатором биологической активности (т.е. фотосинтеза) в водоеме.
Таблица 4. Содержание кислорода в водоемах с различной степенью загрязненности
Уровень загрязненности воды и класс качества | Растворенный кислород |
||
лето, мг/дм 3 | зима, мг/дм 3 | % насыщения |
|
Очень чистые, I | |||
Чистые, II | |||
Умеренно загрязненные, III | |||
Загрязненные, IV | |||
Грязные, V | |||
Очень грязные, VI | |||
Относительное содержание кислорода в воде, выраженное в процентах его нормального содержания, называется степенью насыщения кислородом. Эта величина зависит от температуры воды, атмосферного
давления и солености. Вычисляется по формуле:
M - степень насыщения воды кислородом, %;
а - концентрация кислорода, мг/дм 3 ;
Р - атмосферное давление в данной местности, Па;
N - нормальная концентрация кислорода при данной температуре, минерализации (солености) и общем давлении 101308 Па.
Щелочность (рН)
Под щелочностью природных или очищенных вод понимают способность некоторых их компонентов связывать эквивалентное количество сильных кислот. Щелочность обусловлена наличием в воде анионов слабых кислот (карбонатов, гидрокарбонатов, силикатов, боратов, сульфитов, гидросульфитов, сульфидов, гидросульфидов, анионов гуминовых кислот, фосфатов).
Их сумма называется общей щелочностью . Ввиду незначительной концентрации трех последних ионов общая щелочность воды обычно определяется только анионами угольной кислоты (карбонатная щелочность). Анионы, гидролизуясь, образуют гидроксид-ионы:
CO 3 2- + H 2 O Û HCO 3 - + OH - ;
HCO 3 - + H 2 O Û H 2 CO 3 + OH - .
Щелочность определяется количеством сильной кислоты, необходимой для нейтрализации 1 дм 3 воды. Щелочность большинства природных вод определяется только гидрокарбонатами кальция и магния, pH этих вод не превышает 8,3.
Определение щелочности полезно при дозировании химических веществ, необходимых на обработку вод для водоснабжения, а также при реагентной очистке некоторых сточных вод. Определение щелочности при избыточных концентрациях щелочноземельных металлов важно для установлении пригодности воды для ирригации. Вместе со значениями рН щелочность воды служит для расчета содержания карбонатов и баланса угольной кислоты в воде.
Водородный показатель (рН)
CO 2 + H 2 0 Û H + + HCO 3 - Û 2 H + + CO 3 2- .
Для удобства выражения содержания водородных ионов была введена величина, представляющая собой логарифм их концентрации, взятый с обратным знаком:
pH = -lg.
Для поверхностных вод, содержащих небольшие количества диоксида углерода, характерна щелочная реакция. Изменения pH тесно связаны с процессами фотосинтеза (при потреблении CO 2 водной
растительностью высвобождаются ионы ОН -). Источником ионов водорода являются также гумусовые кислоты, присутствующие в почвах. Гидролиз солей тяжелых металлов играет роль в тех случаях, когда в воду попадают значительные количества сульфатов железа, алюминия, меди и других металлов:
Fe 2+ + 2H 2 O Þ Fe(OH) 2 + 2H + .
Значение pH в речных водах обычно варьирует в пределах 6,5-8,5, в атмосферных осадках 4,6-6,1, в болотах 5,5-6,0, в морских водах 7,9-8,3. Концентрация ионов водорода подвержена сезонным колебаниям. Зимой величина pH для большинства речных вод составляет 6,8-7,4, летом 7,4-8,2. Величина pH природных вод определяется в некоторой степени геологией водосборного бассейна.
В соответствии с требованиями к составу и свойствам воды водоемов у пунктов питьевого водопользования, воды водных объектов в зонах рекреации, а также воды водоемов рыбохозяйственного назначения, величина pH не должна выходить за пределы интервала значений 6,5-8,5.
ВеличинаpH воды - один из важнейших показателей качества вод. Величина концентрации ионов водорода имеет большое значение для химических и биологических процессов, происходящих в природных водах. От величины pH зависит развитие и жизнедеятельность водных растений, устойчивость различных форм миграции элементов, агрессивное действие воды на металлы и бетон. Величина pH воды также влияет на процессы превращения различных форм биогенных элементов, изменяет токсичность загрязняющих веществ.
В водоеме можно выделить несколько этапов процесса его закисления. На первом этапе рН практически не меняется (ионы бикарбоната успевают полностью нейтрализовать ионы Н + ). Так продолжается до тех пор, пока общая щелочность в водоеме не упадет примерно в 10 раз до величины менее 0,1 моль/дм 3 .
На втором этапе закисления водоема рН воды обычно не поднимается выше 5,5 в течение всего года. О таких водоемах говорят как об умеренно кислых. На этом этапе закисления происходят значительные изменения в видовом составе живых организмов.
На третьем этапе закисления водоема рН стабилизируется на значениях рН <5 (обычно рН 4,5), даже если атмосферные осадки имеют более высокие значения рН . Это связано с присутствием гумусовых веществ и соединений алюминия в водоеме и почвенном слое.
Природные воды в зависимости от рН рационально делить на семь групп (табл. 3.3).
Таблица 5. Группы природных вод в зависимости от рН
Группа | Примечание |
|
Сильнокислые воды | результат гидролиза солей тяжелых металлов (шахтные и рудничные воды) |
|
Кислые воды | поступление в воду угольной кислоты, фульвокислот и других органических кислот в результате разложения органических веществ |
|
Слабокислые воды | присутствие гумусовых кислот в почве и болотных водах (воды лесной зоны) |
|
Нейтральные воды | наличие в водах Ca(HCO 3) 2 , Mg(HCO 3) 2 |
|
Слабощелочные воды | наличие в водах Ca(HCO 3) 2 , Mg(HCO 3) 2 |
|
Щелочные воды | присутствие Na 2 CO 3 или NaHCO 3 |
|
Сильнощелочные воды | присутствие Na 2 CO 3 или NaHCO 3 |
Взвешенные вещества (грубодисперсные примеси) ВВ
Взвешенные твердые вещества, присутствующие в природных водах, состоят из частиц глины, песка, ила, суспендированных органических и неорганических веществ, планктона и различных микроорганизмов. Концентрация взвешенных частиц связана с сезонными факторами и режимом стока, зависит от пород, слагающих русло, а также от антропогенных факторов, таких как сельское хозяйство, горные разработки и т.п.
Взвешенные частицы влияют на прозрачность воды и на проникновение в нее света, на температуру, состав растворенных компонентов поверхностных вод, адсорбцию токсичных веществ, а также на состав и распределение отложений и на скорость осадкообразования. Вода, в которой много взвешенных частиц, не подходит для рекреационного использования по эстетическим соображениям.
В соответствии с требованиями к составу и свойствам воды водных объектов у пунктов хозяйственно-питьевого и культурно-бытового назначения содержание взвешенных веществ в результате спуска сточных вод не должно увеличиваться соответственно более, чем на 0,25 мг/дм 3 и 0,75 мг/дм 3 . Для водоемов, содержащих в межень более 30 мг/дм 3 природных минеральных веществ, допускается увеличение концентрации взвешенных веществ в пределах 5%.
Определение количества взвешенных частиц важно проводить при контроле процессов биологической и физико-химической обработки сточных вод и при оценке состояния природных водоемов.
Грубодисперсные примеси определяют гравиметрическим методом после их отделения путем фильтрования через фильтр "синяя лента" (преимущественно для проб с прозрачностью менее 10 см).
В различных аналитических лабораториях нашей страны специалисты ежегодно выполняют не менее 100 млн. анализов качества воды, причем 23 % определений заключается в оценке их органолептических свойств, 21 % — мутности и концентрации взвешенных веществ, 21 % составляет определение общих показателей — жесткости, солесодержания, ХПК, БПК, 29 % — определение неорганических веществ, 4 % — определение отдельных органических веществ. Значительное количество анализов выполняют санитарно-эпидемиологические службы.
Результаты анализов показывают, что в химическом отношении опасной для здоровья являются каждая четвертая проба, в бактериальном — каждая пятая. Необходимо отметить также, что стоимость комплексного анализа качества питьевой воды за рубежом составляет около 1100 долларов.
По нормативам качества, определяющим наличие и допустимые концентрации примесей, воды различают как питьевую, природные воды (водоемов хозяйственно-питьевого, культурно-бытового и рыбохозяйственного назначения) и сточные воды (нормативно-очищенные, стоки неизвестного происхождения, ливневые).Иногда выделяют также различные виды источников водопотребления, например, водопровод, колодцы, артезианские скважины, подземные источники и поверхностные источники и др. Подобное выделение проводится в тех случаях, когда необходимо учесть специфику источника, либо когда можно ожидать какие-либо характерные способы загрязнения воды, а также пути распространения загрязнений.
Нормативы качества воды различных источников — предельно-допустимые концентрации (ПДК), ориентировочные допустимые уровни (ОДУ) и ориентировочно-безопасные уровни воздействия (ОБУВ) — содержатся в нормативно-технической литературе, составляющей водно-санитарное законодательство. К ним, в частности, относятся Государствен¬ные стандарты — ГОСТ 2874, ГОСТ 24902, ГОСТ 17.1.3.03, различные перечни, нормы, ОБУВ, санитарные правила и нор¬мы охраны поверхностных вод от загрязнений сточными вода¬ми СНиП № 4630 и др.
Среди нормативов качества воды устанавливаются лимитирующие показатели вредности — органолептические, санитарно-токсикологические или общесанитарные. Лимитирующий показатель вредности — это признак, характеризующийся наименьшей безвредной концентрацией вещества в воде.
К органолептическим лимитирующим показателям относятся нормативы для тех веществ, которые вызывают неудовлетворительную органолептическую оценку (по вкусу, запаху, цвету, пенистости) при концентрациях, находящихся в пределах допустимых значений. Так, ПДК для фенола, устанавливаемая по наличию запаха, составляет 0,001 мг/л при условии хлорирования воды, и 0,1 мг/л — в отсутствии хлорирования. К органолептическим лимитирующим показателям относят также ПДК для имеющих окраску соединений хрома (VI) и хрома (Ш); имеющих запах и характерный привкус керосина и хлорофоса; образующего пену сульфолана и т.п.
Ли¬митирующие общесанитарные показатели устанавливаются в виде нормативов для относительно малотоксичных и неток¬сичных соединений — например, уксусной кислоты, ацетона, дибутилфталата и т.п.
Для остальных (основной массы) вредных веществ установлены лимитирующие санитарно-токсикологические показатели вредности.
НОРМАТИВНО-ТЕХНИЧЕСКИЕ ДОКУМЕНТЫ
ВОДНО-САНИТАРНОГО ЗАКОНОДАТЕЛЬСТВА
- ГОСТ 2874-82 «Вода питьевая»;
- ГОСТ 25151-82 «Водоснабжение. Термины и определения»;
- ГОСТ 27065-85 «Качество вод. Термины и определения»;
- ГОСТ 17.1.1.01-77 « Использование и охрана вод. Термины и определения»;
- СанПиН № 4630-88 «ПДК и ОДУ вредных веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования»;
- СанПиН 2.1.4.559-96 « Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества»
1.1. Температура
Температура является важной гидрологической характеристикой водоема, показателем возможного теплового загрязнения. Тепловое загрязнение водоема происходит обычно в результате использования воды для отвода избыточного тепла и сбрасывания воды с повышенной температурой в водоем. При тепловом загрязнении происходит повышение температуры воды в водоеме по сравнению с естественными значениями температур в тех же точках в соответствующие периоды сезона.
Основные источники промышленных тепловых загряз-нений — теплые воды электростанций (прежде всего атомных) и крупных промышленных предприятий, образующиеся в ре-зультате отведения тепла от нагретых агрегатов и машин.
Электростанции часто сбрасывают в водоемы воду, имеющую температуру на 8-12 °С больше, чем забираемая из того же во-доема вода.
Тепловое загрязнение опасно тем, что вызывает интенсификацию процессов жизнедеятельности и ускорение естественных жизненных циклов водных организмов, измене-ние скоростей химических и биохимических реакций, проте-кающих в водоеме.
В условиях теплового загрязнения значи-тельно изменяются кислородный режим и интенсивность процессов самоочищения водоема, изменяется интенсивность фотосинтеза и др. В результате этого нарушается, часто необ-ратимо, природный баланс водоема, складываются особые эко-логические условия, негативно сказывающиеся на животном и растительном сообществе, в частности:
Подогретая вода дезориентирует водные организмы, создает условия для истощения пищевых ресурсов;
. усиливаются температурные различия по вертикальным слоям, особенно в холодный сезон, по «вывернутому» типу, противоположному тому, который складывается в результате естественного распределения температур воды;
. при повышении температуры воды, уменьшается концентрация растворенного кислорода, что усугубляет кислородный режим, особенно в зонах сброса коммунально-бытовых стоков;
. при повышенной температуре многие водные организмы, и в частности рыбы, находятся в состоянии стресса, что снижает их естественный иммунитет;
. происходит массовое размножение сине-зеленых водорослей;
. образуются тепловые барьеры на путях миграций рыбы;
. уменьшается видовое разнообразие растительного и животного «населения» водоемов и др.
Специалисты установили: чтобы не допустить необратимых нарушений экологического равновесия, температура воды в водоеме летом в результате спуска загрязненных (теплых) вод не должна повышаться более чем на 3°С по сравнению со среднемесячной температурой самого жаркого года за послед¬ние 10 лет.
2. Органолептические показатели
Любое знакомство со свойствами воды, сознаем мы это или нет, начинается с определения органолептических показателей, т.е. таких, для определения которых мы пользуемся нашими органами чувств (зрением, обонянием, вкусом), Органолептическая оценка приносит много прямой и косвенной информации о составе воды и может быть проведена быстро и без каких-либо приборов. К органолептическим характеристи¬кам относятся цветность, мутность (прозрачность), запах, вкус и привкус, пенистость.
2.1. Цветность
Цветность — естественное свойство природной воды, обусловленное присутствием гуминовых веществ и комплексных соединений железа. Цветность воды может определяться свойствами и структурой дна водоема, характером водной растительности, прилегающих к водоему почв, наличием в водосборном бассейне болот и торфяников и др. Цветность воды определяется визуально или фотометрически, сравнивая окраску пробы с окраской условной 100-градусной шкалы цветности воды, приготавливаемой из смеси бихромата калия K2Cr2О7 и сульфата кобальта CoS04. Для воды поверхностных водоемов этот показатель допускается не более 20 градусов по шкале цветности.
2.2. Запах
.jpg)
Запах воды обусловлен наличием в ней летучих пахнущих веществ, которые попадают в воду естественным путем либо со сточными водами . Практически все органические вещества (в особенности жидкие) имеют запах и передают его воде. Обычно запах определяют при нормальной (20 °С) и при повышенной (60 °С) температуре воды.
Запах по характеру подразделяют на две группы, описы¬вая его субъективно по своим ощущения:
1) естественного происхождения (от живущих и отмерших ор¬ганизмов, от влияния почв, водной растительности и т.п.);
2) искусственного происхождения. Такие запахи обычно значительно изменяются при обработке воды.
Характер и интенсивность запаха
Интенсивность запаха оценивают по 5-балльной шкале, приведенной в табл. 5 (ГОСТ 3351).
Таблица для определения характера и интенсивности запаха
|
Интенсивность запаха |
Характер проявления запаха |
Оценка ин-тенсивности запаха |
|
Запах не ощущается |
||
|
Очень слабая |
Запах сразу не ощущается, но обнару-живается при тщательном исследовании (при нагревании воды) |
|
|
Слабая |
Запах замечается, если обратить на это внимание |
|
|
Заметная |
Запах легко замечается и вызывает не-одобрительный отзыв о воде |
|
|
Отчетливая |
Запах обращает на себя внимание и за-ставляет воздержаться от питья |
|
|
Очень сильная |
Запах настолько сильный, что делает воду непригодной к употреблению |
Для питьевой воды допускается запах не более 2 баллов.
Можно количественно определить интенсивность запаха как степень разбавления анализируемой воды водой, лишенной запаха.При этом определяют «пороговое число» запаха.
2.3. Вкус и привкус
Оценку вкуса воды проводят питьевой природной во-дой при отсутствии подозрений на ее загрязненность. Раз-личают 4 вкуса: соленый, кислый, горький, сладкий . Осталь-ные вкусовые ощущения считаются привкусами (солоноватый, горьковатый, металлический, хлорный и т.п.).
Интенсивность вкуса и привкуса оценивают по 5-балльной шкале, приведенной в табл. 6 (ГОСТ 3351).При определении вкуса и привкуса воду не проглатывать!
Таблица для определения характера и интенсивности вкуса и привкуса
|
Интенсив-ность вкуса и привкуса |
Характер проявления вкуса и привкуса |
Оценка ин-тенсивности вкуса и прив-куса |
|
Вкус и привкус не ощущаются |
||
|
Очень слабая |
Вкус и привкус сразу не ощущаются по-требителем, но обнаруживаются при тща-тельном тестировании |
|
|
Вкус и привкус замечаются, если обратить на это внимание |
||
|
Заметная |
Вкус и привкус легко замечаются и вызы-вают неодобрительный отзыв о воде |
|
|
Отчетливая |
Вкус и привкус обращают на себя внима-ние и заставляют воздержаться от питья |
|
|
Очень сильная |
Вкус и привкус настолько сильные, что делают воду непригодной к употреблению |
Для питьевой воды допускаются значения показателей вкус и привкус не более 2 баллов.
2.4. Мутность
Мутность воды обусловлена содержанием взвешенных в воде мелкодисперсных примесей — нерастворимых или коллоидных частиц различного происхождения.
Мутность воды обусловливает и некоторые другие характеристики воды — такие как:
— наличие осадка, который может отсутствовать, быть незначительным, заметным, большим, очень большим, измеряясь в миллиметрах;— взвешенные вещества, или грубодисперсные примеси — определяются гравиметрически после фильтрования пробы, по привесу высушенного фильтра. Этот показатель обычно малоинформативен и имеет значение, главным образом, для сточных вод;
— прозрачность, измеряется как высота столба воды, при взгляде сквозь который на белой бумаге можно различать стандартный шрифт см. раздел «Прозрачность».
Мутность воды
2.5. Прозрачность
Прозрачность, или светопропускание, воды обусловлено ее цветом и мутностью, т.е. содержанием в ней различных окрашенных и минеральных веществ. Прозрачность воды часто определяют наряду с мутностью, особенно в тех случаях, когда вода имеет незначительные окраску и мутность, которые за¬труднительно обнаружить.
2.6. Пенистость
Пенистостью считается способность воды сохранять ис¬кусственно созданную пену. Данный показатель может быть использован для качественной оценки присутствия таких ве-ществ, как детергенты (поверхностно-активные вещества) при¬родного и искусственного происхождения и др. Пенистость определяют, в основном, при анализе сточ¬ных и загрязненных природных вод.
3. Водородный показатель (рН)
Водородный показатель (рН) представляет собой отрицательный логарифм концентрации водородных ионов в растворе: рН= -lgH+.
Для всего живого в воде (за исключением некоторых кислотоустойчивых бактерий) минимально возможная величина рН=5; дождь, имеющий рН < 5,5, считается кислотным дождем.
В питьевой воде допускается рН 6,0-9,0; в воде водоемов хозяйственно-питьевого и культурно-бытового водопользования — 6,5—8,5. Величина рН природной воды определятся, как правило, соотношением концентраций гидрокарбонат-анионов и свободного СО2;. Пониженное значение рН характерно для болотных вод за счет повышенного содержания гуминовых и других природных кислот.
Измерение рН при контроле качества природной и пить¬евой воды проводится практически повсеместно.
4. Щелочность и кислотность
Щелочность обусловлена присутствием в воде веществ, содержащих гидроксо-анион, а также веществ, реагирующих с сильными кислотами (соляной, серной). К таким соединениям относятся:
1) сильные щелочи (КОН, NaOH) и летучие основания (на¬пример, NНз x Н2О), а также анионы, обуславливающие высокую щелочность в результате гидролиза в водном растворе при рН>8,4 (S2-, P043-, SiOз2- и др.);
2) слабые основания и анионы летучих и нелетучих слабых кислот (НСОз-; СОз2-, Н2Р04-; НРО42-, СНзСОО-, HS-, анионы гуминовых кислот и др.).
Щелочность пробы воды измеряется в г-экв/л или мг-экв/л и определяется количеством сильной кислоты (обычно исполь¬зуют соляную кислоту с концентрацией 0,05 или 0,1 г-экв/л), израсходованной на нейтрализацию раствора.
При нейтрализации сильных щелочей до значений рН 8,0-8,2 в качестве индикатора используют фенолфталеин.Определяемая таким образом величина называется свободной щелочностью.
При нейтрализации слабых оснований и анионов летучих и нелетучих слабых кислот до значений рН 4,2-4,5 в качестве индикатора используют метиловый оранжевый.Определяемая таким образом величина называется общей щелочностью. При рН 4,5 проба воды имеет нулевую щелочность.
Соединения первой группы из приведенных выше определяются по фенолфталеину, второй — по метилоранжу. Щелочность природных вод в силу их контакта с атмосферным воздухом и известняками, обусловлена, главным образом, содержанием в них гидрокарбонатов и карбонатов, которые вносят значительный вклад в минерализацию воды. Мы уделим этим компонентам достаточно внимания, рассмотрев подробно в разделе «Карбонаты и гидрокарбонаты». Соединения первой группы могут содержаться также в сточных и загрязненных поверхностных водах.
Аналогично щелочности, иногда, главным образом при анализе сточных и технологических вод, определяют кислотность воды.
Кислотность воды обусловлена содержанием в воде ве¬ществ, реагирующих с гидроксо-анионами.
К таким соединениям относятся:
1) сильные кислоты: соляная (НСl), азотная (НNОз), сер¬ная (H2S04);
2) слабые кислоты: уксусная (СНзСООН); сернистая (Н2SОз); угольная (Н2СОз); сероводородная (H2S) и т.п.;
3) катионы слабых оснований: аммоний (NH4+) катионы органических аммонийных соединений.
Кислотность пробы воды измеряется в г-экв/л или мг-экв/л и определяется количеством сильной щелочи (обычно исполь¬зуют растворы КОН или NaOH с концентрацией 0,05 или 0,1 г-экв/л), израсходованной на нейтрализацию раствора. Анало¬гично показателю щелочности, различают свободную и общую кислотность. Свободная кислотность определяется при титро¬вании сильных кислот до значений рН 4,3-4,5 в присутствии в качестве инди-катора метилового оранжевого. В этом диапазоне оттитровываются НСl, HNOз, H2SO4 НзРO4.
Естественная кислотность обусловлена содержанием слабых органических кислот природного происхождения (на¬пример, гуминовых кислот).
Загрязнения, придающие воде по¬вышенную кислотность, возникают при кислотных дождях, при попадании в водоемы не прошедших нейтрализацию сточ¬ных вод промышленных предприятий и др.
Общая кислотность обусловлена содержанием катионов слабых оснований, определяется при титровании до значений рН 8,2-8,4 в присутствии фенолфталеина в качестве индикатора.
В этом диапазоне оттитровываются слабые кисло¬ты — органические, угольная, сероводородная, катионы сла¬бых оснований.
5. Минеральный состав
Минеральный состав воды интересен тем, что отражает результат взаимодействия воды как физической фазы и среды жизни с другими фазами (средами): твердой, т.е. береговыми и подстилающими, а также почвообразующими минералами и породами; газообразной (с воздушной средой) и содержащейся в ней влагой и минеральными компонентами. Кроме того, минеральный состав воды обусловлен целым рядом протекающих в разных средах физико-химических и физических процессов — растворения и кристаллизации, пептизации и коагуляции, седиментации, испарения и конденсации и др. Большое влияние на минеральный состав воды поверхностных водоемов оказывают протекающие в атмосфере и в других средах хи¬мические реакции с участием соединений азота, углерода, кислорода, серы и др.
Ряд показателей качества воды, так или иначе, связан с определением концентрации растворенных в воде различных минеральных веществ. Содержащиеся в воде минеральные соли вносят разный вклад в общее солесодержание, которое мо¬жет быть рассчитано суммированием концентраций каждой из солей. Пресной считается вода, имеющая общее солесодержание не более 1 г/л. Можно выделить две группы минеральных солей, обычно встречающихся в природных водах.
Основные компоненты минерального состава воды
Допустимая величина общей жесткости для питьевой воды и источников централизованного водоснабжения составляет не более 7 мг-экв/л (в отдельных случаях — до 10 мг-экв/л), лимитирующий показатель вредности — органолептический.
Компонент минерального состава воды |
Предельно-допустимая кон-центрация (ПДК)15 |
ГРУППА 1 |
|
|
1. Катионы: |
|
|
Кальций (Са2+) |
|
|
Натрий (Na+) |
|
|
Магний (Mg2+) |
|
|
2. Анионы: |
|
|
Гидрокарбонат (НСОз-) |
|
|
Сульфат (S042-) |
|
|
Хлорид (Сl-) |
|
|
Карбонат (СОз2-) |
|
ГРУППА 2 |
|
|
/. Катионы |
|
|
Аммоний (NH4+) |
|
|
Тяжелые металлы |
0,001 ммоль/л |
|
Железо общее (сумма Fе2+иFе3+) |
|
|
Нитрат (NOз-) |
|
|
Ортофосфат (РО43-) |
|
|
Нитрит (N02-) |
|
Как видно из табл. 8, основной вклад в минеральный состав вносят соли 1-й группы), и образуют так называемые «главные ионы»), которые определяют в первую очередь. К ним относятся хлориды, карбонаты, гидрокарбонаты, сульфаты. Соответствующими катионами для названных анионов являются калий, натрий, кальций, магний. Соли 2-й группы также необходимо учитывать при оценке качества воды, т.к. на каждую из них установлено значение ПДК, хотя они вносят незначительный вклад в солесодержание природных вод.
5.1. Карбонаты и гидрокарбонаты
Как отмечалось выше (в разделе «Щелочность и кислотность), карбонаты и гидрокарбонаты представляют собой компоненты, определяющие природную щелочность воды. Их содержание в воде обусловлено процессами растворения атмосферной С02, взаимодействия воды с находящимися в прилегающих грунтах известняками и, конечно, протекающими в воде жизненными процессами дыхания всех водных организмов.
Определение карбонат - и гидрокарбонат-анионов является титриметрическим и основано на их реакции с водородными ионами в присутствии фенолфталеина (при определении карбонат-анионов) или метилового оранжевого (при определении гидро-карбонат-анионов) в качестве индикаторов. Используя эти два индикатора, удается наблюдать две точки эквивалентности: в первой точке (рН 8,0-8,2) в присутствии фенолфталеина полностью завершается титрование карбонат-анионов, а во второй (рН 4,1-4,5) — гидрокарбонат-анионов. По результатам титрования можно определить концентрации в анализируемом растворе основных ионных форм, обуславливающих потребление кислоты (гидроксо-, карбонат- и гидрокарбонат-анионов), а также величины свободной и общей щелочности воды, т.к. они нахо¬дятся в стехиометрической зависимости от содержания гидроксил-, карбонат- и гидрокарбонат-анионов
Определение карбонат-анионов основано на реакции:
СО32-+H+=HСОз-
Присутствие карбонат-аниона в концентрациях, определяемых аналитически, возможно лишь в водах, рН которых более 8,0-8,2. В случае присутствия в анализируемой воде гидроксо-анионов при определении карбонатов протекает также реакция нейтрализации:
OH-+H+=H2О
Определение гидрокарбонат-анионов основано на реакции:
НСО3-+H+=СO2+Н20
Таким образом, при титровании по фенолфталеину в ре¬акции с кислотой участвуют анионы ОН- и СOз2- , а при титро¬вании по метиловому оранжевому — ОН-, СОз2- и НСОз-.
Величина карбонатной жесткости рассчитывается с уче¬том эквивалентных масс участвующих в реакциях карбонат- и гидрокарбонат-анионов.
Следует иметь в виду, что при определении потребления кислоты на титрование по метилоранжу (Vмо) происходит последовательное титрование и карбонатов, и гидрокарбонатов. По этой причине получаемый объем кислоты VMO содержит соответствующую долю, обусловленную присутствием в исходной пробе карбонатов, перешедших после реакции с катионом водорода в гидрокарбонаты, и не характеризует полностью концентрацию гидрокарбонатов в исходной пробе. Следовательно, при расчете концентраций основных ионных форм, обуславливающих потребление кислоты, необходимо учесть относительное потребление кислоты при титровании по фенолфталеину (Vф) и мети-лоранжу (Vмо). Рассмотрим несколько возможных вариантов, сопоставляя величины Vo и VMO.
1. Vф=0. Карбонаты, а также гидроксо-анионы в пробе отсутствуют
, и потребление кислоты при титровании по метилоранжу может быть обусловлено только присутствием гидрокарбонатов.
2. Vф?0, причем 2Vф
3. 2Vф=Vмо. Гидрокарбонаты в исходной пробе отсутст¬вуют, и потребление кислоты обусловлено содержанием прак¬тически только карбонатов
, которые количественно переходят в гидрокарбонаты. Именно этим объясняется удвоенное, по сравнению с Vф, потребление кислоты VMO.
4. 2Vф>Vмо. В данном случае в исходной пробе гидро¬карбонаты отсутствуют, но присутствуют не только карбонаты, но и другие потребляющие кислоту анионы, а именно — гид¬роксо-анионы.
При этом содержание последних эквивалентно составляет Vон =2Vф - Vмо. Содержание карбонатов можно рассчитать, составив и решив систему уравнений:
Vк + Vон = Vмо )
Vон + 2Vф = Vмо
}Vк = 2(Vмо - Vф)
5. Vф = Vмо. В исходной пробе отсутствуют и карбонаты, и гидрокарбонаты, и потребление кислоты обусловлено при¬сутствием сильных щелочей, содержащих гидроксо-анионы.
Присутствие свободных гидроксо-анионов в заметных количествах (случаи 4 и 5) возможно только в сточных водах.
Результаты титрования по фенолфталеину и метилоран¬жу позволяют рассчитать показатель щелочности воды, кото¬рый численно равен количеству эквивалентов кислоты, израсходованной на титрование пробы объемом 1 л.
При этом потребление кислоты при титровании по фенолфталеину ха-рактеризует свободную щелочность, а по метилоранжу — общую щелочность,
которая измеряется в мг-экв/л. Показатель щелочности используется в России, как правило, при исследовании сточных вод. В некоторых других странах (США, Канаде, Швеции и др.) щелочность определяется при оценке качества природных вод и выражается массовой концентрацией в эквиваленте СаСОз.
Следует иметь в виду, что, при анализе сточных и загрязненных природных вод, получаемые результаты не всегда корректно отражают величины свободной и общей щелочности, т.к. в воде, кроме карбонатов и гидрокарбонатов, могут присутствовать соединения некоторых других групп (см. «Щелочность и кислотность»).
5.2. Сульфаты
Сульфаты, — распространенные компоненты природных вод . Их присутствие в воде обусловлено растворением некоторых минералов — природных сульфатов (гипс), а также переносом с дождями содержащихся в воздухе сульфатов. Последние образуются при реакциях окисления в атмосфере оксида серы (IV) до оксида серы (VI), образования серной кислоты и ее нейтрализации (полной или частичной):
2SO2+О2=2SOз
SOз+H2O=H2SO4
Наличие сульфатов в промышленных сточных водах обычно обусловлено технологическими процессами, проте¬кающими с использованием серной кислоты (производство минеральных удобрений, производства химических веществ). Сульфаты в питьевой воде не оказывают токсического эффекта для человека, однако ухудшают вкус воды: ощущение вкуса сульфатов возникает при их концентрации 250-400 мг/л. Сульфаты могут вызывать отложение осадков в трубопроводах при смешении двух вод с разным минеральным составом, например, сульфатных и кальциевых (в осадок выпадает CaS04).
ПДК сульфатов в воде водоемов хозяйственно-питьевого назначения составляет 500 мг/л, лимитирующий показатель вредности — органолептический.
5.3. Хлориды
Хлориды присутствуют практически во всех пресных поверхностных и грунтовых водах, а также в питьевой воде, в виде солей металлов. Если в воде присутствует хлорид на-трия, она имеет соленый вкус уже при концентрациях свыше 250 мг/л; в случае хлоридов кальция и магния соленость воды возникает при концентрациях свыше 1000 мг/л. Именно по органолептическому показателю — вкусу установлена ПДК для питьевой воды по хлоридам (350 мг/л), лимитирующий показатель вредности — органолептический.
Большие количества хлоридов могут образовываться в промышленных процессах концентрирования растворов, ионного обмена, высоливания и т.д., образуя сточные воды с высоким содержанием хлорид-аниона.
Высокие концентрации хлоридов в питьевой воде не оказывают токсических эффектов на людей, хотя соленые воды очень коррозионно активны по отношению к металлам, пагубно влияют на рост растений, вызывают засоление почв.
6. Сухой остаток
Сухой остаток характеризует содержание в воде нелету¬чих растворенных веществ (главным образом минеральных) и органических веществ, температура кипения которых превы¬шает 105-110 °С.
Величину сухого остатка можно также оценить расчетным методом. При этом надо суммировать полученные в ре¬зультате анализов концентрации растворенных в воде минеральных солей, а также органических веществ (гидрокарбонат суммируется в количестве 50 %). Для питьевой и природной воды величина сухого остатка практически равна сумме массовых концентраций анионов (карбоната, гидрокарбоната, хлорида, сульфата) и катионов (кальция и магния, а также определяемых расчетным методом натрия и калия).
Величина сухого остатка для поверхностных вод водоемов хозяйственно-питьевого и культурно-бытового водопользования не должна превышать 1000 мг/л (в отдельных случаях допускается до 1500 мг/л).
7. Общая жесткость, кальций и магний
Жесткость воды — одно из важнейших свойств, имеющее большое значение при водопользовании. Если в воде находятся ионы металлов, образующие с мылом нерастворимые соли жирных кислот, то в такой воде затрудняется образование пены при стирке белья или мытье рук, в результате чего возникает ощущение жесткости. Жесткость воды пагубно сказывает¬ся на трубопроводах при использовании воды в тепловых сетях, приводя к образованию накипи. По этой причине в воду приходится добавлять специальные «смягчающие» химикаты.Жесткость воды обусловлена присутствием растворимых и малорастворимых солей-минералов, главным образом кальция (Са2+") и магния (Mg2+).
Величина жесткости воды может варьироваться в широких пределах в зависимости от типа пород и почв, слагающих бассейн водосбора, а также от сезона года, погодных условий. Общая жесткость воды в озерах и реках тундры, например, составляет 0,1-0,2 мг-экв/л, а в морях, океанах, подземных водах достигает 80-100 мг-экв/л и даже больше (Мертвое море). В табл. 11 приведены значения общей жесткости воды некоторых рек и водоемов России.
Значения общей жесткости воды некоторых рек и водоемов России
Море, озеро |
Сухой остаток,
|
Общая жест-кость, мг-экв/л |
Река |
Сухой остаток,
|
Общая жест-кость, мг-экв/л |
|
Каспий-ское море |
Дон |
||||
Черное море |
Волга |
||||
Балтий-ское море |
Москва |
||||
Белое море |
Иртыш |
||||
Оз.Балхаш |
|||||
Оз.Байкал |
Нева |
||||
Оз. Ладож-ское |
Днепр |
Из всех солей, относящихся к солям жесткости, выделяют гидрокарбонаты, сульфаты и хлориды. Содержание других растворимых солей кальция и магния в природных водах обычно очень мало. Жесткость, придаваемая воде гидрокарбонатами, называется гидрокарбонатной, или временной, т.к. гид¬рокарбонаты при кипячении воды (точнее, при температуре более 60 °С) разлагаются с образованием малорастворимых карбонатов (Mg(HC03)2 в природных водах встречается реже, чем Са(НСОз)2, т.к. магнезитовые породы мало распространены. Поэтому в пресных водах преобладает так называемая кальциевая жесткость):
СаНСОз> СаСОзv+Н2О+СO2
В природных условиях приведенная выше реакция обратима, однако при выходе на поверхность подземных (грунтовых) вод, обладающих значительной временной жесткостью, равновесие сдвигается в сторону образования СO2, который удаляется в атмосферу. Этот процесс приводит к разложению гидрокарбонатов и выпадению в осадок СаСОз и MgCO3. Таким путем образуются разновидности карбонатных пород, называемые известковыми туфами.
В присутствии растворенного в воде углекислого газа протекает и обратная реакция. Так происходит растворение, или вымывание, карбонатных пород в природных условиях.
Жесткость, обусловленная хлоридами или сульфатами, называется постоянной, т.к. эти соли устойчивы при нагревании и кипячении воды.
Суммарная жесткость воды, т.е. общее содержание растворимых солей кальция и магния, получила название «общей жесткости».
Ввиду того, что солями жесткости являются соли разных катионов, имеющие разную молекулярную массу, концентрация солей жесткости, или жесткость воды, измеряется в единицах эквивалентной концентрации — количеством г-экв/л или мг-экв/л. При жесткости до 4 мг-экв/л вода считается мягкой; от 4 до 8 мг-экв/л — средней жесткости; от 8 до 12 мг-экв/л — жесткой; более 12 мг-экв/л — очень жесткой (встречается и другая классификация воды по степеням жесткости)Допустимая величина общей жесткости для питьевой воды и источников централизованного водоснабжения составляет не более 7 мг-экв/л (в отдельных случаях — до 10 мг-экв/л), лимитирующий показатель вредности — органолептический.
Допустимая величина общей жесткости для питьевой воды и источников централизованного водоснабжения составляет не более 7 мг-экв/л (в отдельных случаях — до 10 мг-экв/л), лимитирующий показатель вредности — органолептический.
8. Общее солесодержание
Для расчета общего солесодержания по сумме массовых концентраций главных анионов в миллиграмм-эквивалентной форме их массовые концентрации, определенные при анализе и выраженные в мг/л, умножают на коэффициенты, указанные в табл. 12, после чего суммируют.
Коэффициенты пересчета концентраций
Концентрацию катиона калия в данном расчете (для при¬родных вод) условно учитывают в виде концентрации катиона натрия. Полученный результат округляют до целых чисел (мг/л)
9. Растворенный кислород
Кислород постоянно присутствует в растворенном виде в поверхностных водах. Содержание растворенного кислорода (РК) в воде характеризует кислородный режим водоема и имеет важнейшее значение для оценки экологического и санитарного состояния водоема. Кислород должен содержаться в воде в достаточном количестве, обеспечивая условия для дыхания гидробионтов. Он также необходим для самоочищения водоемов, т. к. участвует в процессах окисления органических и других примесей, разложения отмерших организмов. Снижение концентрации РК свидетельствует об изменении биологических процессов в водоеме, о загрязнении водоема биохимически интенсивно окисляющимися веществами (в первую очередь органическими). Потребление кислорода обусловлено также химическими процессами окисления содержащихся в воде примесей, а также дыханием водных организмов.
Поступление кислорода в водоем происходит путем растворения его при контакте с воздухом (абсорбции), а также в результате фотосинтеза водными растениями", т.е. в результате физико-химических и биохимических процессов. Кислород также поступает в водные объекты с дождевыми и снеговыми водами. Поэтому существует много причин, вызывающих повышение или снижение концентрации в воде растворенного кислорода.
Растворенный в воде кислород находится в виде гидратированных молекул О2. Содержание РК зависит от температу¬ры, атмосферного давления, степени турбулизации воды, количества осадков, минерализации воды др. При каждом значении температуры существует равновесная концентрация кислорода, которую можно определить по специальным справочным таблицам, составленным для нормального атмосферного давления. Степень насыщения воды кислородом, соответствующая равновесной концентрации, принимается равной 100 %. Растворимость кислорода возрастает с уменьшением температуры и ми¬нерализации, и с увеличением атмосферного давления.
В поверхностных водах содержание растворенного кислорода может колебаться от 0 до 14 мг/л и подвержено значительным сезонным и суточным колебаниям. В эвтрофированных и сильно загрязненных органическими соединениями водных объектах может иметь место значительный дефицит кислорода. Уменьшение концентрации РК до 2 мг/л вызывает массовую гибель рыб и других гидробионтов.
В воде водоемов в любой период года до 12 часов дня концентрация РК должна быть не менее 4 мг/л. ПДК растворенного в воде кислорода для рыбохозяйственных водоемов установлена 6 мг/л (для ценных пород рыбы), либо 4 мг/л (для остальных пород).
Растворенный кислород является весьма неустойчивым компонентом химического состава вод. При его определении особо тщательно следует проводить отбор проб: необходимо избегать контакта воды с воздухом до фиксации кислорода (связывания его в нерастворимое соединение).
В ходе анализа воды определяют концентрацию РК (в мг/л) и степень насыщения им воды (в %) по отношению к равновесному содержанию при данных температуре и атмо-сферном давлении.
Контроль содержания кислорода в воде — чрезвычайно важная проблема, в решении которой заинтересованы практически все отрасли народного хозяйства, включая черную и цветную металлургию, химическую промышленность, сельское хозяйство, медицину, биологию, рыбную и пищевую промышленность, службы охраны окружающей среды. Содержание РК определяют как в незагрязненных природных водах, так и в сточных водах после очистки. Процессы очистки сточных вод всегда сопровождаются контролем содержания кислорода. Определение РК является частью анализа при определении другого важнейшего показателя качества воды — биохимического потребления кислорода (БПК).
10. Биохимическое потребление кислорода (БПК)
В природной воде водоемов всегда присутствуют органические вещества. Их концентрации могут быть иногда очень малы (например, в родниковых и талых водах). Природными источниками органических веществ являются разрушающиеся останки организмов растительного и животного происхождения, как живших в воде, так и попавших в водоем с листвы, по воздуху, с берегов и т.п. Кроме природных, существуют также техногенные источники органических веществ: транспортные предприятия (нефтепродукты), целлюлозно-бумажные и лесоперерабатывающие комбинаты (лигнины), мясокомбинаты (белковые соединения), сельскохозяйственные и фекальные стоки и т.д. Органические загрязнения попадают в водоем разными путями, главньм образом со сточными водами и дождевыми поверхностными смывами с почвы.
В естественных условиях находящиеся в воде органические вещества разрушаются бактериями, претерпевая аэробное биохимическое окисление с образованием двуокиси углерода. При этом на окисление потребляется растворенный в воде кислород. В водоемах с большим содержанием органических веществ большая часть РК потребляется на биохимическое окисление, лишая, таким образом, кислорода другие организмы. При этом увеличивается количество организмов, более устойчивых к низкому содержанию РК, исчезают кислородолюбивые виды и появляются виды, терпимые к дефициту кислорода. Таким образом, в процессе биохимического окисления органических веществ в воде происходит уменьшение концентрации РК, и эта убыль косвенно является мерой содержания в воде орга¬нических веществ. Соответствующий показатель качества воды, характеризующий суммарное содержание в воде органи¬ческих веществ, называется биохимическим потреблением кислорода (БПК).
Определение БПК основано на измерении концентрации РК в пробе воды непосредственно после отбора, а также после инкубации пробы. Инкубацию пробы проводят без доступа воздуха в кислородной склянке (т.е. в той же посуде, где определяется значение РК) в течение времени, необходимого для протекания реакции биохимического окисления.
Так как скорость биохимической реакции зависит от температуры, инкубацию проводят в режиме постоянной температуры (20±1) °С, причем от точности поддержания значения температуры зависит точность выполнения анализа на БПК. Обычно определяют БПК за 5 суток инкубации (БПК5) (Может определяться также БПК10 за 10 суток и БПКполн за 20 суток (при этом окисляется около 90 и 99 % органических веществ соответственно)), однако содержание некоторых соединений более информативно характеризуется величиной БПК за 10 суток или за период полного окисления (БПК10 или БПКполн. соответственно). Погрешность в определении БПК может внести также освещение пробы, влияющее на жизнедеятельность микроорганизмов и способное в некоторых случаях вызывать фотохимическое окисление. Поэтому инкубацию пробы проводят без доступа света (в темном месте).
Величина БПК увеличивается со временем, достигая некоторого максимального значения — БПКполн.; причем загрязнители различной природы могут повышать (понижать) значение БПК. Динамика биохимического потребления кислорода при окислении органических веществ в воде приведена на рис.8..jpg)
Рис. 8. Динамика биохимического потребления кислорода:
а — легкоокисляющиеся («биологически мягкие») вещества — сахара, формаль¬дегид, спирты, фенолы и т.п.;
в — нормально окисляющиеся вещества — нафтолы, крезолы, анионогенные ПАВ, сульфанол и т.п.;
с — тяжело окисляющиеся («биологически жесткие») вещества — неионогенные ПАВ, гидрохинон и т.п.
Таким образом, БПК — количество кислорода в (мг), требуемое для окисления находящихся в 1 л воды органических вещества в аэробных условиях, без доступа света, при 20°С, за определенный период в результате протекающих в воде, биохимических процессов.
Ориентировочно принимают, что БПК5 составляет около 70 % БПКполн., но может составлять от 10 до 90 % в зависимости от окисляющегося вещества.
Особенностью биохимического окисления органических веществ в воде является сопутствующий ему процесс нитрификации, искажающий характер потребления кислорода

2NH4++ЗO2=2HNО2+2H2О+2Н++Q
2HNO2+O2=2HNOз+Q
где: Q — энергия, высвобождающаяся при реакциях
.
Рис. 9. Изменение характера потребления кислорода при нитрификации.
Нитрификация протекает под воздействием особых нитрифицирующих бактерий — Nitrozomonas, Nitrobacter и др. Эти бактерии обеспечивают окисление азотсодержащих соединений, которые обычно присутствуют в загрязненных природных и некоторых сточных водах, и тем самым способствуют превращению азота сначала из аммонийной в нитритную, а затем и нитратную формы
Процесс нитрификации происходит и при инкубации пробы в кислородных склянках. Количество кислорода, по¬шедшее на нитрификацию, может в несколько раз превышать количество кислорода, требуемое для биохимического окисления органических углеродсодержащих соединений. Начало нитрификации можно зафиксировать по минимуму на графике суточных приращений БПК за период инкубации. Нитрификация начинается приблизительно на 7-е сутки инкубации (см. рис. 9), поэтому при определении БПК за 10 и более суток необходимо вводить в пробу специальные вещества — ингибиторы, подавляющие жизнедеятельность нитрифицирующих бактерий, но не влияющие на обычную микрофлору (т.е. на бактерии — окислители органических соединений). В качестве ингибитора применяют тиомочевину (тиокарбамид), который вводят в пробу либо в разбавляющую воду в концентрации 0,5 мг/мл.
В то время как, и природные, и хозяйственно-бытовые сточные воды содержат большое количество микроорганизмов, способных развиваться за счет содержащихся в воде органических веществ, многие виды промышленных сточных вод стерильны, или содержат микроорганизмы, которые не способны к аэробной переработке органических веществ. Однако микрбы можно адаптировать (приспособить) к присутствию различных соединений, в том числе токсичных. Поэтому при анализе таких сточных вод (для них характерно, как правило, повышенное содержание органических веществ) обычно применяют разбавление водой, насыщенной кислородом и содержащей добавки адаптированных микроорганизмов. При определении БПКполн промышленных сточных вод предварительная адаптация микрофлоры имеет решающее значение для получения правильных результатов анализа, т.к. в состав таких вод часто входят вещества, которые сильно замедляют процесс биохимического окисления, а иногда оказывают токсическое действие на бактериальную микрофлору.
Для исследования различных промышленных сточных вод, которые трудно подвергаются биохимическому окислению, используемый метод может применяться в варианте определения «полного» БПК (БПКполн.).
Если в пробе очень много органических веществ, к ней добавляют разбавляющую воду. Для достижения максимальной точности анализа БПК анализируемая проба или смесь пробы с разбавляющей водой должна содержать такое количество кислорода, чтобы во время инкубационного периода произошло снижение его концентрации на 2 мг/л и более, причем остающаяся концентрация кислорода спустя 5 суток инкубации должна составлять не менее 3 мг/л. Если же содержание РК в воде недостаточно, то пробу воды предварительно аэрируют для насыщения кислородом воздуха. Наиболее правильным (точным) считается результат такого определения, при котором израсходовано около 50 % первоначально присутствующего в пробе кислорода.
В поверхностных водах величина БПК5 колеблется в пределах от 0,5 до 5,0 мг/л; она подвержена сезонным и суточным изменениям, которые, в основном, зависят от изменения температуры и от физиологической и биохимической активности микроорганизмов. Весьма значительны изменения БПК5 природных водоемов при загрязнении сточными водами.
Норматив на БПКполн. не должен превышать: для водоемов хозяйственно-питьевого водопользования — 3 мг/л для водоемов культурно-бытового водопользования — 6 мг/л. Соответственно можно оценить предельно-допустимые значения БПК5 для тех же водоемов, равные примерно 2 мг/л и 4 мг/л.
11. Биогенные элементы
Биогенными элементами (биогенами) традиционно считаются элементы, входящие, в значительных количествах, в состав живых организмов
. Круг элементов, относимых к биогенным, достаточно широк, это — азот, фосфор, сера, железо, кальций, магний, калий и др.
Вопросы контроля качества воды и экологической оценки водоемов внесли в понятие биогенных элементов более широкий смысл: к ним относят соединения (точнее, компоненты воды), которые, во-первых, являются продуктами жизнедеятельности различных организмов, и во-вторых, являются «строительным материалом» для живых организмов. В первую очередь к ним относятся соединения азота (нитраты, нитриты, органические и неорганические аммонийные соединения), а также фосфора (ортофосфаты, полифосфаты, органические эфиры фосфорной кислоты и др.). Соединения серы нас интересуют в этой связи, в меньшей степени, так как сульфаты мы рассматривали в аспекте компонента минерального состава воды, а сульфиды и гидросульфиты, если присутствуют в природных водах, то в очень малых концентрациях, и могут быть обнаружены по запаху.
11.1. Нитраты
Нитраты являются солями азотной кислоты и обычно присутствуют в воде
. Нитрат-анион содержит атом азота в максимальной степени окисления «+5». Нитратобразующие (нитратфиксирующие) бактерии превращают нитриты в нитраты в аэробных условиях. Под влиянием солнечного излучения атмосферный азот (N2) превращается также преимущественно в нитраты посредством образования оксидов азота. Многие минеральные удобрения содержат нитраты, которые при избыточном или нерациональном внесении в почву приводят к загрязнению водоемов. Источниками загрязнения нитратами являются также поверхностные стоки с пастбищ, скотных дворов, молочных ферм и т.п.
Повышенное содержание нитратов в воде может служить индикатором загрязнения водоема в результате распростране¬ния фекальных либо химических загрязнений (сельскохозяйст¬венных, промышленных).
Богатые нитратными водами сточные канавы ухудшают качество воды в водоеме, стимулируя массовое развитие водной растительности (в первую очередь — сине-зеленых водорослей) и ускоряя эвтрофикацию водоемов. Питьевая вода и продукты питания, содержащие повы¬шенное количество нитратов, также могут вызывать заболевания, и в первую очередь у младенцев (так называемая метгемоглобинемия). Вследствие этого расстройства ухудшается транспортировка кислорода с клетками крови и возникает синдром «голубого младенца» (гипоксия). Вместе с тем, растения не так чувствительны к увеличению содержания в воде азота, как фосфора.
11.2. Фосфаты и общий фосфор
В природных и сточных водах фосфор может присутствовать в разных видах. В растворенном состоянии (иногда говорят — в жидкой фазе анализируемой воды) он может находиться в виде ортофосфорной кислоты (Н3Р04) и ее анионов (Н2Р04-, НР042-, Р043-), в виде мета-, пиро- и полифосфатов (эти вещества используют для предупреждения образования накипи, они входят также в состав моющих средств). Кроме того, существуют разнообразные фосфорорганические соединения — нуклеиновые кислоты, нуклеопротеиды, фосфолипиды и др., которые также могут присутствовать в воде, являясь продуктами жизнедеятельности или разложения организмов. К фосфорорганическим соединениям относятся также некоторые пестициды.
Фосфор может содержаться и в нерастворенном состоянии (в твердой фазе воды), присутствуя в виде взвешенных в воде труднорастворимых фосфатов, включая природные минералы, белковые, органические фосфорсодержащие соединения, остатки умерших организмов и др. Фосфор в твердой фазе в природных водоемах обычно находится в донных отложениях, однако может встречаться, и в больших количествах, в сточных и загрязненных природных водах.
Фосфор является необходимым элементом для жизни, однако его избыток приводит к ускоренной эвтрофикации во¬доемов. Большие количества фосфора могут попадать в водоемы в результате естественных и антропогенных процессов — поверхностной эрозии почв, неправильного или избыточного применения минеральных удобрений и др.
ПДК полифосфатов (триполифосфат и гексаметафосфат) в воде водоемов составляет 3,5 мг/л в пересчете на ортофосфат-анион РО43-,
лимитирующий показатель вредности — органолептический.
11.3. Аммоний
Соединения аммония содержат атом азота в минимальной степени окисления «-З».
Катионы аммония являются продуктом микробиологического разложения белков животного и растительного происхождения.
Образовавшийся таким образом аммоний вновь вовлекается в процесс синтеза белков, участвуя тем самым в биологическом круговороте веществ (цикле азота). По этой причине аммоний и его соединения в небольших концентрациях обычно присутствуют в природных водах.
Существуют два основных источника загрязнения окружающей среды аммонийными соединениями. Аммонийные соединения в больших количествах входят в состав минеральных и органических удобрений, избыточное и неправильное применение которых приводит к соответствующему загрязнению водоемов. Кроме того, аммонийные соединения в значительных количествах присутствуют в нечистотах (фекалиях). Не утилизированные должным образом нечистоты могут проникать в грунтовые воды или смываться поверхностными стоками в водоемы. Стоки с пастбищ и мест скопления скота, сточные воды от животноводческих комплексов, а также бытовые и хозяйственно-фекальные стоки всегда содержат большие количества аммонийных соединений. Опасное загрязнение грунтовых вод хозяйственно-фекальными и бытовыми сточными водами происходит при разгерметизации системы канализации. По этим причинам повышенное содержание аммонийного азота в поверхностных водах обычно является признаком хозяйственно-фекальных загрязнений.
ПДК аммиака и ионов аммония в воде водоемов состав¬ляет 2,6 мг/л (или 2,0 мг/л по аммонийному азоту). Лимитирующий показатель вредности — общесанитарный.
11.4. Нитриты
Нитритами называются соли азотистой кислоты.
Нитрит-анионы являются промежуточными продуктами биологического разложения азотсодержащих органических соединений
и содержат атомы азота в промежуточной степени окисления «+3». Нитрифицирующие бактерии превращают аммонийные соединения в нитриты в аэробных условиях. Некоторые виды бактерий в процессе своей жизнедеятельности также могут восстанавливать нитраты до нитритов, однако это происходит уже в анаэробных условиях. Нитриты часто используются в промышленности как ингибиторы коррозии, в пищевой промышленности как консерванты.
Благодаря способности превращаться в нитраты, нитриты, как правило, отсутствуют в поверхностных водах. Поэтому наличие в анализируемой воде повышенного содержания нитритов свидетельствует о загрязнении воды, причем с учетом частично прошедшей трансформацию азотистых соединений из одних форм в другие.
ПДК нитритов (по N02-) в воде водоемов составляет 3,3 мг/л (или 1 мг/л нитритного азота), лимитирующий показатель вредности — санитарно-токсикологический.
12. Фтор (фториды)
Фтор в виде фторидов может содержаться в природных и грунтовых водах, что обусловлено его присутствием в составе некоторых почвообразующих (материнских) пород и минералов. Этот элемент может добавляться в питьевую воду в целях профилактики заболеваний кариесом. Однако избыточные количества фтора оказывают вредное воздействие на человека, вызывают разрушение зубной эмали. Кроме того, избыток фтора в организме осаждает кальций, что приводит к нарушениям кальциевого и фосфорного обмена. По этим причинам определение фтора в питьевой воде, а также грунтовых водах (например, воде колодцев и артезианских скважин) и воде водоемов хозяйственно-питьевого назначения, является очень важным.
ПДК фтора в питьевой воде для разных климатических районов составляет от
0,7 до 1,5 мг/л, лимитирующий показатель вредности — санитарно-токсический.
13. Металлы
13.1. Железо общее
Железо — один из самых распространенных элементов в природе. Его содержание в земной коре составляет около 4,7 % по массе, поэтому железо, с точки зрения его распространенности в природе, принято называть макроэлементом.
Известно свыше 300 минералов, содержащих соединения железа. Среди них — магнитный железняк α-FeO(OH), бурый железняк FeзО4x H2O, гематит (красный железняк), гемит (бурый железняк), гидрогетит, сидерит FeСОз, магнитный колчедан FeSx, (х=1-1,4), железомарганцевые конкреции и др. Железо также является жизненно важным микроэлементом для живых организмов и растений, т.е. элементом, необходимым для жизнедеятельности в малых количествах.
В малых концентрациях железо всегда встречается практически во всех природных водах (до 1 мг/л при ПДК на сумму железа 0,3 мг/л) и особенно — в сточных водах. В последние железо может попадать из отходов (сточных вод) травильных и гальванических цехов, участков подготовки металлических поверхностей, стоков при крашении тканей и др.
Железо образует 2 рода растворимых солей, образующих катионы Fe2+ и Fe3+, однако в растворе железо может находиться и во многих других формах, в частности:
1) в виде истинных растворов (аквакомплексов) 2+, содержащих железо (II). На воздухе железо (II) быстро окисляется до железа (III), растворы которого имеют бурую окраску из-за быстрого образования гидроксосоединений (сами растворы Fe2+ и Fe3+ практически бесцветны);
2) в виде коллоидных растворов из-за пептизации (распада агрегированных частиц) гидроксида железа под воздействием органических соединений;
3) в виде комплексных соединений с органическими и неорганическими лигандами. К ним относятся карбонилы, ареновые комплексы (с нефтепродуктами и др. углеводородами), гексацианоферраты 4- и др.
В нерастворимой форме железо может быть представлено в виде различных взвешенных в воде твердых минеральных частиц различного состава.
При рН>3,5 железо (Ш) существует в водном растворе только в виде комплекса, постепенно переходящего в гидроксид. При рН>8 железо (П) тоже существует в виде аквакомплекса, претерпевая окисление через стадию образования железа (Ш):
Fe (II) >Fe (III) >FeO (ОН) х Н2О
Таким образом, поскольку соединения железа в воде могут существовать в различных формах, как в растворе, так и во взвешенных частицах, точные результаты могут быть получены только при определении суммарного железа во всех его формах, так называемого «общего железа».
Раздельное определение железа (II) и (III), их нерастворимых и растворимых форм, дает менее достоверные результаты относительно загрязнения воды соединениями железа, хотя иногда возникает необходимость определить железо в его индивидуальных формах.
Перевод железа в растворимую форму, пригодную для анализа, проводят, добавляя к пробе определенное количество сильной кислоты (азотной, соляной, серной) до рН 1-2.
Диапазон определяемых концентраций железа в воде — от 0,1 до 1,5 мг/л. Определение возможно и при концентрации железа более 1,5 мг/л после соответствующего разбавления пробы чистой водой.
ПДК общего железа в воде водоемов составляет 0,3 мг/л, лимитирующий показатель вредности — органолептический.
13.2. Сумма тяжелых металлов
Говоря о повышенной концентрации в воде металлов, как правило, подразумевают ее загрязнение тяжелыми металлами (Cad, Pb, Zn, Cr, Ni, Co, Hg и др.). Тяжелые металлы, попадая в воду, могут существовать в виде растворимых токсичных солей и комплексных соединений (иногда очень устойчивых), коллоидных частиц, осадков (свободных металлов, оксидов, гидроксидов и др.). Главными источниками загрязнения воды тяжелыми металлами являются гальванические производства, предприятия горнорудной, черной и цветной металлургии, машиностроительные заводы и др. Тяжелые металлы в водоеме вызывают целый ряд негативных последствий: попадая в пищевые цепи и нарушая элементный состав биологических тканей, они оказывают тем самым прямое или косвенное токсическое воздействие на водные организмы. Тяжелые металлы по пищевым цепям попадают в организм человека.
Тяжелые металлы по характеру биологического воздействия можно подразделить на токсиканты и микроэлементы, имеющие принципиально различный характер влияния на живые организмы. Характер зависимости эффекта, оказываемого элементом на организмы, в зависимости от его концентрации в воде (и, следовательно, как правило, в тканях организма), приведен на рис. 10.

Как видно из рис. 10, токсиканты оказывают отрицательное воздействие на организмы при любой концентрации, в то время как микроэлементы имеют область недостаточности, вызывающей отрицательный эффект (менее Ci), и область необходимых для жизни концентраций, при превышении которых снова возникает отрицательный эффект (более С2). Типичными токсикантами являются кадмий, свинец, ртуть; микроэлеметами — марганец, медь, кобальт.
Ниже мы приводим краткие сведения о физиологической (в том числе токсической) некоторых металлов, обычно относимых к тяжелым.
Медь. Медь является микроэлементом, содержится в организме человека, главным образом, в виде комплексных органических соединений и играет важную роль в процессах кроветворения. Во вредном воздействии избытка меди решающую роль играет реакция катионов Сu2+ с SH-группами ферментов. Изменения содержания меди в сыворотке и коже обуславливают явления депигментации кожи (витилиго). Отравление соединениями меди могут приводить к расстройствам нервной системы, нарушению функций печени и почек и др. ПДК меди в воде водоемов хозяйственно-питьевого и культурно-бытового назначения составляет 1,0 мг/л, лимитирующий показатель вредности —органолептический.
Цинк. Цинк является микроэлементом и входит с состав некоторых ферментов. Он содержится в крови (0,5-0,6), мягких тканях(0,7-5,4), кос¬тях (10-18), волосах (16-22 мг %), (единица измерения малых концентраций, 1 мг %=10-3) т.е., в основном, в костях и волосах. Находится в организме в динамическом равновесии, которое сдвигается в условиях повышенных концентраций в окружающей среде. Отрицательное воздействие соединений цинка может выражаться в ослаблении организма, повышенной заболеваемости, астмоподобных явлениях и др. ПДК цинка в воде водоемов составляет 1,0 мг/л, лимитирующий показатель вредности — общесанитарный.
Кадмий . Соединения кадмия очень ядовиты. Действуют на многие системы организма — органы дыхания и желудочно-кишечный тракт, центральную и периферическую нервные системы. Механизм действия соединений кадмия заключается в угнетении активности ряда ферментов, нарушении фосфорно-кальциевого обмена, нарушений метаболизма микроэлементов (Zn, Сu, Ре, Mn, Se). ПДК кадмия в воде водоемов составляет 0,001 мг/л, лимитирующий показатель вредности — санитарно-токсикологический.
Ртуть . Ртуть относится к ультрамикроэлементам и постоянно присутствует в организме, поступая с пищей. Неорганические соединения ртути (в первую очередь катионы Hg реагируют с SH-группами белков («тиоловые яды»), а также с карбоксильными и аминными группами тканевых белков, образуя прочные комплексные соединения — металлопротеиды. В результате возникают глубокие нарушения функций централь¬ной нервной системы, особенно высших ее отделов. Из органических соединений ртути наибольшее значение играет метилртуть, которая хорошо растворима в липидных тканях и быстро проникает в жизненно важные органы, и в том числе в мозг. В результате возникают изменения в вегетативной нервной системе, периферических нервных образованиях, в сердце, сосудах, кроветворных органах, печени и др., нарушения в иммунобиологическом состоянии организма. Соединения ртути обладают также эмбриотоксическим действием (приводят к поражению плода у беременных). ПДК ртути в воде водоемов составляет 0,0005 мг/л, лимитирующий показатель вредности — санитарно-токсикологический.
Свинец
. Соединения свинца — яды, действующие на все живое, но вызывающие изменения особенно в нервной системе, крови и сосудах. Подавляют многие ферментативные процессы. Дети более восприимчивы к воздействию соединений свинца, чем взрослые. Обладают эмбриотоксическим и тератогенным действием, приводят к энцефалопатии и поражениям печени, угнетают иммунитет. Органические соединения свинца (тетраметилсвинец, тетраэтилсвинец) — сильные нервные яды, летучие жидкости. Являются активными ингибиторами обменных процессов. Для всех соединений свинца характерно кумулятивное действие. ПДК свинца в воде водоемов составляет 0,03 мг/л, лимитирующий показатель — сани¬тарно-токсикологический.
Ориентировочное предельно-допустимое значение содержания в водах суммы металлов составляет 0,001 ммоль/л (ГОСТ 24902). Значения ПДК для воды водоемов по отдельным металлам приведены ранее при описании их физиологического воздействия.
14. Активный хлор
Хлор может существовать в воде не только в составе хлоридов, но и в составе других соединений, обладающих сильными окислительными свойствами
. К таким соединениям хлора относятся свободный хлор (CL2), гапохлорит-анион (СlO-), хлорноватистая кислота (НСlO), хлорамины (вещества, при растворении в воде которых образуются монохлорамин NH2Cl, дихлорамин NHCl2, трихлорамин NCl3). Суммарное содержа¬ние этих соединений называют термином «активный хлор».
Содержащие активный хлор вещества подразделяют на две группы: сильные окислители — хлор, гипохлориты и хлорноватистая кислота — содержат так называемый «свободный активный хлор», и относительно менее слабые окислители — хлорамины — «связанный активный хлор». Благодаря сильным окислительным свойствам соединения, имеющие активный хлор, используются для обеззараживания (дезинфекции) питьевой воды и воды в бассейнах, а также для химической очистки некоторых сточных вод. Кроме того, некоторые содержащие активный хлор соединения (например, хлорная известь) широко используются для ликвидации очагов распространения инфекционных загрязнений.
Наиболее широко для дезинфекции питьевой воды используется свободный хлор, который при растворении в воде диспропорционирует по реакции:
Сl2+Н2О=Н++Сl-+НОСl
В природной воде содержание активного хлора не допускается; в питьевой воде его содержание установлено в пересчете на хлор на уровне 0,3-0,5 мг/л в свободном виде и на уровне 0,8-1,2 мг/л в связанном виде (В данном случае приведен диапазон концентраций активного хлора, т.к. при меньших его концентрациях возможна неблагоприятная ситуация по микробиологическим показателям, а при больших — превышение непосредственно по активному хлору.). Активный хлор в указанных концентрациях присутствует в питьевой воде непродолжительное время (не более нескольких десятков минут) и нацело удаляется даже при кратковременном кипячении воды.
По этой причине анализ отобранной пробы на содержание активного хлора следует проводить немедленно.
Интерес к контролю содержания хлора в воде, особенно в питьевой воде, возрос после осознания того факта, что хлорирование воды приводит к образованию заметных количеств хлоруглеводородов, вредных для здоровья населения. Особую опасность представляет хлорирование питьевой воды, загрязненной фенолом. ПДК для фенолов в питьевой воде при отсутствии хлорирования питьевой воды установлено 0,1 мг/л, а в условиях хлорирования (при этом образуются гораздо более токсичные и имеющие резкий характерный запах хлорфенолы) — 0,001 мг/л. Аналогичные химические реакции могут протекать с участием органических соединений природного или техногенного происхождения, приводя к различным токсичным хлорорганическим соединениям — ксенобиотикам.
Лимитирующий показатель вредности для активного хлора — общесанитарный.
15. Интегральная и комплексная оценка качества воды
Каждый из показателей качества воды в отдельности, хотя и несет информацию о качестве воды, все же не может служить мерой качества воды, т.к. не позволяет судить о значениях других показателей, хотя иногда косвенно бывает, связан с некоторыми из них. Например, увеличенное, по сравнению с нормой, значение БПК5 косвенно свидетельствует о повышенном содержании в воде легкоокисляющихся органических веществ, увеличенное значение электропроводности — о повышенном солесодержании и др. Вместе с тем, результатом оценки качества воды должны быть некоторые интегральные показатели, которые охватывали бы основные показатели качества воды (либо те из них, по которым зафиксировано неблагополучие).
В простейшем случае, при наличии результатов по нескольким оцениваемым показателям, может быть рассчитана сумма приведенных концентраций компонентов, т.е. отношение их фактических концентраций к ПДК (правило суммации). Критерием качества воды при использовании правила суммации является выполнение неравенства:
Следует отметить, что сумма приведенных концентраций согласно ГОСТ 2874 может рассчитываться только для химических веществ с одинаковым лимитирующим показателем вредности — органолептическим и санитарно-токсикологическим.
При наличии результатов анализов по достаточному количеству показателей можно определять классы качества воды, которые являются интегральной характеристикой загрязненности поверхностных вод. Классы качества определяются по индексу загрязненности воды (ИЗВ), который рассчитывается как сумма приведенных к ПДК фактических значений 6 основных показателей качества воды по формуле:

Значение ИЗВ рассчитывают для каждого пункта отбора проб (створа). Далее по табл. 14 в зависимости от значения ИЗВ определяют класс качества воды.
Характеристики интегральной оценки качества воды
|
Класс качества воды |
Оценка качества (характе-ристика) воды |
|
|
Менее и равно 0,2 |
Очень чистые |
|
|
Более 0,2-1 |
||
|
Умеренно загрязненные |
||
|
Загрязненные |
||
|
Более 4—6 |
||
|
Очень грязные |
||
|
Чрезвычайно грязные |
В число 6 основных, так называемых «лимитируемых» показателей, при расчете ИЗВ входят, в обязательном порядке, концентрация растворенного кислорода и значение БПК5, а также значения еще 4 показателей, являющихся для данного водоема (воды) наиболее неблагополучными, или которые имеют наибольшие приведенные концентрации (отношение Сi/ПДКi). Такими показателями, по опыту гидрохимического мониторинга водоемов, нередко бывают следующие: содержание нитратов, нитритов, аммонийного азота (в форме органических и неорганических аммонийных соединений), тяжелых металлов —меди, марганца, кадмия и др., фенолов, пестицидов, нефтепродуктов, СПАВ (СПАВ — синтетические поверхностно-активных вещества. Различают неионогенные, а также катионоактивные и анионоактивные СПАВ.), лигносульфонатов. Для расчета ИЗВ показатели выбираются независимо от лимитирующего признака вредности, однако при равенстве приведенных концентраций предпочтение отдается веществам, имеющим санитарно-токсикологический признак вредности (как правило, такие вещества обладают относительно большей вредностью).
Очевидно, не все из перечисленных показателей качества воды могут быть определены полевыми методами. Задачи интегральной оценки осложняются еще и тем обстоятельством, что для получения данных при расчете ИЗВ необходимо проводить анализ по широкому кругу показателей, с выделением из их числа тех, по которым наблюдаются наибольшие приведенные концентрации. При невозможности проведения гидрохимического обследования водоема по всем интересующим показателям целесообразно определить, какие же компоненты могут быть загрязнителями. Это делают на основе анализа доступных результатов гидрохимических исследований прошлых лет, а также сведений и предположений о вероятных источниках загрязнений воды. При невозможности выполнения анализов по данному компоненту полевыми методами (СПАВ, пестициды, нефтепродукты и др.), следует произвести отбор проб и их консервацию с соблюдением необходимых условий (см. главу 5), после чего доставить пробы в требуемые сроки для анализа в лабораторию.
Таким образом, задачи интегральной оценки качества воды практически совпадают с задачами гидрохимического мониторинга, т.к. для окончательного вывода о классе качества воды необходимы результаты анализов по целому ряду показа¬телей в течение продолжительного периода .
Интересным является подход к оценке качества воды, разработанный в США. Национальный Санитарный Фонд этой страны в 1970 г. разработал стандартный обобщенный показатель качества воды (ПКВ), получивший широкое распространение в Америке и некоторых других странах. При разработке ПКВ использовались экспертные оценки на основе большого опыта оценки качества воды при ее использовании для целей бытового и промышленного водопотребления, отдыха на воде (плавания и водных развлечений, рыбалки), охраны водных животных и рыб, сельскохозяйственного использования (водопоя, орошения), коммерческого использования (судоходства, гидроэнергетики, теплоэнергетики) и др. ПКВ является безразмерной величиной, которая может принимать значения от 0 до 100. В зависимости от значения ПКВ возможны следующие оценки качества воды: 100-90 — превосходное; 90-70 — хорошее; 70-50 — посредственное; 50-25 — плохое; 25-0 — очень плохое. Установлено, что минимальное значение ПКВ, при котором удовлетворяется большинство государственных стандартов качества воды, составляет 50—58. Однако вода в водоеме может иметь значение ПКВ больше указанного, и в то же время не соответствовать стандартам по каким-либо отдельным показателям.
ПКВ рассчитывается по результатам определения 9 важнейших характеристик воды — частных показателей, причем каждый из них имеет собственный весовой коэффициент, характеризующий приоритетность данного показателя в оценке качества воды. Частные показатели качества воды, используемые при расчете ПКВ, и их весовые коэффициенты приведены в табл. 15.
Весовые коэффициенты показателей при расчете ПКВ по данным Национального Санитарного Фонда США
|
Наименование показателя |
Значение весового коэффициента |
|
Растворенный кислород |
|
|
Количество кишечных палочек |
|
|
Водородный показатель (рН) |
|
|
Биохимическое потребление кислорода (БПК5) |
|
|
Температура (Δt, тепловое за-грязнение) |
|
|
Общий фосфор |
|
|
Мутность |
|
|
Сухой остаток |
|
Как следует из приведенных в табл. 15 данных, наиболее весомыми показателями являются растворенный кислород и количество кишечных палочек, что вполне понятно, если вспомнить важнейшую экологическую роль растворенного в воде кислорода и опасность для человека, обусловленную кон¬тактом с загрязненной фекалиями водой.
Кроме весовых коэффициентов, имеющих постоянное значение, для каждого отдельного показателя разработаны весовые кривые, характеризующие уровень качества воды (Q) по каждому показателю в зависимости от его фактического значения, определяемого при анализе. Графики весовых кривых приведены на рис. 11. Имея результаты анализов по частным показателям, по весовым кривым определяют численные значения оценки для каждого из них. Последние умножаются на соответствующий весовой коэффициент, и получают оценку качества по каждому из показателей. Суммируя оценки по всем определенным показателям, получают значение обобщенного ПКВ.
Обобщенный ПКВ в значительной степени устраняет недостатки интегральной оценки качества воды с расчетом ИЗВ, т.к. содержит группу конкретных приоритетных показателей, в число которых входит показатель микробного загрязнения.
При оценке качества воды, кроме интегральной оценки, в результате которой устанавливается класс качества воды, а также гидробиологической оценки методами биоиндикации, в результате которой устанавливается класс чистоты, иногда встречается также так называемая комплексная оценка, основу которой составляют методы биотестирования.
Последние относятся также к гидробиологическим методам, но отличаются тем, что позволяют определить реакцию водной биоты на загрязнения по различным тестовым организмам — как простейшим (инфузориям, дафниям), так и высшим — рыбам (гуппиям). Такая реакция иногда считается наиболее показательной, особенно применительно к оценке качества загрязненных вод (природных и сточных) и позволяет определять даже количественно концентрации отдельных соединений.
|
Показатели |
Единицы измерения |
Нормативы |
|
Термотолерантные колиформные бактерии |
Число бактерий в 100 мл. |
Отсутствие |
|
Общие колиформные бактерии |
Число бактерий в 100 мл. |
Отсутствие |
|
Общее микробное число |
Число образующих колоний бактерий в 1 мл. |
Не более 50 |
|
Колифаги |
Число бляшкообразующих единиц (БОЕ) в 100 мл. |
Отсутствие |
|
Споры сульфитредуцирующих клостридий |
Число спор в 20 мл. |
Отсутствие |
|
Цисты лямблий |
Число цист в 50 мл. |
Отсутствие |
Безвредность питьевой воды по химическому составу определяется ее соответствием следующим нормативам:
|
Показатели |
Единица измерения |
Нормативы (ПДК) не более |
Показатель вредности |
Класс опасности |
|
|
Обобщенные показатели |
|||||
|
Водородный показатель |
единицы рН |
в пределах 6-9 |
|||
|
Общая минерализация (сухой остаток) |
|||||
|
Жесткость общая |
|||||
|
Окисляемость перманганатная |
|||||
|
Нефтепродукты, суммарно |
|||||
|
Поверхностно-активные вещества (ПАВ), анионоактивные |
|||||
|
Фенольный индекс |
|||||
|
Неорганические вещества |
|||||
|
Алюминий (Al3+) |
Санит.-токсиколог. |
||||
|
Барий(Ba2+) |
Санит.-токсиколог. |
||||
|
Бериллий(Be2+) |
Санит.-токсиколог. |
||||
|
Бор(B, суммарно) |
Санит.-токсиколог. |
||||
|
Железо (Fe, суммарно) |
Органолептический |
||||
|
Кадмий (Cd, суммарно) |
Санит.-токсиколог. |
||||
|
Марганец (Mn, суммарно) |
Органолептический |
||||
|
Медь (Cu, суммарно) |
Органолептический |
||||
|
Молибден (Mo, суммарно) |
Санит.-токсиколог. |
||||
|
Мышьяк (As, суммарно) |
Санит.-токсиколог. |
||||
|
Никель (Ni, суммарно) |
Санит.-токсиколог. |
||||
|
Нитраты (по NO3) |
Органолептический |
||||
|
Ртуть (Hg, суммарно) |
Санит.-токсиколог. |
||||
|
Свинец (Pb, суммарно) |
Санит.-токсиколог. |
||||
|
Селен (Se, суммарно) |
Санит.-токсиколог. |
||||
|
Стронций(Sr2+) |
Санит.-токсиколог. |
||||
|
Сульфаты (SO42_) |
Органолептический |
||||
|
Фториды (F) для климатических районов |
мг/л |
Санит.-токсиколог. |
|||
|
Органолептический |
|||||
|
Санит.-токсиколог. |
|||||
|
Санит.-токсиколог. |
|||||
|
Органолептический |
|||||
|
Органические вещества |
|||||
|
γ - ГХЦГ (линдан) |
Санит.-токсиколог. |
||||
|
ДДТ (сумма изомеров) |
Санит.-токсиколог. |
||||
|
Санит.-токсиколог. |
|||||
|
Химические вещества |
|||||
|
мг/л |
в пределах 0,3-0,5 |
Органолептический |
||
|
Хлороформ (при хлорировании воды) |
Санит.-токсиколог. |
||||
|
Озон остаточный |
Органолептический |
||||
|
Формальдегид (при озонировании воды) |
Санит.-токсиколог. |
||||
|
Полиакрил-амид |
Санит.-токсиколог. |
||||
|
Активированная кремнекислота (пр Si) |
Санит.-токсиколог. |
||||
|
Полифосфаты (по РО43_) |
Органолептический |
||||
|
Остаточные количества алюминий- и железосодержащих коагулянтов |
См. показатели «Алюминий», «Железо» |
||||
|
Органолептические свойства |
|||||
|
Не более 2 |
|||||
|
Не более 2 |
|||||
|
Цветность |
Не более 20 (35) |
||||
|
Мутность |
ЕМФ (единицы мутности по формазину) или |
2,6 (3,5) |
|||
Перечень вредных веществ, которые могут содержаться в питьевой воде, их источников и характер воздействия на организм человека.
Группы веществ |
Вещества |
Источники |
Воздействие на организм |
|
Неорганические компоненты |
Алюминий |
Водоочистные сооружения, цветная металлургия |
Нейротоксическое действие, болезнь Альцгеймера |
|
Производство пигментов, эпоксидных смол, обогащение каменного угля |
Воздействие на сердечно-сосудистую и кроветворную (лейкозы) системы |
||
|
Цветная металлургия |
Снижение репродуктивной функции у мужчин, нарушение овариально - менструального цикла у женщин (ОМЦ), углеводного обмена, активности ферментов |
||
|
Коррозия труб с гальваническим покрытием, красильная промышленность |
Болезнь “итай-итай”, увеличение кардио-васкулярной заболеваемости (КВЗ), почечной, онкологической (ОЗ), нарушение ОМЦ, течения беременности и родов, мертворождаемость, повреждение костной ткани. |
||
|
Молибден |
Горнодобывающая промышленность, цветная металлургия |
Увеличение КВЗ, подагра, эпидемический зоб, нарушение ОМЦ, |
|
|
Плавильная, стекольная, электронная промышленности, фруктовое садоводство |
Нейротоксическое действие, поражения кожи, ОЗ |
||
|
Шахтные, ливневые воды |
Гипертензия, гипертония |
||
|
Гальваника, химическая промышленность, металлургия |
Поражение сердца, печени, ОЗ, кератиты |
||
|
Нитраты, нитриты |
Животноводство, удобрения, сточные воды |
Метгемоглобинемия, рак желудка |
|
|
Протравка зерна, гальваника, электродетали |
Нарушение функции почек, нервной системы, |
||
|
Тяжелая промышленность, пайки, водопроводы |
Поражение почек. нервной системы, органов кроветворения, КВЗ, авитаминозы С и В |
||
|
Стронций |
Естественный фон |
Стронциевый рахит |
|
|
Горнорудная промышленность, гальваника, электроды, пигменты |
Нарушение функции печени. почек |
||
|
Пластики, электроды, горнорудная промышленность, удобрения |
Поражение нервной системы, щитовидной железы |
||
|
Соли кальция и магния |
Природный фон |
Мочекаменная и слюнно-каменная болезнь, склероз, гипертония. |
|
|
Естественный фон |
Нарушение функции почек, печени, снижение калия |
||
|
Природная вода |
Флюороз скелета и зубов, остеохондроз |
||
|
Цветная металлургия |
Гепатит, анемия, заболевание печени |
||
|
Органические токсиканты |
Четыреххлористый углерод |
Растворители, побочный продукт хлорирования воды (ППХВ) |
ОЗ, мутагенное действие |
|
Тригалометаны (хлороформ, бромоформ,) |
ППХВ, медицинская промышленность |
Мутагенное действие, частично ОЗ |
|
|
1,2-ди-хлорэтан |
ППХВ, производство сжиженного газа, красок, фумигантов |
||
|
Хлориро-ванные этилены |
ППХВ, текстильная, клеевая промышленность, обезжириватели металлов, химчистка, растворители, |
Мутагенное действие, ОЗ |
|
|
Ароматические углеводороды: Бенз(а)-пирен Пентахлор- фенол |
Производство продуктов питания, лекарств. пестицидов, красок. пластиков, газов Каменноугольные смолы, горючие органические вещества, вулканизация |
Воздействие на печень и почки Воздействие на печень и почки, ОЗ |
|
|
Пестициды: Гексахлор-бензол Атразин - 2,4- Симазин |
Инсектицид для рогатого скота, леса, овощей Пестицид (запрещен для использования) Производство пестицидов Гербицид для зерновых культур Протравление гербицидами пшеницы, кукурузы, корнеплодов, почвы, газонов Гербицид для зерновых и водорослей |
Поражение печени, почек, нервной, иммунной, сердечно-сосудистой систем ОЗ, поражение нервной системы и печени Опухоли молочной железы Повреждение печени, почек |
|
|
Химические вещества, влияющие на органолепти-ческие |
Поступление из водопроводной сети, природный фон |
Аллергические реакции. болезни крови |
|
|
Сульфаты |
Природный фон |
Диарея, увеличение числа гипоацидных состояний желудка, желчно- и мочекаменная болезнь. |
|
|
Природный фон |
Гипертензия, гипертоническая болезнь, заболевания сердечно-сосудистой системы. |
||
|
Хлорированные фенолы |
|||
|
Марганец |
Природный фон |
Оказывает элебриотоксическое и гонадотоксическое действие |
Отбор проб воды и их консервация
Отбор проб — операция
, от правильного выполнения которой во многом зависит точность получаемых результатов. Отбор проб при полевых анализах необходимо планировать, намечая точки и глубины отбора, перечень определяемых показателей, количество воды, отбираемой для анализа, совместимость способов консервации проб для их последующего анализа. Чаще всего на водоеме отбираются так называемые разовые пробы. Однако при обследовании водоема может возникнуть необходимость отбора и серий периодических и регулярных проб — из поверхностного, глубинного, придонного слоев вод и т.д. Пробы могут быть отобраны также из подзем¬ных источников, водопровода и т.п. Усредненные данные о составе вод дают смешанные пробы.
В нормативных документах (ГОСТ 24481, ГОСТ 17.1.5.05, ИСО 5667-2 и др.) определены основные правила и рекомендации, которые следует использовать для получения репрезентативных10 проб. Различные виды водоемов (водоисточников) обуславливают некоторые особенности отбора проб в каждом случае. Рассмотрим основные из них.
Пробы из рек и водных потоков
отбирают для определения качества воды в бассейне реки, пригодности воды для пищевого использования, орошения, для водопоя скота, рыборазведения, купания и водного спорта, установления источников загрязнения.
Для определения влияния места сброса сточных вод и вод притоков, пробы отбирают выше по течению и точке, где произошло полное смешение вод. Следует иметь в виду, что загрязнения могут быть неравномерно распространены по потоку реки, поэтому обычно пробы отбирают в местах максимально бурного течения, где потоки хорошо перемешиваются. Пробоотборники помещают вниз по течению потока, располагая на нужной глубине.
Пробы из природных и искусственных озер (прудов
) отбирают с теми же целями, что и пробы воды из рек. Однако, учитывая длительность существования озер, на первый план выступает мониторинг качества воды в течение длительного периода времени (несколько лет), в том числе в местах, предполагаемых к использованию человеком, а также установление последствий антропогенных загрязнений воды (мониторинг ее состава и свойств). Отбор проб из озер должен быть тщательно спланирован для получения информации, к которой можно было бы применять статистическую оценку. Слабопроточные водоемы имеют значительную неоднородность воды в горизонтальном направлении. Качество воды в озерах часто сильно различается по глубине из-за термальной стратификации, причиной которой является фотосинтез в поверхностной зоне, подогрев воды, воздействие донных отложений и др. В больших глубоких водоемах может появляться также внутренняя циркуляция.
Следует отметить, что качество воды в водоемах (как озерах, так и реках) носит циклический характер, причем наблюдается суточная и сезонная цикличность. По этой причине ежедневные пробы следует отбирать в одно и тоже время суток (например, в 12 часов), а продолжительность сезонных исследований должна быть не менее 1 года, включая исследования серий проб, отобранных в течение каждого времени года. Это особенно важно для определения качества воды в реках, имеющих резко отличающиеся режимы — межень и паводок.
Пробы влажных осадков (дождя и снега)
чрезвычайно чувствительны к загрязнениям, которые могут возникнуть в пробе при использовании недостаточно чистой посуды, попадании инородных (не атмосферного происхождения) частиц и др. Считается, что пробы влажных осадков не следует отбирать вблизи источников значительных загрязнений атмосферы — например, котельных или ТЭЦ, открытых складов материалов и удобрений, транспортных узлов и др. В подобных случаях проба осадков будет испытывать значительное влияние указанных локальных источников антропогенных загрязнений.
Образцы осадков собирают в специальные емкости, приготовленные из нейтральных материалов. Дождевая вода собирается при помощи воронки (диаметром не менее. 20 см) в мерный цилиндр (или непосредственно в ведро) и хранится в них до анализа.
Отбор проб снега обычно проводят, вырезая керны на всю глубину (до земли), причем делать это целесообразно в конце периода обильных снегопадов (в начале марта). Объем снега в переводе на воду можно также вычислить по вышеприведенной формуле, где D — диаметр керна.
Пробы грунтовых вод
отбирают для определения пригодности грунтовых вод в качестве источника питьевой воды, для технических или сельскохозяйственных целей, определение влияния на качество грунтовых вод потенциально опасных хозяйственных объектов, при проведении мониторинга загрязнителей грунтовых вод.
Грунтовые воды изучают, отбирая пробы из артезианских скважин, колодцев, родников. Следует иметь в виду, что качество воды в различных водоносных горизонтах может значительно различаться, поэтому при отборе пробы грунтовых вод следует оценить доступными способами глубину горизонта, из которого отобрана проба, возможные градиенты подземных потоков, информацию о составе подземных пород, через которые пролегает горизонт. Поскольку в точке отбора пробы может создаться концентрация различных примесей, отличная от всего водоносного слоя, необходимо откачивать из скважины (или из родника, делая в нем углубление) воду в количестве, достаточном для обновления воды в скважине, водопроводе, углублении и т.п.
Пробы воды из водопроводных сетей
отбирают в целях определения общего уровня качества водопроводной воды, поиска причин загрязнения распределительной системы, контроля степени возможного загрязнения питьевой воды продуктами коррозии и др.
Для получения репрезентативных проб при отборе воды из водопроводных сетей соблюдают следующие правила;
— отбор проб проводят после спуска воды в течение 10-15 мин — времени, обычно достаточного для обновления воды с накопившимися загрязнителями;
— для отбора не используют концевые участки водопроводных сетей, а также участки с трубами малого диаметра (менее 1,2см);
— для отбора используют по возможности участки с турбулентным потоком — краны вблизи клапанов, изгибов;
— при отборе проб вода должна медленно течь в пробоотборную емкость до ее переполнения.
Отбор проб с целью определения состава воды (но не качества!) проводится также при изучении сточных вод, вод и пара котельных установок и др. Подобные работы имеют, как правило, технологические цели, требуют от персонала специальной подготовки и соблюдения, дополнительных правил безопасности. Полевые методы вполне (и часто весьма эффективно) могут быть использованы специалистами и в этих случаях, однако, по указанным причинам, мы не будем рекомендовать их к работе образовательных учреждений, населения и общественности, и описывать соответствующие методики отбора проб.
При отборе проб следует обращать внимание (и фиксировать в протоколе) на сопровождавшие отбор проб гидрологические и климатические условия, такие как осадки и их обилие, паводки, межень и застойность водоема и др.
Пробы воды для анализа могут отбираться как непосредственно перед анализом, так и заблаговременно. Для отбора проб специалисты используют стандартные батометры либо бутыли вместимостью не менее 1 л, открывающиеся и наполняющиеся на требуемой глубине. В связи с тем, что для анализа полевыми методами по какому-либо одному показателю (за исключением растворенного кислорода и БПК) обычно достаточно 30-50 мл воды, отбор проб непосредственно перед анализом может быть выполнен в колбу вместимостью 250-500 мл (например, из состава комплекта-лаборатории, измерительного комплекта и т.п.).
Понятно, что посуда для отбора проб должна быть чистой. Чистота посуды обеспечивается предварительным мытьем ее горячей мыльной водой (стиральные порошки и хромовую смесь не использовать!), многократным споласкиванием чистой теплой водой. В дальнейшем для отбора проб желательно использовать одну и ту же посуду. Сосуды, предназначенные для отбора проб, предварительно тщательно моют, ополаскивают не менее трех раз отбираемой водой и закупоривают стеклянными или пластмассовыми пробками, прокипяченными в дистиллированной воде. Между пробкой и отобранной пробой в сосуде оставляют воздух объемом 5-10 мл. В общую посуду отбирают пробу на анализ только тех компонентов, которые имеют одинаковые условия консервации и хранения.
Отбор проб, не предназначенных для анализа сразу же (т.е. отбираемых заблаговременно), производится в герметично закрывающуюся стеклянную или пластмассовую (желательно фторопластовую) посуду вместимостью не менее 1 л.
Для получения достоверных результатов анализ воды сле¬дует выполнять, по возможности, скорее. В воде протекают процессы окисления-восстановления, сорбции, седиментации, биохимические процессы, вызванные жизнедеятельностью микроорганизмов и др. В результате некоторые компоненты могут окисляться или восстанавливаться: нитраты — до нитритов или ионов аммония, сульфаты — до сульфитов; кислород может расходоваться на окисление органических веществ и т.п. Соответственно могут изменяться и органолептические свойства воды — запах, привкус, цвет, мутность. Биохимические процессы можно замедлить, охладив воду до температуры 4-5 °С (в холодильнике).
Однако, даже владея полевыми методами анализа, не всегда есть возможность выполнить анализ сразу же после отбора пробы. В зависимости от предполагаемой продолжительности хранения отобранных проб может возникнуть необходимость в их консервации. Универсального консервирующего средства не существует, поэтому пробы для анализа отбирают в несколько бутылей. В каждой из них воду консервируют, добавляя соответствующие химикаты в зависимости от определяемых компонентов.
В табл. приведены способы консервации, а также особенности отбора и хранения проб. При анализе воды на некоторые показатели (например, растворенный кислород, фенолы, нефтепродукты) к отбору проб предъявляются особые требования. Так, при определении растворенного кислорода и сероводорода важно исключить контакт пробы с атмосферным воздухом, поэтому бутыли необходимо заполнять при помощи сифона — резиновой трубки, опущенной до дна склянки, обеспечивая переливание воды через край при переполнении склянки. Подробно особые условия при отборе проб (если они существуют) приводятся при описании соответствующих анализов.
Способы консервации, особенности отбора и хранения проб
|
Анализируе-мый показа-тель |
Способ консервации и количество консер-ванта на 1 л воды |
Максимальное время хране-ния пробы |
Особенности отбора и хра-нения проб |
|
1. Активный хлор |
Не консервируют |
Несколько минут |
|
|
2. Аммиак и |
Не консервируют |
||
|
Хранить при 4°С |
|||
|
2-4 мл хлороформа или 1 мл концентри-рованной серной ки-слоты |
|||
|
3.Биохимиче-ское потребле-ние кислорода (БПК) |
Не консервируют |
||
|
Хранить при 4°С |
|||
|
4.Взвешенные вещества |
Не консервируют |
Перед анали-зом взболтать |
|
|
5. Вкус и прив-кус |
Не консервируют |
Отбирать толь-ко в стеклян-ные бутыли |
|
|
6.Водородный показатель (РН) |
Не консервируют |
При отборе пробы |
|
|
В бутыли не оставлять пу-зырьков воз-духа, предо-хранять от нагревания |
|||
|
7. Гидрокарбо-наты |
Не консервируют |
||
|
8. Железо об-щее |
Не консервируют |
||
|
2-4 мл хлороформа или 3 мл концентри-рованной азотной (соляной) кислоты (дорН2) |
|||
|
9. Жесткость общая |
Не консервируют |
||
|
10.Запах (без |
Не консервируют |
Отбирать толь-ко в стеклян-ные бутыли |
|
|
11. Кальций |
Не консервируют |
||
|
12. Карбонаты |
Не консервируют |
||
|
13. Металлы тяжелые (медь, свинец, цинк) |
Не консервируют |
В день отбора |
|
|
3 мл азотной или со-ляной кислоты (до рН2) |
|||
|
Хранить при 4°С |
|||
|
14. Мутность |
Не консервируют |
Перед анали-зом взболтать |
Следует иметь в виду, что ни консервация, ни фиксация не обеспечивают постоянства состава воды неограниченно долго. Они лишь сохраняют на определенное время соответствующий компонент в воде, что позволяет доставить пробы к месту анализа, — например, в полевой лагерь, а при необходимости — и в специализированную лабораторию. В протоколах отбора и анализа проб обязательно указываются даты отбора и анализа проб.