Как видно из определения, соли по составу похожи на кислоты, только вместо атомов водорода они содержат ионы металла. Поэтому их можно также назвать продуктами замещения атомов водорода в кислоте на ионы металла. Например, всем известная поваренная соль NaCl может быть рассмотрена как продукт замещения водорода в соляной кислоте НСl на ион натрия.
Заряд иона натрия 1+, а заряд иона хлора 1-. Так как соединение электронейтрально, формула поваренной соли Na + Cl - . Если же надо вывести формулу сульфида алюминия (III), поступают следующим образом.
- Обозначают заряды ионов, из которых состоит соединение: Al 3+ S 2- . Заряд иона алюминия 3+, а заряд иона серы можно определить по формуле соответствующей сероводородной кислоты H 2 S, он равен 2-.
- Находят наименьшее общее кратное числовых значений зарядов ионов алюминия и серы (3 и 2), оно равно 6.
- Находят индексы, разделив наименьшее общее кратное на величины зарядов, и записывают формулу:
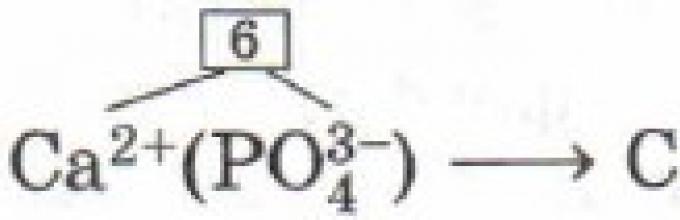
Аналогично выводят формулы солей кислородсодержащих кислот, имеющих сложные ионы. Выведем, например, формулу кальциевой соли фосфорной кислоты - фосфата кальция. По таблице Менделеева определим заряд иона кальция как элемента главной подгруппы II группы (IIA группы): 2+. По формуле фосфорной кислоты Н 3 РO 4 определим заряд иона, образованного кислотным остатком: . Отсюда формула фосфата кальция имеет вид

(читают «кальций три, пэ-о-четыре дважды»).
Нетрудно заметить, что при выведении формул солей по зарядам ионов вы должны действовать так же, как при выведении формул бинарных соединений по валентности и по степеням окисления образующих их элементов.
Как образуют названия солей бескислородных кислот, вы уже рассмотрели, когда знакомились с номенклатурой бинарных соединений: соли НСl называют хлоридами, а соли H 2 S - сульфидами.
Названия солей кислородсодержащих кислот составляют из двух слов: названия иона, образованного кислотным остатком, в именительном падеже и названия иона металла - в родительном. Названия ионов кислотных остатков составляют, в свою очередь, из корней названий элементов, с суффиксами -am для высшей степени окисления и -ит для низшей степени окисления атомов элемента-неметалла, образующего сложный ион остатка кислородсодержащей кислоты. Например, соли азотной кислоты HNO 3 называют нитратами: KNO 3 - нитрат калия, а соли азотистой кислоты HNO 2 - нитритами: Ca(NO 2) 2 - нитрит кальция. Если же металл проявляет различные степени окисления, то их указывают в скобках римской цифрой, например: Fe 2+ SO 3 - сульфит железа (II) и - сульфат железа (III).
Номенклатура солей приведена в таблице 5.
Таблица 5
Номенклатура солей

По растворимости в воде соли делят на растворимые (Р), нерастворимые (Н) и малорастворимые (М). Для определения растворимости солей используют таблицу растворимости кислот, оснований и солей в воде. Если под рукой нет этой таблицы, можно воспользоваться приведёнными ниже правилами. Их легко запомнить.
- Растворимы все соли азотной кислоты - нитраты.
- Растворимы все соли соляной кислоты - хлориды, кроме AgCl (Н), РЬСl 2 (М).
- Растворимы все соли серной кислоты - сульфаты, кроме BaSO 4 (Н), PbSO 4 (Н), CaSO 4 (М), Ag 2 SO 4 (М).
- Растворимы соли натрия и калия.
- Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме этих солей для Na+ и К+.
Рассмотрим растворимую натриевую соль бескислородной соляной кислоты - хлорид натрия NaCl и нерастворимые кальциевые соли угольной и фосфорной кислот - карбонат кальция СаСO 3 и фосфат кальция Са 3 (РO 4) 2 .
Лабораторный опыт № 12
Ознакомление с коллекцией солей
-
Ознакомьтесь с коллекцией выданных вам образцов солей. Запишите их формулы, охарактеризуйте физические свойства, в том числе и растворимость в воде. Рассчитайте молекулярные (молярные) массы солей, а также массовые доли образующих их элементов. Найдите массу 2 моль каждой соли.
Хлорид натрия NaCl - хорошо растворимая в воде соль, известна под названием поваренная соль. Без этой соли невозможна жизнь растений, животных и человека, так как она обеспечивает важнейшие физиологические процессы в организмах: в крови соль создаёт необходимые условия для существования красных кровяных телец, в мышцах обусловливает способность к возбудимости, в желудке образует соляную кислоту, без которой было бы невозможным переваривание и усвоение пищи. Необходимость соли для жизни была известна со времён глубочайшей древности. Значение соли отражено в многочисленных пословицах, поговорках, обычаях. «Хлеб да соль» - вот одно из пожеланий, которым русские люди с давних пор обменивались друг с другом во время приёма пищи, подчёркивая равноценное с хлебом значение соли. Хлеб и соль стали символом гостеприимства и радушия русской нации.
Говорят: «Чтобы узнать человека, надо с ним пуд соли съесть». Оказывается, ждать не так уж долго: за два года двое съедают пуд соли (16 кг), так как в год каждый человек с пищей потребляет от 3 до 5,5 кг соли.
В названиях многих городов и посёлков разных стран присутствует слово соль: Соликамск, Соль-Илецк, Усолье, Усолье-Сибирское, Солт-Лейк-Сити, Солтвиль, Зальцбург и т. д.
Соль образует мощные отложения в земной коре. В Соль-Илецке, например, толщина пласта соли превышает полтора километра. Соли, находящейся в озере Баскунчак в Астраханской области, хватит нашей стране на 400 лет. Огромные количества соли содержат в себе воды морей и океанов. Солью, извлечённой из Мирового океана, можно было бы засыпать всю сушу земного шара слоем в 130 м. Во многих странах Азии и Африки соль добывают из соляных озёр (рис. 66, а), а в европейских странах - часто из соляных шахт (рис. 66, б).

Рис. 66.
Добыча соли:
а - из соляных озёр; б - из шахт
Хлорид натрия широко используют в химической промышленности для получения натрия, хлора, соляной кислоты, в медицине, для приготовления пищи, для консервирования продуктов питания (соление и квашение овощей) и т. д.
Карбонат кальция СаСO 3 - нерастворимая в воде соль, из которой многочисленные морские животные (моллюски, раки, простейшие) строят покровы своего тела - раковины (рис. 67) и кораллы.

Рис. 67.
Эти красивые раковины состоят преимущественно из карбоната кальция
Остатки коралловых полипов, с которыми вы познакомились на уроках биологии, образуют тропические острова (атоллы) и коралловые рифы (рис. 68). Наиболее известен Большой Барьерный риф в Австралии. Скапливаясь после гибели своих «хозяев» на дне водоёмов и главным образом морей, эти раковины за десятки и сотни миллионов лет сформировали мощные пласты соединений кальция, давших начало образованию горных пород - известняков СаСO 3 .

Рис. 68.
Красивейшие морские организмы - кораллы - строят свой скелет из карбоната кальция. Остатки их образуют коралловые атоллы и рифы
Эту же формулу имеет и строительный камень - мрамор, и столь привычный каждому стоящему у доски школьнику мел, который добывают из карьеров или меловых гор (рис. 69). Из известняка получают негашёную и гашёную известь, его применяют в строительстве. Мрамор идёт на изготовление статуй, им отделаны станции метро.

Рис. 69.
Меловые горы
Из карбоната кальция наземные животные «строят» свои скелеты - внутреннюю опору для мягких тканей, которые в десятки раз превышают вес самой опоры.
Фосфат кальция Са 3 (РO 4) 2 , нерастворимый в воде, - это основа минералов фосфоритов и апатитов. Из них производят фосфорные удобрения, без которых было бы невозможно получение высоких урожаев в сельском хозяйстве. Фосфат кальция также входит в состав костей животных.
Ключевые слова и словосочетания
- Соли.
- Номенклатура солей.
- Составление формул солей.
- Растворимые, нерастворимые и малорастворимые соли.
- Хлорид натрия (поваренная соль).
- Карбонат кальция (мел, мрамор, известняк).
- Фосфат кальция.
Работа с компьютером
- Обратитесь к электронному приложению. Изучите материал урока и выполните предложенные задания.
- Найдите в Интернете электронные адреса, которые могут служить дополнительными источниками, раскрывающими содержание ключевых слов и словосочетаний параграфа. Предложите учителю свою помощь в подготовке нового урока - сделайте сообщение по ключевым словам и словосочетаниям следующего параграфа.
Вопросы и задания
- Составьте формулы солей натрия, кальция и алюминия для следующих кислот: азотной, серной и фосфорной. Дайте их названия. Какие из солей растворимы в воде?
- Запишите формулы следующих солей: а) карбоната калия, сульфида свинца (II), нитрата железа (III); б) хлорида свинца (IV), фосфата магния, нитрата алюминия.
- Из перечисленных формул: H 2 S, K 2 SO 3 , КОН, SO 3 , Fe(OH) 3 , FeO, N 2 O 3 , Cu 3 (PO 4) 2 , Cu 2 O, P 2 O 5 , H 3 PO 4 - выпишите формулы: а) оксидов; б) кислот; в) оснований; г) солей. Дайте названия веществ.
Солями называются сложные вещества, молекулы которых, состоят из атомов металлов и кислотных остатков (иногда могут содержать водород). Например, NaCl – хлорид натрия, СаSO 4 – сульфат кальция и т. д.
Практически все соли являются ионными соединениями, поэтому в солях между собой связаны ионы кислотных остатков и ионы металла:
Na + Cl – – хлорид натрия
Ca 2+ SO 4 2– – сульфат кальция и т.д.
Соль является продуктом частичного или полного замещения металлом атомов водорода кислоты. Отсюда различают следующие виды солей:
1. Средние соли – все атомы водорода в кислоте замещены металлом: Na 2 CO 3 , KNO 3 и т.д.
2. Кислые соли – не все атомы водорода в кислоте замещены металлом. Разумеется, кислые соли могут образовывать только двух- или многоосновные кислоты. Одноосновные кислоты кислых солей давать не могут: NaHCO 3 , NaH 2 PO 4 ит. д.
3. Двойные соли – атомы водорода двух- или многоосновной кислоты замещены не одним металлом, а двумя различными: NaKCO 3 , KAl(SO 4) 2 и т.д.
4. Соли основные можно рассматривать как продукты неполного, или частичного, замещения гидроксильных групп оснований кислотными остатками: Аl(OH)SO 4 , Zn(OH)Cl и т.д.
По международной номенклатуре название соли каждой кислоты происходит от латинского названия элемента. Например, соли серной кислоты называются сульфатами: СаSO 4 – сульфат кальция, Mg SO 4 – сульфат магния и т.д.; соли соляной кислоты называются хлоридами: NaCl – хлорид натрия, ZnCI 2 – хлорид цинка и т.д.
В название солей двухосновных кислот добавляют частицу «би» или «гидро»: Mg(HCl 3) 2 – бикарбонат или гидрокарбонат магния.
При условии, что в трехосновной кислоте замещён на металл только один атом водорода, то добавляют приставку «дигидро»: NaH 2 PO 4 – дигидрофосфат натрия.
Соли – это твёрдые вещества, обладающие самой различной растворимостью в воде.
 Химические свойства солей
Химические свойства солей
Химические свойства солей определяются свойствами катионов и анионов, которые входят в их состав.
1. Некоторые соли разлагаются при прокаливании:
CaCO 3 = CaO + CO 2
2. Взаимодействуют с кислотами с образованием новой соли и новой кислоты. Для осуществление этой реакции необходимо, чтобы кислота была более сильная чем соль, на которую воздействует кислота:
2NaCl + H 2 SO 4 → Na 2 SO 4 + 2HCl.
3. Взаимодействуют с основаниями , образуя новую соль и новое основание:
Ba(OH) 2 + Mg SO 4 → BaSO 4 ↓ + Mg(OH) 2 .
4. Взаимодействуют друг с другом с образованием новых солей:
NaCl + AgNO 3 → AgCl + NaNO 3 .
5. Взаимодействуют с металлами, которые стоят в раду активности до металла, который входит в состав соли:
Fe + CuSO 4 → FeSO 4 + Cu↓.
Остались вопросы? Хотите знать больше о солях?
Чтобы получить помощь репетитора – .
Первый урок – бесплатно!
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Поваренная соль — это хлорид натрия, применяемый в качестве добавки к пище, консерванта продуктов питания. Используется также в химической промышленности, медицине. Служит важнейшим сырьем для получения едкого натра, соды и других веществ. Формула соли поваренной — NaCl.
Образование ионной связи между натрием и хлором
Химический состав хлорида натрия отражает условная формула NaCl, которая дает представление о равном количестве атомов натрия и хлора. Но вещество образовано не двухатомными молекулами, а состоит из кристаллов. При взаимодействии щелочного металла с сильным неметаллом каждый атом натрия отдает более электроотрицательному хлору. Возникают катионы натрия Na + и анионы кислотного остатка соляной кислоты Cl - . Разноименно заряженные частицы притягиваются, образуя вещество с ионной кристаллической решеткой. Маленькие катионы натрия расположены между крупными анионами хлора. Число положительных частиц в составе хлорида натрия равно количеству отрицательных, вещество в целом является нейтральным.
Химическая формула. Поваренная соль и галит
Соли — это сложные вещества ионного строения, названия которых начинаются с наименования кислотного остатка. Формула соли поваренной — NaCl. Геологи минерал такого состава называют «галит», а осадочную породу — «каменная соль». Устаревшей химический термин, который часто употребляется на производстве, — «хлористый натрий». Это вещество известно людям с глубокой древности, когда-то его считали «белым золотом». Современные ученики школ и студенты при чтении уравнений реакций с участием хлорида натрия называют химические знаки («натрий хлор»).
Проведем несложные расчеты по формуле вещества:
1) Mr (NaCl) = Ar (Na) + Ar (Cl) = 22,99 + 35,45 = 58,44.
Относительная составляет 58,44 (в а.е.м.).
2) Численно равна молекулярному весу молярная масса, но эта величина имеет единицы измерения г/моль: М (NaCl) = 58,44 г/моль.
3) Образец соли массой 100 г содержит 60,663 г атомов хлора и 39,337 г натрия.
Физические свойства поваренной соли
Хрупкие кристаллы галита — бесцветные или белые. В природе также встречаются месторождения каменной соли, окрашенной в серый, желтый либо голубой цвет. Иногда минеральное вещество обладает красным оттенком, что обусловлено видами и количеством примесей. Твердость галита по составляет всего 2-2,5, стекло оставляет на его поверхности черту.

Другие физические параметры хлорида натрия:
- запах — отсутствует;
- вкус — соленый;
- плотность — 2,165 г/ см3 (20 °C);
- температура плавления — 801 °C;
- точка кипения — 1413 °C;
- растворимость в воде — 359 г/л (25 °C);
Получение хлорида натрия в лаборатории
При взаимодействии металлического натрия с газообразным хлором в пробирке образуется вещество белого цвета — хлорид натрия NaCl (формула поваренной соли).

Химия дает представление о различных способах получения одного и того же соединения. Вот некоторые примеры:
NaOH (водн.) + HCl = NaCl + H 2 O.
Окислительно-восстановительная реакция между металлом и кислотой:
2Na + 2HCl = 2NaCl + Н 2 .
Действие кислоты на оксид металла: Na 2 O + 2HCl (водн.) = 2NaCl + H 2 O
Вытеснение слабой кислоты из раствора ее соли более сильной:
Na 2 CO 3 + 2HCl (водн.) = 2NaCl + H 2 O + CO 2 (газ).
Для применения в промышленных масштабах все эти методы слишком дорогие и сложные.
Производство поваренной соли
Еще на заре цивилизации люди знали, что после засолки мясо и рыба сохраняются дольше. Прозрачные, правильной формы кристаллы галита использовались в некоторых древних странах вместо денег и были на вес золота. Поиск и разработка месторождений галита позволили удовлетворить растущие потребности населения и промышленности. Важнейшие природные источники поваренной соли:
- залежи минерала галита в разных странах;
- вода морей, океанов и соленых озер;
- прослойки и корки каменной соли на берегах соленых водоемов;
- кристаллы галита на стенках вулканических кратеров;
- солончаки.

В промышленности используются четыре основных способа получения поваренной соли:
- выщелачивание галита из подземного слоя, испарение полученного рассола;
- добыча в ;
- выпаривание или рассола соленых озер (77% от массы сухого остатка приходится на хлорид натрия);
- использование побочного продукта опреснения соленых вод.
Химические свойства хлорида натрия

По своему составу NaCl — это средняя соль, образованная щелочью и растворимой кислотой. Хлорид натрия — сильный электролит. Притяжение между ионами настолько велико, что его могут разрушить только сильно полярные растворители. В воде вещества распадается, освобождаются катионы и анионы (Na + , Cl -). Их присутствием обусловлена электропроводность, которой обладает раствор поваренной соли. Формула в этом случае записывается так же, как для сухого вещества — NaCl. Одна из качественных реакций на катион натрия — окрашивание в желтый цвет пламени горелки. Для получения результата опыта нужно набрать на чистую проволочную петлю немного твердой соли и внести в среднюю часть пламени. Свойства поваренной соли также связаны с особенностью аниона, которая заключается в качественной реакции на хлорид-ион. При взаимодействии с нитратом серебра в растворе выпадает белый осадок хлорида серебра (фото). Хлороводород вытесняется из соли более сильными кислотами, чем соляная: 2NaCl + H 2 SO 4 = Na 2 SO 4 + 2HCl. При обычных условиях хлорид натрия не подвергается гидролизу.
Сферы применения каменной соли
Хлорид натрия снижает температуру плавления льда, поэтому зимой на дорогах и тротуарах используется смесь соли с песком. Она впитывает в себя большое количество примесей, при таянии загрязняет реки и ручьи. Дорожная соль также ускоряет процесс коррозии автомобильных кузовов, повреждает деревья, посаженные рядом с дорогами. В химической промышленности хлорид натрия используется как сырье для получения большой группы химических веществ:
- соляной кислоты;
- металлического натрия;
- газообразного хлора;
- каустической соды и других соединений.
Кроме того, поваренная соль применяется в производстве мыла, красителей. Как пищевой антисептик используется при консервировании, засолке грибов, рыбы и овощей. Для борьбы с нарушениями работы щитовидной железы у населения формула соли поваренной обогащается за счет добавления безопасных соединений йода, например, KIO 3 , KI, NaI. Такие добавки поддерживают выработку гормона щитовидной железы, предотвращают заболевание эндемическим зобом.
Значение хлорида натрия для организма человека

Формула соли поваренной, ее состав приобрел жизненно важное значение для здоровья человека. Ионы натрия участвуют в передаче нервных импульсов. Анионы хлора необходимы для выработки соляной кислоты в желудке. Но слишком большое содержание поваренной соли в пище может приводить к высокому кровяному давлению и повышению риска развития заболеваний сердца и сосудов. В медицине при большой кровопотере пациентам вводят физиологический солевой раствор. Для его получения в одном литре дистиллированной воды растворяют 9 г хлорида натрия. Человеческий организм нуждается в непрерывном поступлении этого вещества с пищей. Выводится соль через органы выделения и кожу. Среднее содержание хлорида натрия в теле человека составляет примерно 200 г. Европейцы потребляют в день около 2-6 г поваренной соли, в жарких странах эта цифра выше в связи с более высоким потоотделением.
Когда слышишь слово "соль", то первая ассоциация, конечно же, поваренная, без которой любое блюдо покажется невкусным. Но ведь это не единственное вещество, которое относится к классу химических веществ соли. Примеры, состав и химические свойства солей вы сможете найти в этой статье, а также научитесь правильно составлять название любой из них. Прежде чем продолжить, давайте договоримся, в этой статье мы рассмотрим только неорганические средние соли (полученные при реакции неорганических кислот с полным замещением водорода).
Определение и химический состав
Одно из определений соли звучит так:
- (т. е. состоящее из двух частей), в состав которого входят ионы металлов и кислотный остаток. То есть это вещество, получившееся в результате реакции кислоты и гидроксида (оксида) любого металла.
Есть еще одно определение:
- Это соединение, представляющее собой продукт полного или частичного замещения ионов водорода кислоты ионами металла (подходит для средних, основных и кислых).
Оба определение правильные, но не отражают всю суть процесса получения соли.
Классификация солей
Рассматривая различных представителей класса солей, можно заметить, что они бывают:
- Кислородсодержащими (соли серной, азотной, кремниевой и других кислот, в состав кислотного остатка которых входит кислород и еще один неметалл).
- Бескислородными, т. е. соли, образованные при реакции остаток которой не содержит кислород, — соляная, бромоводородная, сероводородная и другие.
По количеству замещенных водородов:
- Одноосновные: соляная, азотная, иодоводородная и другие. В состав кислоты входит один ион водорода.
- Двухосновные: два иона водорода замещены ионами металлов при образовании соли. Примеры: серная, сернистая, сероводородная и другие.
- Трехосновные: в составе кислоты три иона водорода замещены металлическими ионами: фосфорная.
Есть и другие типы классификаций по составу и свойствам, но мы не станем их разбирать, так как цель статьи немного другая.
Учимся называть правильно
У любого вещества есть название, которое понятно только жителям определенного региона, его еще называют тривиальным. Поваренная соль — пример разговорного названия, по международной номенклатуре оно будет называться уже по-другому. Но в разговоре абсолютно любой человек, знакомый с номенклатурой названий, без проблем поймет, что речь идет о веществе с химической формулой NaCl. Эта соль является производной от соляной кислоты, а соли ее называют хлоридами, то есть называется она хлорид натрия. Нужно просто выучить названия солей, приведенных ниже в таблице, а затем добавить название металла, образовавшего соль.
Но так просто составляется название, если у металла неизменная валентность. А теперь рассмотрим с названием), у которой металл с переменной валентностью — FeCl 3. Вещество называется хлорид железа трехвалентного. Именно такое название правильное!
| Формула кислоты | Название кислоты | Кислотный остаток (формула) | Номенклатурное название | Пример и тривиальное название |
| HCl | соляная | Cl - | хлорид | NaCl (поваренная соль, каменная соль) |
| HI | иодоводородная | I - | иодид | NaI |
| HF | фтороводородная | F - | фторид | NaF |
| HBr | бромоводородная | Br - | бромид | NaBr |
| H 2 SO 3 | сернистая | SO 3 2- | сульфит | Na 2 SO 3 |
| H 2 SO 4 | серная | SO 4 2- | сульфат | CaSO 4 (ангидрит) |
| HClO | хлорноватистая | ClO - | гипохлорит | NaClO |
| HClO 2 | хлористая | ClO 2 - | хлорит | NaClO 2 |
| HClO 3 | хлорноватая | ClO 3 - | хлорат | NaClO 3 |
| HClO 4 | хлорная | ClO 4 - | перхлорат | NaClO 4 |
| H 2 CO 3 | угольная | CO 3 2- | карбонат | CaCO 3 (известняк, мел, мрамор) |
| HNO 3 | азотная | NO 3 - | нитрат | AgNO 3 (ляпис) |
| HNO 2 | азотистая | NO 2 - | нитрит | KNO 2 |
| H 3 PO 4 | фосфорная | PO 4 3- | фосфат | AlPO 4 |
| H 2 SiO 3 | кремниевая | SiO 3 2- | силикат | Na 2 SiO 3 (жидкое стекло) |
| HMnO 4 | марганцовая | MnO 4 - | перманганат | KMnO 4 (марганцовка) |
| H 2 CrO 4 | хромовая | CrO 4 2- | хромат | CaCrO 4 |
| H 2 S | сероводородная | S- | сульфид | HgS (киноварь) |
Химические свойства
Как класс, соли по своим химическим свойствам характеризуются тем, что могут взаимодействовать со щелочами, кислотами, солями и более активными металлами:
1. При взаимодействии со щелочами в растворе обязательным условием реакции является выпадение в осадок одного из получаемых веществ.
2. При взаимодействии с кислотами реакция проходит, если образуется летучая кислота, нерастворимая кислота или нерастворимая соль. Примеры:
- К летучим кислотам относится угольная, так как она легко распадается на воду и углекислый газ: MgCO 3 + 2HCl = MgCl 2 + H 2 O + CO 2.
- Нерастворимая кислота — кремниевая, образуется в результате реакции силиката с другой кислотой.
- Одним из признаков химической реакции является выпадение осадка. Какие соли можно посмотреть в таблице растворимости.
3. Взаимодействие солей между собой происходит только в случае связывания ионов, т. е. одна из образовавшихся солей выпадает в осадок.
4. Чтобы определить, пойдет ли реакция между металлом и солью, нужно обратиться к таблице напряжения металлов (иногда ее еще называют рядом активности).

Только более активные металлы (расположенные левее) могут вытеснять из соли металл. Примером является реакция железного гвоздя с медным купоросом:
CuSO 4 + Fe= Cu + FeSO 4

Такие реакции свойственны большинству представителей класса солей. Но есть и более специфические реакции в химии, свойства соли индивидуальные отражающие, например разложение при накаливании или образование кристаллогидратов. Каждая соль индивидуальна и по-своему необычна.
Определение солей в рамках теории диссоциации. Соли принято делить на три группы: средние, кислые и основные. В средних солях все атомы водорода соответствующей кислоты замещены на атомы металла, в кислых солях они замещены только частично, в основных солях группы ОН соответствующего основания частично замещены на кислотные остатки.
Существуют также некоторые другие типы солей, например двойные соли, в которых содержатся два разных катиона и один анион: СаСО 3 MgCO 3 (доломит), КСl NaCl (сильвинит), KAl(SO 4) 2 (алюмокалиевые квасцы); смешанные соли, в которых содержится один катион и два разных аниона: СаОСl 2 (или Са(ОСl)Сl); комплексные соли, в состав которых входит комплексный ион, состоящий из центрального атома, связанного с несколькими лигандами : K 4 (желтая кровяная соль), K 3 (красная кровяная соль), Na, Cl; гидратные соли (кристаллогидраты), в которых содержатся молекулы кристаллизационной воды: CuSO 4 5H 2 O(медный купорос), Na 2 SO 4 10Н 2 О (глауберова соль).
Название солей образуют из названия аниона, за которым следует название катиона.
Для солей бескислородных кислот к названию неметалла добавляют суффикс ид, например хлорид натрия NaCl, сульфид железа(Н) FeS и др.
При наименовании солей кислородсодержащих кислот к латинскому корню названия элемента добавляют в случае высших степеней окисления окончание — am , в случае низших степеней окисления окончание -ит. В названиях некоторых кислот для обозначения низших степеней окисления неметалла используют приставку гипо-, для солей хлорной и марганцовой кислот используют приставку пер-, например: карбонат кальция СаСО 3 , сульфат железа(III) Fe 2 (SO 4) 3 , сульфит железа(II) FeSO 3 , гипохлорит калия КОСl, хлорит калия КОСl 2 , хлорат калия КОСl 3 , перхлорат калия КОСl 4 , перманганат калия КМnO 4 , дихромат калия К 2 Сг 2 O 7 .
Кислые и основные соли можно рассматривать как продукт неполного превращения кислот и оснований. По международной номенклатуре атом водорода, входящий в состав кислой соли, обозначают приставкой гидро-, группу ОН - приставкой гидрокси, NaHS - гидросульфид натрия, NaHSO 3 - гидросульфит натрия, Mg(OH)Cl - гидроксихлорид магния, Аl(ОН) 2 Сl - дигидроксихлорид алюминия.
В названиях комплексных ионов сначала указывают лиганды, завершают названием металла с указанием соответствующей степени окисления (римскими цифрами в скобках). В названиях комплексных катионов используют русские названия металлов, например: Cl 2 - хлорид тетраамминмеди(П), 2 SO 4 - сульфат диамминсеребра(1). В названиях комплексных анионов используют латинские названия металлов с суффиксом -ат, например: К[Аl(ОН) 4 ] - тетрагидроксиалюминат калия, Na - тетра- гидроксихромат натрия, K 4 - гексацианоферрат(Н) калия.
Названия гидратных солеи (кристаллогридратов ) образуются двумя способами. Можно воспользоваться системой названий комплексных катионов, описанной выше; например, медный купорос SO 4 Н 2 0 (или CuSO 4 5Н 2 O) можно назвать сульфат тетрааквамеди(П). Однако для наиболее известных гидратных солей чаще всего число молекул воды (степень гидратации) указывают численной приставкой к слову «гидрат», например: CuSO 4 5Н 2 O - пентагидрат сульфата меди(И), Na 2 SO 4 10Н 2 О - декагидрат сульфата натрия, СаСl 2 2Н 2 O - дигидрат хлорида кальция.

Растворимость солей
По растворимости в воде соли делятся на растворимые (Р), нерастворимые (Н) и малорастворимые (М). Для определения растворимости солей пользуются таблицей растворимости кислот, оснований и солей в воде. Если таблицы под рукой нет, то можно воспользоваться правилами. Их легко запомнить.
1. Растворимы все соли азотной кислоты - нитраты.
2. Растворимы все соли соляной кислоты - хлориды, кроме AgCl (Н) , PbCl 2 (М) .
3. Растворимы все соли серной кислоты - сульфаты, кроме BaSO 4 (Н) , PbSO 4 (Н) .
4. Растворимы соли натрия и калия.
5. Не растворяются все фосфаты, карбонаты, силикаты и сульфиды, кроме солей Na + и K + .
Из всех химических соединений соли являются наиболее многочисленным классом веществ. Это твердые вещества, они отличаются друг от друга по цвету и растворимости в воде. В начале XIX в. шведский химик И. Берцелиус сформулировал определение солей как продуктов реакций кислот с основаниями или соединений, полученных заменой атомов водорода в кислоте металлом. По этому признаку различают соли средние, кислые и основные. Средние, или нормальные, соли - это продукты полного замещения атомов водорода в кислоте на металл.
Например:
Na 2 CO 3 - карбонат натрия;
CuSO 4 - сульфат меди (II) и т. д.
Диссоциируют такие соли на катионы металла и анионы кислотного остатка:
Na 2 CO 3 = 2Na + + CO 2 —
Кислые соли - это продукты неполного замещения атомов водорода в кислоте на металл. К кислым солям относят, например, питьевую соду NaHCO 3 , которая состоит из катиона металла Na + и кислотного однозарядного остатка HCO 3 — . Для кислой кальциевой соли формула записывается так: Ca(HCO 3) 2. Названия этих солей складываются из названий средних солей с прибавлением приставки гидро- , например:
Mg(HSO 4) 2 - гидросульфат магния.
Диссоциируют кислые соли следующим образом:
NaHCO 3 = Na + + HCO 3 —
Mg(HSO 4) 2 = Mg 2+ + 2HSO 4 —
Основные соли - это продукты неполного замещения гидроксогрупп в основании на кислотный остаток. Например, к таким солям относится знаменитый малахит (CuOH) 2 CO 3 , о котором вы читали в произведениях П. Бажова. Он состоит из двух основных катионов CuOH + и двухзарядного аниона кислотного остатка CO 3 2- . Катион CuOH + имеет заряд +1, поэтому в молекуле два таких катиона и один двухзарядный анион CO 3 2- объединены в электронейтральную соль.
Названия таких солей будут такими же, как и у нормальных солей, но с прибавлением приставки гидроксо- , (CuOH) 2 CO 3 - гидроксокарбонат меди (II) или AlOHCl 2 - гидроксохлорид алюминия. Большинство основных солей нерастворимы или малорастворимы.
Последние диссоциируют так:
AlOHCl 2 = AlOH 2 + + 2Cl —

Свойства солей


Первые две реакции обмена были подробно рассмотрены ранее.
Третья реакция также является реакцией обмена. Она протекает между растворами солей и сопровождается образованием осадка, например:

Четвертая реакция солей связана с положением металла в электрохимическом ряду напряжений металлов (см. «Электрохимический ряд напряжений металлов»). Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений. Это соблюдается при выполнении следующих условий:
1) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
2) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II групп (для последней начиная с Са) не вытесняют другие металлы из растворов солей.


Способы получения солей
Способы получения и химические свойства солей. Соли могут быть получены из неорганических соединений практически любого класса. Наряду с этими способами соли бескислородных кислот могут быть получены при непосредственном взаимодействии металла и неметалла (Cl, S ит. д.).
Многие соли устойчивы при нагревании. Однако соли аммония, а также некоторые соли малоактивных металлов, слабых кислот и кислот, в которых элементы проявляют высшие или низшие степени окисления, при нагревании разлагаются.
СаСO 3 = СаО + СO 2
2Ag 2 CO 3 = 4Ag + 2СO 2 + O 2
NH 4 Cl = NH 3 + НСl
2KNO 3 = 2KNO 2 + O 2
2FeSO 4 = Fe 2 O 3 + SO 2 + SO 3
4FeSO 4 = 2Fe 2 O 3 + 4SO 2 + O 2
2Cu(NO 3) 2 = 2CuO + 4NO 2 + O 2
2AgNO 3 = 2Ag + 2NO 2 + O 2
NH 4 NO 3 = N 2 O + 2H 2 O
(NH 4) 2 Cr 2 O 7 = Cr 2 O 3 + N 2 + 4H 2 O
2КСlO 3 =MnO 2 = 2KCl + 3O 2
4KClO 3 = 3КСlO 4 + KCl