Ферментами называются белки, обладающие каталитическими свойствами. В природе существуют как простые, так и сложные ферменты. Первые целиком представлены полипептидными цепями и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др. Большинство природных ферментов относится к классу сложных белков, содержащих, помимо полипептидных цепей, какой-либо небелковый компонент (кофактор), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью. К основным свойствам ферментов как биокатализаторов относят: 1.Высокая активность. 2. Специфичность – способность катализировать превращение субстрата или одного типа связи. Высокая специфичность обусловлена конформационной и электростатической комплементарностью между молекулами субстрата и фермента и уникальной структурной организацией активного центра, который состоит из субстратсвязывающего участка(отвечает зв связывание субстрата) и каталитического участка(отвечает за выбор пути хим. превращения субстрата).Различают такие виды специфичности: 1)абсолютная субстратная -ферменты действуют только на 1-н определенный субстрат. Пример, уреаза, сукцинатДГ. 2)групповая специфичность - фермент действует на 1 тип связей(напр., пептидную, эфирную, гликозидную). Пример, липазы, фосфатазы, гексокиназы. 3) стереоспецифичность – фермент действует на 1-н вид оптического изомера и не действует на другой. Она обеспечена цис- и трансизомерией. Например, дрожжи сбраживают D- глюкозу, и не действуют на L- глюкозу.4) каталитическая специфичность – фермент катализирует превращение присоединенного субстрата по одному из возможных путей. 3. Термолабильность . Чем выше Т°, тем медленнее протекает реакция.(З-н Ван Гоффа). Для показателя возрастания скорости химической реакции используют температурный коэффициент ВанзГоффа Q 10 , который указывает на возрастание скорости реакции при повышении Т° на 10°С. Оптимум температуры для ферментов 37-40°, высокая активность 50-60°, выше этого показателя происходит денатурация, ниже 20°-ингибирование. При ингибировании и денатурации сильно снижается ферментативная активность. 4. Зависимость активности ферментов от pH. Каждый фермент проявляет максимальную активность при определенном значенииpH. Это значение называется оптимальным pH (для ферментов от 6 до 8). При pH оптимуме между ферментом и субстратом существует наилучшая пространственная и электростатическая комплементарность, которая обеспечивает их связывание, образование фермент – субстратного комплекса и дальнейшего его превращения.
Активный центр ф – область молекулы фермента, в которой происходит связывание и превращение субстрата. В простых ферментах активный центр формируется за счет аминокислотных остатков. В формировании актив центра сложных ферментов принимают участие не только аминокислотные остатки, но и небелковая часть (кофермент, простет группа). В активном центре различают каталитический центр, непосредственно вступающий в хим взаимодействие с субстратом, и субстрат-связывающий центр, который обеспечивает специфическое сродство к субстрату и формирование его комплекса с ферментом. Актив центр преимущественно располагается в углублении белковой молекулы. Строение актив центра обуславливает специфичность ферментов – способность катализировать превращение одного субстрата (или группы близкородственных суб-тов) или одного типа связи. Субстратсвязывающий участок активного центра определяет абсолютную и групповую субстратную специфичность, стереоспецифичность, каталитический участок определяет специфичность пути превращения.
Любые воздействия, приводящие к нарушению третичной структуры, приводят к искажению или разрушению структуры актив центра и соответственно потере ферментов каталитических свойств. Если удается восстановить нативную трехмерную структуру белка-фермента, то восстанавливается и его каталитическая активность.
Любая ферментативная реакция начинается с взаимодействия субстрата, в большинстве случаев, небольшой по размерам молекулы, с активным центром фермента. Под активным центром фермента понимают совокупность аминокислотных остатков, осуществляющих связывание (сорбцию) субстрата, его химическую активацию и превращение. Активный центр белковой молекулы фермента имеет сложную конфигурацию; он включает как полярные (гидрофильные), так и неполярные (гидрофобные) группы.
Структура активного центра фермента складывается из двух составляющих:
1) сорбционного участка (подцентра, сайта), ответственного за связывание, фиксацию и ориентацию субстратов; свойства этого центра определяют специфичность действия фермента;
2) каталитического участка (подцентра, сайта), осуществляющего химическое превращение молекул субстрата и использующего для этих целей, как правило, общий кислотно-основной катализ.
Аминокислотные остатки, образующие каталитический центр однокомпонентного фермента, расположены в различных точках единой полипептидной цепи. Поэтому активный центр, представляющий собой уникальное сочетание нескольких аминокислотных остатков, возникает в тот момент, когда белковая молекула приобретает присущую ей третичную структуру. Чаще всего в активных центрах однокомпонентных ферментов встречаются остатки Ser , His , три, Arg , Cys , Asp , Glu и Tyr . Изменение третичной структуры фермента под влиянием тех или иных факторов может привести к деформации активного центра и изменению ферментативной активности.
Активный центр двухкомпонентных ферментов представлен небелковым компонентом – коферментом (простетической группой) и несколькими выше приведенными минокислотными остатками.
Характерной особенностью cложных или двухкомпонентных ферментов является то, что ни белковая часть, ни добавочная группа в отдельности не обладают заметной каталитической активностью. Только их комплекс проявляет ферментативные свойства. При этом белок резко повышает каталитическую активность добавочной группы, присущую ей в свободном состоянии в очень малой степени; добавочная же группа стабилизирует белковую часть и делает ее менее уязвимой к денатурирующим агентам. Таким образом, хотя непосредственным исполнителем каталитической функции является простетическая группа, образующая каталитический центр, ее действие немыслимо без участия полипептидных фрагментов белковой части фермента.
В апоферменте есть участок, характеризующийся специфической структурой, избирательно связывающий кофермент. Это так называемый кофермент связывающий домен ; его структура у различных апоферментов, соединяющихся с одним и тем же коферментом, очень сходна. Таковы, например, пространственные структуры нуклеотидсвязывающих доменов ряда дегидрогеназ (рис. 1.5.1).
Рис. 1.5.1. Активный центр глюкозо-6-фосфатдегидрогеназы
Методы изучения активных центров ферментов
Представление об активном центре сформировалось в результате анализа данных по ингибированию реакций и химической модификации белковой молекулы. Необратимые ингибиторы блокируют каталитическую активность фермента, осуществляя химическую модификацию одной из групп, участвующих в каталитическом превращении субстрата. Обратимые ингибиторы, образуя комплекс с функциональной группой белка, вызывают либо существенное изменение свойств данной группы (неконкурентные ингибиторы), либо конкурентно блокируют сорбцию (комплексообразование) субстрата в области каталитического центра.
Рассмотрим некоторые примеры.
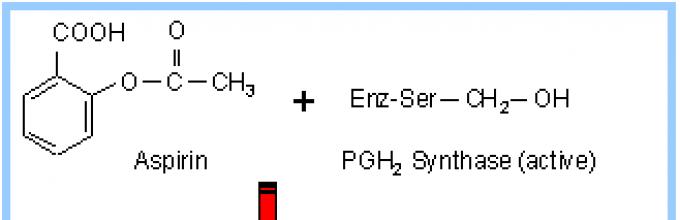
Сериновые протеазы и эстеразы. Каталитически активной группой многих ферментов является гидроксильная группа серина. В активном центре эта спиртовая группа играет роль нуклеофильного реагента в реакциях нуклеофильного замещения при гидролизе сложных эфиров, амидов, пептидов. Представителем семейства сериновых протеаз является простагландин-Н-синтаза, участвующая в метаболизме арахидоновой кислоты.
Простагландин-Н-синтаза. Аспирин (ацетилсалициловая кислота) представляет собой нестероидный противовоспалительный лекарственный препарат. Физиологическое действие препарата связано с его способностью ацетилировать Ser-514, входящий в центр сорбции арахидоновой кислоты - субстрата ПНС.

Рис. 1.5.2. Блокирование гидроксильной группы серина в активном центре простагландин-Н-синтазы
Аспирин выступает необратимым ингибитором лимитирующего фермента синтеза простагландинов. Последующий гидролиз модифицированного белка и анализ продуктов гидролиза позволили идентифицировать центр модификации фермента.
Несмотря на то, что метод химической модификации позволяет получить весьма важную информацию о природе активных центров ферментов, он имеет и определенные недостатки.
Функциональные группы белка, составляющие активный центр, могут быть замаскированы полипептидной цепью или остатками других аминокислот, что делает группы активного центра недоступными для реагента-модификатора. Химическая модификация, как правило, не является избирательной, химической реакции подвергаются сразу несколько аминокислотных остатков в белке. Это ведет к существенному изменению структуры белка, развитию инактивационных и денатурационных процессов, что может привести к потере ферментом каталитической активности даже в том случае, если химически модифицировались остатки, не входящие в каталитический центр. Выводы об участии тех или иных функциональных групп аминокислот в каталитическом процессе на основе данных по химической модификации белка могут быть сделаны с известной осторожностью и оговорками.
Таким образом, метод химической модификации не позволяет получить исчерпывающую информацию об участниках каталитического акта.
Как правило, для такого рода выводов требуются независимые структурные исследования.
Ситуация становится более однозначной, если химический модификатор встраивается в структуру специфического субстрата или ингибитора фермента. В этом случае модификатор адресно направляется в активный центр, что существенно увеличивает вероятность химической реакции с функциональной группой активного центра.
Новые возможности идентификации групп, входящих в активные центры ферментов, появились с развитием техники сайт-специфического мутагенеза. Для ферментов, экспрессию генов которых можно организовать с помощью генно-инженерных конструкций типа плазмид, оказалась возможной замена отдельных аминокислот на уровне ДНК с последующей экспрессией и изучением каталитических свойств получаемых белков. Это позволяет получить важную информацию об участии той или иной аминокислоты данного фрагмента полипептидной цепи в каталитическом акте. Однако и в этом случае при интерпретации результатов необходима известная осторожность, поскольку в белках имеется большое число аминокислот, формирующих структуру активного центра, но не принимающих непосредственное участие в акте катализа.
Окончательная информация о структуре активного центра активного центра может быть получена методом рентгеноструктурного анализа (РСА) и спектроскопии ядерного магнитного резонанса (ЯМР) высокого разрешения. В первом случае исследование проводят на кристаллах фермента, во втором ‒ исследуют растворы фермента. Для идентификации групп, принимающих участие в катализе, обычно используют образование комплекса ферментов с ингибиторами или мало реакционноспособными аналогами субстратов (т.н. квазисубстратами).
Метод РСА впервые был использован Липскомбом с сотрудниками при анализе активного центра карбоксипептидазы А. На рис. 1.5.3. показана структура карбоангидразы по данным рентгеноструктурного анализа.

Рис. 1.5.3. Третичная структура карбоангидразы по данным рентгеноструктурного анализа: а) общий вид ферментной глобулы; б) пространственное расположение аминокислотных остатков
Структуру и свойства каждого белка определяет последовательность аминокислот. В настоящее время становится очевидным, что при большой вариабельности белков некоторые элементы структуры являются консервативными, и эти элементы в значительной степени определяют функцию белковой молекулы. Это особенно характерно для белков, выполняющих каталитическую функцию. Например, для гидролаз, составляющих около трети всех известных ферментов (приблизительно 1100 из 3700), типов структур каталитических центров всего четыре.
Чтобы ответить на вопросы, какие химические структуры образуют каталитический центр, каким образом аминокислоты, расположенные на разных, зачастую удаленных друг от друга участках полипептидной цепи, находят друг друга и формируют уникальную структуру, ‒ используют методы биоинформатики.
По мнению энзимологов в рамках одного суперсемейства ферментов сорбционный сайт, отвечающий за специфичность, может быть представлен многими вариантами аминокислотных остатков, соответствующими вариантам структуры субстратов. В то же время каталитические сайты, число типов которых весьма ограничено, являются консервативными (незаменимыми) элементами структуры. Для подтверждения этого положения был использован биоинформационный подход, основанный на сравнении последовательностей аминокислот в белках, объединенных в одно крупное семейство.
Был проведен анализ нескольких больших семейств ферментов, представленных в базе данных HSSP (www.sander.embl-heidelberg.de/ ). Выбор семейств ферментов был сделан на основании следующих критериев:
1) число анализируемых представителей семейства должно быть более 100; это необходимо для обеспечения статистической достоверности результатов;
2) для анализа следует выбирать семейства ферментов различных классов (оксидоредуктазы, гидролазы, изомеразы и т.д.);
3) по возможности следует выбирать ферменты, для которых установлена структура активных центров и с высокой степенью достоверности изучен механизм катализа.
Проведенный анализ показал, что в полипептидной цепи большая часть позиций аминокислот высоко вариабельна, это означает, что функционирование фермента не зависит от того, какую позицию занимает та или иная аминокислота. В то же время имеются позиции аминокислот, которых относительно немного. Эти позиции и соответствующие им аминокислоты называют консервативными. Именно они играют особую роль в функционировании фермента. Что же это за аминокислоты, и какова их роль?
Биоинформационный анализ ферментов всех классов показал, что наиболее часто консервативной аминокислотой является глицин. По рейтингу консервативности аминокислоты располагаются в следующем ряду: глицин > аспарагиновая кислота > цистеин > пролин > гистидин > аргинин > глутаминовая кислота. Это наиболее важные аминокислоты в ферментативном катализе. В сумме глицин и аспарагиновая кислота составляют примерно 50% всех консервативных аминокислот. Из наиболее часто встречающихся консервативных элементов структуры ферментов можно отметить глицин, аспарагиновую кислоту, цистеин, пролин и гистидин. Эти аминокислоты составляют примерно 70% всех консервативных элементов. Метионин и изолейцин практически никогда не бывают консервативными.
В свою очередь наиболее консервативные аминокислоты можно разделить на две принципиально разные группы:
1) аминокислоты, участвующие в активации молекул субстрата в качестве кислот и оснований (аспарагиновая кислота и гистидин);
2) аминокислоты, формирующие геометрию активного центра (глицин, цистеин, пролин).
Таким образом, статистический анализ показал, что каталитическую функцию фермента и архитектуру активного центра формирует небольшая, но определенная часть аминокислот, занимающих строго фиксированные позиции в полипептидной цепи. Консервативные аминокислоты являются либо кислотами или основаниями (электрофильные и нуклеофильные агенты), формирующими каталитический сайт, либо важными структурообразующими аминокислотами, формирующими структуру белка в целом.
Каталитическую функцию выполняют аспарагиновая кислота, гистидин, аргинин, и глутаминовая кислота. Структурообразующими аминокислотами являются глицин, цистеин, и пролин. Глицин и пролин, обеспечивающие возможность поворота цепи, необходимы для того, чтобы активный центр был образован аминокислотами, расположенными на разных участках полипептидной цепи. А цистеин необходим для фиксации необходимой конформации полипептидной цепи.
Природа сформировала активные центры ферментов из ограниченного числа компонентов. Большая часть активных центров ферментов всех классов сформирована из аспарагиновой и глутаминовой кислот, из гистидина и аргинина, из ионов нескольких металлов. Как следствие, число типов каталитических центров невелико. Например, для гидролаз, составляющих около трети всех известных ферментов, можно идентифицировать всего четыре основных типа структуры. Эффективные комбинации каталитических групп, характерные для одних реакций, природа активно использует для организации каталитических центров других типов реакций.
Полипептидная цепь обеспечивает организацию каталитических групп в активные центры. Как известно, в растворе практически исключены трехмолекулярные реакции и реакции более высоких порядков. В ферментативных процессах в реакции участвуют четыре (или пять) остатков различных аминокислот, организованных в полипептидную цепь. Ферментативный катализ не использует сильных химических агентов; компоненты, составляющие активные центры, ‒ это относительно слабые кислоты и основания. Однако они хорошо организованы в пространстве и, как следствие, весьма эффективны.
Примеры активных центров некоторых ферментов
Остановимся на ферментах класса гидролаз, для большинства которых идентифицированы группы, составляющие каталитически активные центры, и созданы обоснованные представления о взаимодействии этих групп в механизме каталитического цикла.
По структуре активных центров и механизму действия гидролазы условно можно разделить на 4 основных типа.
1. Гидролазы, содержащие в активном центре аспарагиновую или глутаминовую кислоту (лизоцим-пепсиновый тип).
2. Гидролазы, содержащие в активном центре гидроксильную группу серина, треонина или цистеина и цепь переноса протонов, активирующую эту группу (тип химотрипсина); гидролазы, использующие имидазольную группу гистидина непосредственно для активации воды (тип панкреатической рибонуклеазы).
3. Гидролазы, использующие комплексы Zn 2+ или Со 2+ для активации воды и субстрата (тип щелочной фосфатазы, карбоксипептидазы А).
4. Гидролазы, использующие ионы Мg 2+ или Мn 2+ для активации воды и субстрата (тип пирофосфатазы).
Химотрипсин. В активный центр входят Ser-195, His-57, Asp-102.

Рис. 1.5.4. Структура химотрипсина
Лактатдегидрогеназа. Это NAD + -зависимая дегидрогеназа. Осуществляет обратимое окисление-восстановление органических молекул, при этом в качестве донора (акцептора) гидрид-иона выступает кофермент. Каталитически активные группы фермента представлены Arg-165, His-194, Arg-105. Все эти аминокислоты являются консервативными. Молочная или пировиноградная кислоты фиксируются в активном центре с помощью положительного заряда Arg-168. Участниками каталитического процесса являются протон-транспортная цепь His-194-Asp-165 и Arg-105.

Рис. 1.5.5. Структура лактатдегидрогеназы
(а) Схематическое изображение тетрамера и (b) - отдельной субъединицы; (с) Модель NAD + -связывающего региона. Никотинамидное кольцо NAD + связывается между цепями d и е, а адениновое кольцо – между а и b.
На рис. 1.5.6. приведены возможные типы связей, участвующих в присоединении NAD + в активном центре ЛДГ.

Рис. 1.5.6. Связывание NAD + лактатдегидрогеназой
Линии, показанные точками – водородные связи, перекрестные линии – электростатические взаимодействия, аминокислотные остатки в рамках – гидрофобные взаимодействия
Триозофосфатизомераза. Каталитически важные группировки активного центра фермента представлены Glu-165 и His-95.

Рис. 1.5.7. Структура субъединицы триозофосфатизомеразы дрожжей
Глицин, цистеин и пролин как структурообразующие аминокислоты
Глицин в силу особенностей его строения не участвует в химических актах активации молекул в каталитическом цикле. Не обладая заместителем у α-углеродного атома, глицин лишен выраженной химической функции. Тем не менее наличие глицина в структуре белка очень важно. Так, сайт-специфическая замена глицина в консервативных позициях на любую из аминокислот приводит, как правило, к полной потере (или существенному снижению) активности фермента.
По-видимому, глицин в консервативных позициях важен по следующим причинам.
1. Являясь уникальной аминокислотой с наиболее энергетически облегченным вращением вокруг связей С-N и С-С полипептидной цепи, глицин может играть роль узловой точки, обеспечивающей возможность изменения направления полипептидной цепи при «сборке» аминокислотных остатков в активный центр. Таким образом, наличие консервативных глицинов позволяет объяснить структурный парадокс ферментативного катализа, когда одинаковые активные центры «собираются» из абсолютно разных полипептидных цепей. Общим для этих цепей являются наличие глицина в консервативных позициях и возможность стабилизации собранной структуры, например, за счет дисульфидных связей (цистеин также проявляет высокую степень консервативности, занимая третью позицию в рейтинге консервативности).
2. Глицин в консервативных позициях может играть роль конформационных «шарниров», обеспечивая возможность «сборки» активного центра и известную конформационную подвижность. Подтверждением этому служит то, что во многих случаях вблизи каталитически активных групп можно обнаружить глицин в консервативных позициях. Например, для гидролаз различных семейств консервативными являются следующие мотивы: Asp-215-X-Gly-217 (пепсин); Asp-170-Xаа-Xаа-Gly-173 (термолизнн); Gly-173-Xаа-Ser-177 (трипсин); His-76-Gly-77, Ser-153-Xаа-Gly-155, Gly-175-Xаа-Asp-177 (липазы). Здесь Хаа ‒ произвольная аминокислота. Аминокислоты Asp, His, Ser в указанных ферментах входят в структуру активных центров.
Превращение исходного субстрата в конечные продукты в ферментативном катализе сопряжено с участием большого числа интермедиатов с отличной от исходного субстрата структурой. Глицины активного центра могут играть роль «релаксирующих» элементов, конформационно подстраивая активный центр для следующего элементарного акта.
Существенную роль в формировании архитектуры активного центра играют цистеин и пролин (соответственно 3-я и 4-я позиции в рейтинге консервативных аминокислот). Пролин, как известно, является уникальной аминокислотой, разворачивающей полипептидную цепь. Роль цистеина заключается в том, что необходимая конформация активного центра, складывающаяся из различных участков полипептидной цепи, фиксируется химической связью в виде дисульфидного мостика. Для многих ферментов это завершает формирование архитектуры активного центра.
Таким образом, активный центр состоит из ряда функциональных групп, определенным образом ориентированных в пространстве. Среди них различают группы, входящие в состав каталитического сайта активного центра, и группы, образующие сайт, обеспечивающий специфическое сродство, т.е. связывание субстрата ферментом – так называемый контактный или «якорный» участок. Это деление достаточно условно, поскольку взаимодействия в контактном участке фермента при образовании фермент-субстратного комплекса, оказывает существенное влияние на скорость и направление превращений в каталитическом участке.
1. Активный центр
— это относительно небольшой участок,
расположенный в узком гидрофобном углублении (щели) поверхности молекулы фермента, непосредственно участвующий в катализе.
2. Активные центры ферментов образуются на уровне третичной структуры.
3. Ферментативный катализ требует точной про-странственной организации больших ансамблей, построенных из аминокислотных остатков и их бо-ковых групп. Такие ансамбли формируют как ак-тивные, так и регуляторные (аллостерические) центры ферментов.
4. Активный центр, кроме каталитического участка, включает субстратсвязывающий участок, который от-вечает за специфическое комплементарное связыва-ние субстрата и образование фермент-субстратного комплекса (ES); в активный центр фермента часто входит участок или домен для связывания кофактора.
Пример 1. Активные центры ферментов форми-руются на уровне третичной структуры.
Сериновые протеазы широко распространены в природе и вместе с протеолитическими фермента-ми других классов (аспартильными, цистеиновыми и металлопротеиназами) обеспечивают расщепле-ние белков (катаболизм) и целый ряд реакций ог-раниченного протеолиза, имеющих регуляторное значение для жизни клетки.
Сериновые протеазы (к ним относятся трипсин, химотрипсин, эластаза, тромбин и др.) имеют од-нотипное строение каталитического центра, в ко-торый входит триада аминокислот: Асп, Гис и Сер.
В разных сериновых протеазах эти аминокисло-ты могут занимать разные места в пептидной цепи фермента, но они сближаются при свертывании полипептидной цепи и их относительное располо-жение в пространстве строго сохраняется (рис. 2.3).
5. Активный центр не может быть очерчен строго определенными границами, поскольку каждый его компонент так или иначе взаимодействует с други-ми участками молекулы фермента. Влияние мик-роокружения может быть весьма существенным: — компоненты активного центра, в том числе и ко-факторы, взаимодействуют с соседними группами фермента, что видоизменяет химические характерис-тики функциональных групп, участвующих в катализе;
|
|
- в клетке образуют структурные комплек-сы и ансамбли как друг с другом, так и с участками клеточных и внутриклеточных мембран, с элемен-тами цитоскелета и/или другими молекулами, что влияет на реакционную способность функциональных групп в активном центре фермента.
6. Структура активного центра определяет специ-фичность действия ферментов. Большинство фер-ментов высокоспецифично как к природе, так и к пути превращения субстрата.
7. Специфичность к субстрату обусловлена комплементарностью структуры субстратсвязывающего центра фермента структуре субстрата (рис. 2.4).
Как показывает рис. 2.4, субстратсвязывающий участок по форме соответствует субстрату (геометри-ческое соответствие), более того, между аминокис-лотными остатками активного центра фермента и субстратом образуются специфические связи (гид-рофобные, ионные и водородные), т.е. устанавлива-ется электронное или химическое соответствие.
Обратите внимание на то, что нековалентные свя-зи между субстратом и ферментом похожи по харак-теру на межрадикальные взаимодействия в белках.
Связывание субстрата с активным центром фер-мента происходит многоточечно, с участием не-скольких функциональных групп, которые далее мо-гут участвовать в катализе.
8. Ферменты могут различаться по субстратной специфичности и обладать абсолютной специфич-ностью, т.е. иметь только один субстрат и не взаи-модействовать даже с очень близкими по строению молекулами (например, уреаза ускоряет гидролиз мочевины, но не действует на тиомочевину), или даже стереоспецифичностью (когда фермент взаи-модействует с определенным оптическим и геомет-рическим изомером).
9. Некоторые ферменты проявляют более ши-рокую специфичность (групповая или относитель-ная специфичность) и взаимодействуют со многи-ми веществами, имеющими похожую структуру (протеазы ускоряют гидролиз пептидных связей в белках, липазы ускоряют рас-щепление эфирных связей в жирах).
Пример 2. Сери новые протеазы проявляют групповую специ-фичность к субстратам.
Все они ускоряют гидролиз пеп- тидных связей в белках, но, имея похожую структуру и каталитиче-ский механизм, различаются по субстратной специфичности.
На рис. 2.5 показаны субстрат-связывающие участки активных центров панкреатических фер-ментов, относящихся к группе сериновых протеаз: химотрипси на, трипсина и эластазы.|
|
В трипсине отрицательный заряд остатка аспа-рагиновой кислоты в активном центре участвует как в связывании аминогруппы лизина (или гуа-нидиновой группы аргинина), так и непосредст-венно в катализе, при котором разрывается пеп-тидная связь, в образовании которой участвует карбоксильная группа положительно заряженных остатков Лиз и Apr.
В эластазе остатки валина и треонина, входящие в состав субстратсвязывающего центра, допуска-ют связывание остатков аминокислот только с не-большими боковыми цепями, например, как у глицина. Поэтому эластаза ускоряет гидролиз пептидных связей, образованных карбоксильны-ми группами глицина и аланина.Изучение механизма химической реакции, катализируемой ферментом наряду с определением промежуточных и конечных продуктов на разных стадиях реакции подразумевает точное знание геометрии третичной структуры фермента, природы функциональных групп его молекулы, обеспечивающих специфичность действия и высокую каталитическую активность на данный субстрат, а также химической природы участка (участков) молекулы фермента, который обеспечивает высокую скорость каталитической реакции. Обычно молекулы субстрата, участвующие в ферментативных реакциях, по сравнению с молекулами ферментов имеют относительно небольшие размеры. Таким образом, при образовании фермент-субстратных комплексов в непосредственное химическое взаимодействие вступают лишь ограниченные фрагменты аминокислотной последовательности полипептидной цепи - «активный центр» - уникальная комбинация остатков аминокислот в молекуле фермента, обеспечивающая непосредственное взаимодействие с молекулой субстрата и прямое участие в акте катализа
В активном центре условно выделяют
каталитический центр - непосредственно химически взаимодействующий с субстратом;
связывающий центр (контактная или «якорная» площадка) - обеспечивающий специфическое сродство к субстрату и формирование комплекса фермент-субстрат.
Чтобы катализировать реакцию, фермент должен связаться с одним или несколькими субстратами. Белковая цепь фермента сворачивается таким образом, что на поверхности глобулы образуется щель, или впадина, где связываются субстраты. Эта область называется сайтом связывания субстрата. Обычно он совпадает с активным центром фермента или находится вблизи него. Некоторые ферменты содержат также сайты связывания кофакторов или ионов металлов.
Фермент, соединяясь с субстратом:
очищает субстрат от водяной «шубы»
располагает реагирующие молекулы субстратов в пространстве нужным для протекания реакции образом
подготавливает к реакции (например, поляризует) молекулы субстратов.
Обычно присоединение фермента к субстрату происходит за счет ионных или водородных связей, редко - за счет ковалентных. В конце реакции её продукт (или продукты) отделяются от фермента.
В результате фермент снижает энергию активации реакции. Это происходит потому, что в присутствии фермента реакция идет по другому пути (фактически происходит другая реакция), например:
В отсутствие фермента:
В присутствии фермента:
АФ+В = АВФ
АВФ = АВ+Ф
где А, В - субстраты, АВ - продукт реакции, Ф - фермент.
Ферменты не могут самостоятельно обеспечивать энергией эндергонические реакции (для протекания которых требуется энергия). Поэтому ферменты, осуществляющие такие реакции, сопрягают их с экзергоническими реакциями, идущими с выделением большего количества энергии. Например, реакции синтеза биополимеров часто сопрягаются с реакцией гидролиза АТФ.
Для активных центров некоторых ферментов характерно явление кооперативности.
Специфичность
Ферменты обычно проявляют высокую специфичность по отношению к своим субстратам (субстратная специфичность). Это достигается частичной комплементарностью формы, распределения зарядов и гидрофобных областей на молекуле субстрата и в центре связывания субстрата на ферменте. Ферменты обычно демонстрируют также высокий уровень стереоспецифичности (образуют в качестве продукта только один из возможных стереоизомеров или используют в качестве субстрата только один стереоизомер), региоселективности (образуют или разрывают химическую связь только в одном из возможных положений субстрата) и хемоселективности (катализируют только одну химическую реакцию из нескольких возможных для данных условий). Несмотря на общий высокий уровень специфичности, степень субстратной и реакционной специфичности ферментов может быть различной. Например, эндопептидаза трипсин разрывает пептидную связь только после аргинина или лизина, если за ними не следует пролин, а пепсин гораздо менее специфичен и может разрывать пептидную связь, следующую за многими аминокислотами.
Активный центр фермента - это участок, который связывает субстраты (и простетическую группу, если она есть) и в котором содержатся аминокислотные остатки, непосредственно участвующие в образовании или разрыве химических связей. Такие остатки называют каталитическими группами. Несмотря на огромное разнообразие структуры ферментов, их специфичности и механизма каталитического действия, все же можно сделать ряд обобщений в отношении свойств активных центров.
1. На активный центр приходится относительно малая часть общего объема фермента. Большая часть аминокислотных остатков в молекуле фермента не контактирует с субстратом. Остается загадкой,
Рис. 6.9. Скорость ферментативной реакции как функция концентрации субстрата.

Рис. 6.10. Взаимодействие субстратов с ферментами согласно модели ключ-замок. Активный центр фермента сам по себе комплементарен по форме субстрату.
почему размер ферментов так велик. Почти все ферменты содержат более 100 аминокислотных остатков и имеют массу свыше 10 к Да, а диаметр - свыше 25 А.
2. Активный центр - трехмерное образование. Другими словами, это не точка, не линия и даже не плоскость, а сложная трехмерная структура, в формировании которой участвуют группы, принадлежащие разным частям линейной последовательности аминокислот. Действительно, как мы уже видели на примере гемоглобина и миоглобина, взаимодействие между аминокислотными остатками, расположенными далеко друг от друга в линейной последовательности, нередко сильнее, чем взаимодействие между соседними (в последовательности) остатками аминокислот. В лизоциме - ферменте, который мы рассмотрим подробно в следующей главе, основные группы активного центра представлены аминокислотными остатками, занимающими 35, 52, 62, 63 и 101-е положения в линейной последовательности из 129 аминокислот.
3. Субстраты относительно слабо связываются с ферментами. Константы равновесия -комплексов обычно лежат в пределах от до что соответствует свободным энергиям взаимодействия от - 3 до - 12 ккал/моль. Сравним эти величины с силой ковалентных связей, составляющей от - 50 до - 110 ккал/моль.
4. Активный центр имеет форму узкого углубления или щели. Во всех ферментах с изученной структурой связывание субстратов происходит в таком углублении или щели, куда нет доступа воде, за исключением тех случаев, когда вода является одним из реагирующих веществ. В этом углублении присутствует несколько полярных аминокислотных остатков, необходимых для связывания и катализа. Неполярный характер всей области в целом способствует связыванию субстрата. Кроме того, щелевидная форма активного центра создает микроокружение, в котором отдельные полярные остатки приобретают особые свойства, существенно важные для катализа.
5. Специфичность связывания зависит от строго определенного расположения атомов в активном центре. Субстрат входит в активный центр, только если он соответствует ему по форме. В 1890 г. Эмиль Фишер (Е. Fischer) использовал сравнение с ключом и замком (рис. 6.10), которое оказалось по существу правильным и исключительно плодотворным представлением о стереоспецифичности катализа. Однако, как показывают работы последних лет, активные центры некоторых ферментов не являются жесткой структурой, их форма модифицируется при связывании субстратов. В этих ферментах форма активного центра становится комплементарной форме субстрата

Рис. 6.11. Взаимодействие субстратов с ферментами согласно модели индуцированного соответстия. При связывании субстрата происходит изменение формы фермента. Активный центр фермента только после присоединения субстрата становится комплементарным ему по форме.

Рис. 6.12. График зависимости скорости реакции V от концентрации субстрата для фермента, подчиняющегося кинетике Михаэлиса - Ментен (Ктах-максимальная скорость, - константа Михаэлиса).
только после связывания субстрата. Такой процесс динамического узнавания называют индукцией соответствия (рис. 6.11). Кроме того, некоторые ферменты предпочтительно связывают субстрат в напряженной («искаженной») форме, соответствующей переходному состоянию.