Периодический закон химических элементов - фундаментальный закон природы, отражающий периодическое изменение свойств химических элементов по мере увеличения зарядов ядер их атомов. Открыт 1 марта (17 февраля по ст. стилю) 1869 г. Д.И. Менделеевым. В этот день им была составлена таблица, названная «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Окончательная формулировка периодического закона была дана Менделеевым в июле 1871 г. Она гласила:
«Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса ».
Менделеевская формулировка периодического закона просуществовала в науке 40 с небольшим лет. Она была пересмотрена благодаря выдающимся достижениям физики, главным образом разработке ядерной модели атома (см. Атом). Оказалось, заряд ядра атома (Z) численно равен порядковому номеру соответствующего элемента в периодической системе, а заполнение электронных оболочек и подоболочек атомов в зависимости от Z происходит таким образом, что сходные электронные конфигурации атомов периодически повторяются (см. Периодическая система химических элементов). Поэтому современная формулировка периодического закона такова: свойства элементов, простых веществ и их соединений находятся в периодической зависимости от зарядов ядер атомов.
В отличие от других фундаментальных законов природы, например таких, как закон всемирного тяготения или закон эквивалентности массы и энергии, периодический закон не может быть записан в виде какого-либо общего уравнения или формулы. Его наглядным отражением является периодическая система элементов. Однако и сам Менделеев, и другие ученые делали попытки отыскать математическое уравнение периодического закона химических элементов
. Эти попытки увенчались успехом только после разработки теории строения атома. Но они касаются лишь установления количественной зависимости порядка распределения электронов в оболочках и подоболочках от зарядов ядер атомов.
Так, путем решения уравнения Шредингера можно рассчитать, как распределяются электроны в атомах с различными значениями Z. И поэтому основное уравнение квантовой механики как бы является одним из количественных выражений периодического закона.
Или, например, другое уравнение: Z„, = „+,Z - - (21 + 1)2 - >n,(2t + 1) +
1
+ т„где „+,Z = - (n + 1+ 1)" +
+(+1+ 1. 2к(п+О 1
2 2 6
Несмотря на свою громоздкость, оно не так уж и сложно. Буквы и, 1, т, и m,- это не что иное, как главное, орбитальное, магнитное и спиновое квантовые числа (см. Атом). Уравнение позволяет вычислить, при каком значении Z (порядкового номера элемента) в атоме появляется электрон, состояние которого описывается заданной комбинацией четырех квантовых чисел. Подставляя возможные сочетания и, 1, т, и т, в это уравнение, мы получаем набор различных значений Z. Если эти значения расположить в последовательности натурального ряда чисел 1, 2, 3, 4, 5, ..., то, в свою очередь, получается четкая схема построения электронных конфигураций атомов по мере роста Z. Таким образом, это уравнение - также своеобразное количественное выражение периодического закона. Попробуйте сами решить это уравнение для всех элементов периодической системы (как связаны между собой значения и, 1; m, и т„ вы узнаете из статьи Атом).
Периодический закон - это универсальный закон для всей Вселенной . Он имеет силу везде, где существуют атомы. Но периодически изменяются не только электронные структуры атомов. Строение и свойства атомных ядер также подчиняются своеобразному периодическому закону. В ядрах, состоящих из нейтронов и протонов, существуют нейтронные и протонные оболочки, заполнение которых имеет периодический характер. Известны даже попытки построения периодической системы атомных ядер.
Д.И. Менделеев сформулировал Периодический закон в 1869 году, в основе которого была одна из главнейших характеристик атома – атомная масса. Последующее развитие Периодического закона, а именно, получение большого экспериментальных данных, несколько изменило первоначальную формулировку закона, однако эти изменения не противоречат главному смыслу, заложенному Д.И. Менделеевым. Эти изменения только придали закону и Периодической системе научную обоснованность и подтверждение правильности.
Современная формулировка Периодического закона Д.И. Менделеева такова: свойства химических элементов, а также свойства и формы соединений элементов находятся в периодической зависимости от величины заряда ядер их атомов.
Структура Периодической системы химических элементов Д.И. Менделеева
К настоящему мнению известно большое количество интерпретаций Периодической системы, но наиболее популярная – с короткими (малыми) и длинными (большими) периодами. Горизонтальные ряды называют периодами (в них расположены элементы с последовательным заполнением одинакового энергетического уровня), а вертикальные столбцы – группами (в них расположены элементы, имеющие одинаковое количество валентных электронов – химические аналоги). Так же все элементы можно разделить на блоки по по типу внешней (валентной) орбитали: s-, p-, d-, f-элементы.
Всего в системе (таблице) 7 периодов, причем номер периода (обозначается арабской цифрой) равен числу электронных слоев в атоме элемента, номеру внешнего (валентного) энергетического уровня, значению главного квантового числа для высшего энергетического уровня. Каждый период (кроме первого) начинается s-элементом — активным щелочным металлом и заканчивается инертным газом, перед которым стоит p-элемент — активный неметалл (галоген). Если продвигаться по периоду слева направо, то с ростом заряда ядер атомов химических элементов малых периодов будет возрастать число электронов на внешнем энергетическом уровне, вследствие чего свойства элементов изменяются – от типично металлических (т.к. в начале периода стоит активный щелочной металл), через амфотерные (элемент проявляет свойства и металлов и неметаллов) до неметаллических (активный неметалл – галоген в конце периода), т.е. металлические свойства постепенно ослабевают и усиливаются неметаллические.
В больших периодах с ростом заряда ядер заполнение электронов происходит сложнее, что объясняет более сложное изменение свойств элементов по сравнению с элементами малых периодов. Так, в четных рядах больших периодов с ростом заряда ядра число электронов на внешнем энергетическом уровне остается постоянным и равным 2 или 1. Поэтому, пока идет заполнение электронами следующего за внешним (второго снаружи) уровня, свойства элементов в четных рядах изменяются медленно. При переходе к нечетным рядам, с ростом величины заряда ядра увеличивается число электронов на внешнем энергетическом уровне (от 1 до 8), свойства элементов изменяются также, как в малых периодах.
Вертикальные столбцы в Периодической системе – группы элементов со сходным электронным строением и являющимися химическими аналогами. Группы обозначают римскими цифрами от I до VIII. Выделяют главные (А) и побочные (B) подгруппы, первые из которых содержат s- и p-элементы, вторые – d – элементы.
Номер А подгруппы показывает число электронов на внешнем энергетическом уровне (число валентных электронов). Для элементов В-подгрупп нет прямой связи между номером группы и числом электронов на внешнем энергетическом уровне. В А-подгруппах металлические свойства элементов усиливаются, а неметаллические – уменьшаются с возрастанием заряда ядра атома элемента.
Между положением элементов в Периодической системе и строением их атомов существует взаимосвязь:
— атомы всех элементов одного периода имеют равное число энергетических уровней, частично или полностью заполненных электронами;
— атомы всех элементов А подгрупп имею равное число электронов на внешнем энергетическом уровне.
Периодические свойства элементов
Близость физико-химических и химических свойств атомов обусловлена сходством их электронных конфигураций, причем, главную роль играет распределение электронов по внешней атомной орбитали. Это проявляется в периодическом появлении, по мере увеличения заряда ядра атома, элементов с близкими свойствами. Такие свойства называют периодическими, среди которых наиболее важными являются:
1. Количество электронов на внешней электронной оболочке (заселенность – w ). В малых периодах с ростом заряда ядра w внешней электронной оболочки монотонно увеличивается от 1 до 2 (1 период), от 1 до 8 (2-й и 3-й периоды). В больших периодах на протяжении первых 12 элементов w не превышает 2, а затем до 8.
2. Атомный и ионный радиусы (r), определяемые как средние радиусы атома или иона, находимые из экспериментальных данных по межатомным расстояниям в разных соединениях. По периоду атомный радиус уменьшается (постепенно прибавляющиеся электроны описываются орбиталями с почти равными характеристиками, по группе атомный радиус возрастает, поскольку увеличивается число электронных слоев (рис.1.).
Рис. 1. Периодическое изменение атомного радиуса
Такие же закономерности наблюдаются и для ионного радиуса. Следует заметить, что ионный радиус катиона (положительно заряженный ион) больше атомного радиуса, а тот в свою очередь, больше ионного радиуса аниона (отрицательно заряженный ион).
3. Энергия ионизации (Е и) – количество энергии, необходимое для отрыва электрона от атома, т.е. энергия, необходимая для превращения нейтрального атома в положительно заряженный ион (катион).
Э 0 — → Э + + Е и
Е и измеряется в электронвольтах (эВ) на атом. В пределах группы Периодической системы значения энергии ионизации атомов уменьшаются с возрастанием зарядов ядер атомов элементов. От атомов химических элементов можно последовательно отрывать все электроны, сообщив дискретные значения Е и. При этом Е и 1 < Е и 2 < Е и 3 <….Энергии ионизации отражают дискретность структуры электронных слоев и оболочек атомов химических элементов.
4. Сродство к электрону (Е е) – количество энергии, выделяющееся при присоединении дополнительного электрона к атому, т.е. энергия процесса
Э 0 + → Э —
Е е также выражается в эВ и, как и Е и зависит от радиуса атома, поэтому характер изменения Е е по периодам и группам Периодической системы близок характеру изменения атомного радиуса. Наибольшим сродством к электрону обладают p-элементы VII группы.
5. Восстановительная активность (ВА) – способность атома отдавать электрон другому атому. Количественная мера – Е и. Если Е и увеличивается, то ВА уменьшается и наоборот.
6. Окислительная активность (ОА) – способность атома присоединять электрон от другого атома. Количественная мера Е е. Если Е е увеличивается, то ОА также увеличивается и наоборот.
7. Эффект экранирования – уменьшение воздействия на данный электрон положительного заряда ядра из-за наличия между ним и ядром других электронов. Экранирование растет с увеличением числа электронных слоев в атоме и уменьшает притяжение внешних электронов к ядру. Экранированию противоположен эффект проникновения , обусловленный тем, что электрон может находиться в любой точке атомного пространства. Эффект проникновения увеличивает прочность связи электрона с ядром.
8. Степень окисления (окислительное число) – воображаемый заряд атома элемента в соединении, который определяется из предположения ионного строения вещества. Номер группы Периодической системы указывает высшую положительную степень окисления, которую могут иметь элементы данной группы в своих соединениях. Исключение – металлы подгруппы меди, кислород, фтор, бром, металлы семейства железа и другие элементы VIII группы. С ростом заряда ядра в периоде максимальная положительная степень окисления растет.
9. Электроотрицательность, составы высших водородных и кислородных соединений, термодинамические, электролитические свойства и т.д.
Примеры решения задач
ПРИМЕР 1
| Задание | Охарактеризуйте элемент (Z=23) и свойства его соединений (оксидов и гидроксидов) по электронной формуле: семейство, период, группа, число валентных электронов, электронно-графическая формула для валентных электронов в основном и возбужденном состоянии, основные степени окисления (максимальная и минимальная), формулы оксидов и гидроксидов. |
| Решение |
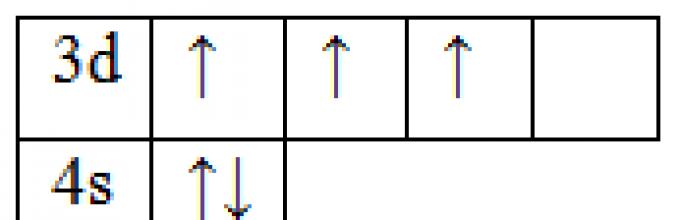
23 V 1s 2 2s 2 2p 6 3s 3 3p 6 3d 3 4s 2
d-элемент, металл, находится в ;-м периоде, в V группе, В подгруппе. Валентные электроны 3d 3 4s 2 . Оксиды VO, V 2 O 3 , VO 2 , V 2 O 5 . Гидроксиды V(OH) 2 , V(OH) 3 , VO(OH) 2 , HVO 3 . Основное состояние Возбужденное состояние Минимальная степень окисления «+2», максимальная – «+5». |
С первых уроков химии вы использовали таблицу Д. И. Менделеева. Она наглядно демонстрирует, что все химические элементы, образующие вещества окружающего нас мира, взаимосвязаны и подчиняются общим закономерностям, т. е. представляют собой единое целое - систему химических элементов. Поэтому в современной науке таблицу Д. И. Менделеева называют Периодической системой химических элементов.
Почему «периодической», вам тоже понятно, так как общие закономерности в изменении свойств атомов, простых и сложных веществ, образованных химическими элементами, повторяются в этой системе через определённые интервалы - периоды. Некоторые из этих закономерностей, приведённые в таблице 1, вам уже известны.
Таким образом, все существующие в мире химические элементы подчиняются единому, объективно действующему в природе Периодическому закону, графическим отображением которого и является Периодическая система элементов. Этот закон и система носят имя великого русского химика Д. И. Менделеева.
Д. И. Менделеев пришёл к открытию Периодического закона, проведя сопоставление свойств и относительных атомных масс химических элементов. Для этого Д. И. Менделеев для каждого химического элемента на карточке записал: символ элемента, значение относительной атомной массы (во времена Д. И. Менделеева эту величину называли атомным весом), формулы и характер высшего оксида и гидроксида. Он расположил 63 известных к тому времени химических элемента в одну цепочку в порядке возрастания их относительных атомных масс (рис. 1) и проанализировал эту совокупность элементов, пытаясь найти в ней определённые закономерности. В результате напряжённого творческого труда он обнаружил, что в этой цепочке имеются интервалы - периоды, в которых свойства элементов и образованных ими веществ изменяются сходным образом (рис. 2).
Рис. 1.
Карточки элементов, расположенные в порядке увеличения их относительных атомных масс

Рис. 2.
Карточки элементов, расположенные в порядке периодического изменения свойств элементов и образованных ими веществ
Лабораторный опыт № 2
Моделирование построения Периодической системы Д. И. Менделеева
|
Смоделируйте построение Периодической системы Д. И. Менделеева. Для этого подготовьте 20 карточек размером 6 х 10 см для элементов с порядковыми номерами с 1-го по 20-й. На каждой карточке укажите следующие сведения об элементе: химический символ, название, относительную атомную массу, формулу высшего оксида, гидроксида (в скобках укажите их характер - основный, кислотный или амфотерный), формулу летучего водородного соединения (для неметаллов).
Перемешайте карточки, а затем расположите их в ряд по возрастанию относительных атомных масс элементов. Сходные элементы с 1-го по 18-й расположите друг под другом: водород над литием и калий под натрием, соответственно, кальций под магнием, гелий под неоном. Сформулируйте выявленную вами закономерность в виде закона. Обратите внимание на несоответствие относительных атомных масс аргона и калия их расположению по общности свойств элементов. Объясните причину этого явления. |
Перечислим ещё раз, используя современные термины, закономерные изменения свойств, проявляемые в пределах периодов:
- металлические свойства ослабевают;
- неметаллические свойства усиливаются;
- степень окисления элементов в высших оксидах увеличивается от +1 до +8;
- степень окисления элементов в летучих водородных соединениях увеличивается от -4 до -1;
- оксиды от основных через амфотерные сменяются кислотными;
- гидроксиды от щелочей через амфотерные гидроксиды сменяются кислородсодержащими кислотами.
На основании этих наблюдений Д. И. Менделеев в 1869 г. сделал вывод - сформулировал Периодический закон, который с использованием современных терминов звучит так:
Систематизируя химические элементы на основе их относительных атомных масс, Д. И. Менделеев уделял большое внимание также свойствам элементов и образованных ими веществ, распределяя элементы со сходными свойствами в вертикальные столбцы - группы. Иногда в нарушение выявленной им закономерности он ставил более тяжёлые элементы перед элементами с меньшими значениями относительных атомных масс. Например, он записал в свою таблицу кобальт перед никелем, теллур - перед иодом, а когда были открыты инертные (благородные) газы, аргон - перед калием. Такой порядок расположения Д. И. Менделеев считал необходимым потому, что иначе эти элементы попали бы в группы несходных с ними по свойствам элементов. Так, в частности, щелочной металл калий попал бы в группу инертных газов, а инертный газ аргон - в группу щелочных металлов.
Д. И. Менделеев не мог объяснить эти исключения из общего правила, как и причину периодичности в изменении свойств элементов и образованных ими веществ. Однако он предвидел, что эта причина кроется в сложном строении атома. Именно научная интуиция Д. И. Менделеева позволила ему построить систему химических элементов не в порядке возрастания их относительных атомных масс, а в порядке возрастания зарядов их атомных ядер. О том, что свойства элементов определяются именно зарядами их атомных ядер, красноречиво говорит существование изотопов, с которыми вы знакомились в прошлом году (вспомните, что это такое, приведите примеры известных вам изотопов).
В соответствии с современными представлениями о строении атома основой классификации химических элементов являются заряды их атомных ядер, и современная формулировка Периодического закона такова:
Периодичность в изменении свойств элементов и их соединений объясняется периодической повторяемостью в строении внешних энергетических уровней их атомов. Именно число энергетических уровней, общее число расположенных на них электронов и число электронов на внешнем уровне отражают принятую в Периодической системе символику, т. е. раскрывают физический смысл порядкового номера элемента, номера периода и номера группы (в чём он состоит?).
Строение атома позволяет объяснить и причины изменения металлических и неметаллических свойств элементов в периодах и группах.
Следовательно, Периодический закон и Периодическая система Д. И. Менделеева обобщают сведения о химических элементах и образованных ими веществах и объясняют периодичность в изменении их свойств и причину сходства свойств элементов одной и той же группы.
Эти два важнейших значения Периодического закона и Периодической системы Д. И. Менделеева дополняет ещё одно, которое заключается в возможности прогнозировать, т. е. предсказывать, описывать свойства и указывать пути открытия новых химических элементов. Уже на этапе создания Периодической системы Д. И. Менделеев сделал ряд прогнозов о свойствах ещё не известных в то время элементов и указал пути их открытия. В созданной им таблице Д. И. Менделеев для этих элементов оставил пустые клеточки (рис. 3).

Рис. 3.
Периодическая таблица элементов, предложенная Д. И. Менделеевым
Яркими примерами прогностической силы Периодического закона явились последующие открытия элементов: в 1875 г. французом Лекоком де Буабодраном был открыт галлий, предсказанный Д. И. Менделеевым пятью годами раньше как элемент под названием «экаалюминий» (эка - следующий за); в 1879 г. шведом Л. Нильсоном был открыт «экабор» по Д. И. Менделееву; в 1886 г. немцем К. Винклером - «экасилиций» по Д. И. Менделееву (определите по таблице Д. И. Менделеева современные названия этих элементов). Насколько точен был в своих предсказаниях Д. И. Менделеев, иллюстрируют данные таблицы 2.
Таблица 2
Предсказанные и экспериментально обнаруженные свойства германия
|
Предсказано Д. И. Менделеевым в 1871 г. |
Установлено К. Винклером в 1886 г. |
|
Относительная атомная масса близка к 72 |
Относительная атомная масса 72,6 |
|
Серый тугоплавкий металл |
Серый тугоплавкий металл |
|
Плотность металла около 5,5 г/см 3 |
Плотность металла 5,35 г/см 3 |
|
Формула оксида Э0 2 |
Формула оксида Ge0 2 |
|
Плотность оксида около 4,7 г/см 3 |
Плотность оксида 4,7 г/см 3 |
|
Оксид будет довольно легко восстанавливаться до металла |
Оксид Ge0 2 восстанавливается до металла при нагревании в струе водорода |
|
Хлорид ЭС1 4 должен быть жидкостью с температурой кипения около 90 °С и плотностью около 1,9 г/см 3 |
Хлорид германия (IV) GeCl 4 представляет собой жидкость с температурой кипения 83 °С и плотностью 1,887 г/см 3 |
Учёные-первооткрыватели новых элементов высоко оценили открытие русского учёного: «Вряд ли может существовать более яркое доказательство справедливости учения о периодичности элементов, чем открытие до сих пор гипотетического экасилиция; оно составляет, конечно, более чем простое подтверждение смелой теории, - оно знаменует собой выдающееся расширение химического поля зрения, гигантский шаг в области познания» (К. Винклер).
Американские учёные, открывшие элемент № 101, дали ему название «менделевий» в знак признания заслуг великого русского химика Дмитрия Менделеева, который первым применил Периодическую систему элементов для предсказания свойств тогда ещё не открытых элементов.
Вы познакомились в 8 классе и будете пользоваться в этом году формой Периодической таблицы, которая называется короткопериодной. Однако в профильных классах и в высшей школе преимущественно используется другая форма - длиннопериодный вариант. Сравните их. Что общего и что различного в этих двух формах Периодической таблицы?
Новые слова и понятия
- Периодический закон Д. И. Менделеева.
- Периодическая система химических элементов Д. И. Менделеева - графическое отображение Периодического закона.
- Физический смысл номера элемента, номера периода и номера группы.
- Закономерности изменения свойств элементов в периодах и группах.
- Значение Периодического закона и Периодической системы химических элементов Д. И. Менделеева.
Задания для самостоятельной работы
- Докажите, что Периодический закон Д. И. Менделеева, как и любой другой закон природы, выполняет объясняющую, обобщающую и предсказательную функции. Приведите примеры, иллюстрирующие эти функции у других законов, известных вам из курсов химии, физики и биологии.
- Назовите химический элемент, в атоме которого электроны располагаются по уровням согласно ряду чисел: 2, 5. Какое простое вещество образует этот элемент? Какую формулу имеет его водородное соединение и как оно называется? Какую формулу имеет высший оксид этого элемента, каков его характер? Запишите уравнения реакций, характеризующих свойства этого оксида.
- Бериллий раньше относили к элементам III группы, и его относительная атомная масса считалась равной 13,5. Почему Д. И. Менделеев перенёс его во II группу и исправил атомную массу бериллия с 13,5 на 9?
- Напишите уравнения реакций между простым веществом, образованным химическим элементом, в атоме которого электроны распределены по энергетическим уровням согласно ряду чисел: 2, 8, 8, 2, и простыми веществами, образованными элементами № 7 и № 8 в Периодической системе. Каков тип химической связи в продуктах реакции? Какое кристаллическое строение имеют исходные простые вещества и продукты их взаимодействия?
- Расположите в порядке усиления металлических свойств следующие элементы: As, Sb, N, Р, Bi. Обоснуйте полученный ряд, исходя из строения атомов этих элементов.
- Расположите в порядке усиления неметаллических свойств следующие элементы: Si, Al, Р, S, Cl, Mg, Na. Обоснуйте полученный ряд, исходя из строения атомов этих элементов.
- Расположите в порядке ослабления кислотных свойств оксиды, формулы которых: SiO 2 , Р 2 O 5 , Аl 2 O 3 , Na 2 O, MgO, Сl 2 O 7 . Обоснуйте полученный ряд. Запишите формулы гидроксидов, соответствующих этим оксидам. Как изменяется их кислотный характер в предложенном вами ряду?
- Напишите формулы оксидов бора, бериллия и лития и расположите их в порядке возрастания основных свойств. Запишите формулы гидроксидов, соответствующих этим оксидам. Каков их химический характер?
- Что такое изотопы? Как открытие изотопов способствовало становлению Периодического закона?
- Почему заряды атомных ядер элементов в Периодической системе Д. И. Менделеева изменяются монотонно, т. е. заряд ядра каждого последующего элемента возрастает на единицу по сравнению с зарядом атомного ядра предыдущего элемента, а свойства элементов и образуемых ими веществ изменяются периодически?
- Приведите три формулировки Периодического закона, в которых за основу систематизации химических элементов взяты относительная атомная масса, заряд атомного ядра и строение внешних энергетических уровней в электронной оболочке атома.
Периодический закон Д.И.Менделеева, его современная формулировка. В чем её отличие от той, которая была дана Д.И.Менделеевым? Поясните, чем обусловлено такое изменение формулировки закона? В чем заключается физический смысл Периодического закона? Поясните причину периодического изменения свойств химических элементов. Как вы понимаете явление периодичности?
Периодический закон был сформулирован Д. И. Менделеевым в следующем виде (1871): «свойства простых тел, а также формы и свойства соединений элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является разработанная Менделеевым Периодическая система элементов.
Периодический закон универсален для Вселенной: как образно заметил известный русский химик Н. Д. Зелинский, Периодический закон явился «открытием взаимной связи всех атомов в мироздании».
В современном состоянии Периодическая система элементов состоит из 10 горизонтальных рядов (периодов) и 8 вертикальных столбцов (групп). Первые три ряда образуют три малых периода. Последующие периоды включают по два ряда. Кроме того, начиная с шестого, периоды включают дополнительные ряды лантаноидов (шестой период) и актиноидов (седьмой период).
По период наблюдается ослабление металлических свойств и усиление неметаллических. Конечный элемент периода представляет собой благородный газ. Каждый последующий период начинается со щелочного металла, т. е. по мере роста атомной массы элементов изменение химических свойств имеет периодический характер.
С развитием атомной физики и квантовой химии Периодический закон получил строгое теоретическое обоснование. Благодаря классическим работам Й. Ридберга (1897), А. Ван-ден-Брука (1911), Г. Мозли (1913) был раскрыт физический смысл порядкового (атомного) номера элемента. Позднее была создана квантово-механическая модель периодического изменения электронного строения атомов химических элементов по мере возрастания зарядов их ядер (Н. Бор, В. Паули, Э. Шрёдингер, В. Гейзенберг и др.).
Периодические свойства химических элементов
В принципе, свойства химического элемента объединяют все без исключения его характеристики в состоянии свободных атомов или ионов, гидратированных или сольватированных, в состоянии простого вещества, а также формы и свойства образуемых им многочисленных соединений. Но обычно под свойствами химического элемента подразумевают, во-первых, свойства его свободных атомов и, во-вторых, свойства простого вещества. Большинство этих свойств проявляет явную периодическую зависимость от атомных номеров химических элементов. Среди этих свойств наиболее важными, имеющими особое значение при объяснении или предсказании химического поведения элементов и образуемых ими соединений являются:
Энергия ионизации атомов;
Энергия сродства атомов к электрону;
Электроотрицательность;
Атомные (и ионные) радиусы;
Энергия атомизации простых веществ
Степени окисления;
Окислительные потенциалы простых веществ.
Физический смысл периодического закона состоит в том, что периодическое изменение свойств элементов находится в полном соответствии с периодически возобновляющимися на все более высоких энергетических уровнях сходными электронными структурами атомов. С их закономерным изменением закономерно изменяются физические и химические свойства.
Физический смысл периодического закона стал понятен после создания теории строения атома.
Итак, физический смысл периодического закона состоит в том, что периодическое изменение свойств элементов находится в полном соответствии с периодически возобновляющимися на все более высоких энергетических уровнях сходными электронными структурами атомов. С их закономерным изменением закономерно изменяются физические и химические свойства элементов.
В чем состоит физический смысл периодического закона.
Этими выводами вскрывается физический смысл периодического закона Д. И. Менделеева, который оставался неясным в течение полувека после открытия этого закона.
Отсюда следует, что физический смысл периодического закона Д. И. Менделеева состоит в периодичности повторения сходных электронных конфигураций при возрастании главного квантового числа и объединении элементов по близости их электронного строения.
Теория строения атомов показала, что физический смысл периодического закона состоит в том, что при последовательном возрастании зарядов ядер периодически повторяются сходные валентные электронные структуры атомов.
Из всего изложенного ясно, что теория строения атома раскрыла физический смысл периодического закона Д. И. Менделеева и еще ярче выявила его значение как основы для дальнейшего развития химии, физики и ряда других наук.
Замена атомной массы зарядом ядра была первым шагом в раскрытии физического смысла периодического закона, Далее, было важно установить причины возникновения периодичности, характер периодической функции зависимости свойств от заряда ядра, объяснить величины периодов, число редкоземельных элементов и пр.
Для элементов-аналогов наблюдается одинаковое число электронов на одноименных оболочках при разных значениях главного квантового числа. Поэтому физический смысл Периодического закона заключается в периодическом изменении свойств элементов в результате периодически возобновляющихся сходных электронных оболочек атомов при последовательном возрастании значений главного квантового числа.
Для элементов - аналогов наблюдается одинаковое число электронов на одноименных орбиталях при разных значениях главного квантового числа. Поэтому физический смысл Периодического закона заключается в периодическом изменении свойств элементов в результате периодически возобновляющихся сходных электронных оболочек атомов при последовательном возрастании значений главного квантового числа.
Таким образом, при последовательном увеличении зарядов атомных ядер периодически повторяется конфигурация электронных оболочек и, как следствие, периодически повторяются химические свойства элементов. В этом заключается физический смысл периодического закона.
Периодический закон Д. И. Менделеева является основой современной химии. Изучение строения атомов вскрывает физический смысл периодического закона и объясняет закономерности изменения свойств элементов в периодах и в группах периодической системы. Знание строения атомов является необходимым для понимания причин образования химической связи. Природа химической связи в молекулах определяет свойства веществ. Поэтому данный раздел является одним из важнейших разделов общей химии.
естествознание периодический экосистема
: как образно заметил известный русский химик Н. Д. Зелинский , Периодический закон явился «открытием взаимной связи всех атомов в мироздании».
История
Поиски основы естественной классификации и систематизации химических элементов начались задолго до открытия Периодического закона. Трудности, с которыми сталкивались естествоиспытатели, которые первыми работали в этой области, были вызваны недостаточностью экспериментальных данных: в начале XIX века число известных химических элементов было мало, а принятые значения атомных масс многих элементов неверны.
Триады Дёберейнера и первые системы элементов
В начале 60-х годов XIX века появилось сразу несколько работ, которые непосредственно предшествовали Периодическому закону.
Спираль де Шанкуртуа
Октавы Ньюлендса
Таблица Ньюлендса (1866)
Вскоре после спирали де Шанкуртуа английский учёный Джон Ньюлендс сделал попытку сопоставить химические свойства элементов с их атомными массами . Расположив элементы в порядке возрастания их атомных масс, Ньюлендс заметил, что сходство в свойствах проявляется между каждым восьмым элементом. Найденную закономерность Ньюлендс назвал законом октав по аналогии с семью интервалами музыкальной гаммы. В своей таблице он располагал химические элементы в вертикальные группы по семь элементов в каждой и при этом обнаружил, что (при небольшом изменении порядка некоторых элементов) сходные по химическим свойствам элементы оказываются на одной горизонтальной линии.
Джон Ньюлендс, безусловно, первым дал ряд элементов, расположенных в порядке возрастания атомных масс, присвоил химическим элементам соответствующий порядковый номер и заметил систематическое соотношение между этим порядком и физико-химическими свойствами элементов. Он писал, что в такой последовательности повторяются свойства элементов, эквивалентные веса (массы) которых отличаются на 7 единиц, или на значение, кратное 7, т. е. как будто бы восьмой по порядку элемент повторяет свойства первого, как в музыке восьмая нота повторяет первую. Ньюлендс пытался придать этой зависимости, действительно имеющей место для лёгких элементов, всеобщий характер. В его таблице в горизонтальных рядах располагались сходные элементы, однако в том же ряду часто оказывались и элементы совершенно отличные по свойствам. Кроме того, в некоторых ячейках Ньюлендс вынужден был разместить по два элемента; наконец, таблица не содержала свободных мест; в итоге закон октав был принят чрезвычайно скептически.
Таблицы Одлинга и Мейера
Проявления периодического закона в отношении энергии сродства к электрону
Периодичность значений энергий сродства атомов к электрону объясняется, естественно, теми же самыми факторами, которые уже были отмечены при обсуждении ионизационных потенциалов (см. определение энергии сродства к электрону).
Наибольшим сродством к электрону обладают p -элементы VII группы. Наименьшее сродство к электрону у атомов с конфигурацией s² ( , , ) и s²p 6 ( , ) или с наполовину заполненными p -орбиталями ( , , ) :
Проявления периодического закона в отношении электроотрицательности
Строго говоря, элементу нельзя приписать постоянную электроотрицательность . Электроотрицательность атома зависит от многих факторов, в частности от валентного состояния атома, формальной степени окисления, координационного числа, природы лигандов , составляющих окружение атома в молекулярной системе, и от некоторых других. В последнее время все чаще для характеристики электроотрицательности используют так называемую орбитальную электроотрицательность, зависящую от типа атомной орбитали, участвующей в образовании связи, и от её электронной заселенности, т. е. от того, занята атомная орбиталь неподелённой электронной парой, однократно заселена неспаренным электроном или является вакантной. Но, несмотря на известные трудности в интерпретации и определении электроотрицательности, она всегда остается необходимой для качественного описания и предсказания природы связей в молекулярной системе, включая энергию связи, распределение электронного заряда и степень ионности, силовую постоянную и т. д.
Периодичность атомной электроотрицательности является важной составной частью периодического закона и легко может быть объяснена, исходя из непреложной, хотя и не совсем однозначной, зависимости значений электроотрицательности от соответствующих значений энергий ионизации и сродства к электрону .
В периодах наблюдается общая тенденция роста электроотрицательности, а в подгруппах - её падение. Наименьшая электроотрицательность у s-элементов I группы, наибольшая - у p-элементов VII группы.
Проявления периодического закона в отношении атомных и ионных радиусов
Рис. 4 Зависимость орбитальных радиусов атомов от порядкового номера элемента.
Периодический характер изменения размеров атомов и ионов известен давно. Сложность здесь состоит в том, что из-за волновой природы электронного движения атомы не имеют строго определенных размеров. Так как непосредственное определение абсолютных размеров (радиусов) изолированных атомов невозможно, в данном случае часто используют их эмпирические значения. Их получают из измеренных межъядерных расстояний в кристаллах и свободных молекулах, разбивая каждое межъядерное расстояние на две части и приравнивая одну из них к радиусу первого (из двух связанных соответствующей химической связью) атома, а другую - к радиусу второго атома. При таком разделении учитывают различные факторы, включая природу химической связи, степени окисления двух связанных атомов, характер координации каждого из них и т. д . Таким способом получают так называемые металлические, ковалентные, ионные и ван-дер-ваальсовы радиусы. Ван-дер-ваальсовы радиусы следует рассматривать как радиусы несвязанных атомов; их находят по межъядерным расстояниям в твердых или жидких веществах, где атомы находятся в непосредственной близости друг от друга (например, атомы в твердом аргоне или атомы из двух соседних молекул N 2 в твердом азоте), но не связаны между собой какой-либо химической связью.
Но, очевидно, лучшим описанием эффективных размеров изолированного атома является теоретически рассчитанное положение (расстояние от ядра) главного максимума зарядовой плотности его наружных электронов . Это так называемый орбитальный радиус атома. Периодичность в изменении значений орбитальных атомных радиусов в зависимости от порядкового номера элемента проявляется довольно отчетливо (см. рис. 4), и основные моменты здесь состоят в наличии очень ярко выраженных максимумов, приходящихся на атомы щелочных металлов, и таких же минимумов, отвечающих благородным газам. Уменьшение значений орбитальных атомных радиусов при переходе от щелочного металла к соответствующему (ближайшему) благородному газу носит, за исключением ряда - , немонотонный характер, особенно при появлении между щелочным металлом и благородным газом семейств переходных элементов (металлов) и лантаноидов или актиноидов . В больших периодах в семействах d- и f- элементов наблюдается менее резкое уменьшение радиусов, так как заполнение орбиталей электронами происходит в пред- предвнешнем слое. В подгруппах элементов радиусы атомов и однотипных ионов в общем увеличиваются.
Проявления периодического закона в отношении энергии атомизации
Следует подчеркнуть, что степень окисления элемента, будучи формальной характеристикой, не дает представления ни об эффективных зарядах атомов этого элемента в соединении, ни о валентности атомов, хотя степень окисления часто называют формальной валентностью. Многие элементы способны проявлять не одну, а несколько различных степеней окисления. Например, для хлора известны все степени окисления от −1 до +7, хотя четные очень неустойчивы, а для марганца - от +2 до +7. Высшие значения степени окисления изменяются в зависимости от порядкового номера элемента периодически, но эта периодичность имеет сложный характер. В простейшем случае в ряду элементов от щелочного металла до благородного газа высшая степень окисления возрастает от +1 ( F) до +8 ( О 4). В других случаях высшая степень окисления благородного газа оказывается меньше ( +4 F 4), чем для предшествующего галогена ( +7 О 4 −). Поэтому на кривой периодической зависимости высшей, степени окисления от порядкового номера элемента максимумы приходятся или на благородный газ, или на предшествующий ему галоген (минимумы - всегда на щелочной металл). Исключение составляет ряд - , в котором ни для галогена (), ни для благородного газа () вообще неизвестны высокие степени окисления, а наибольшим значением высшей степени окисления обладает средний член ряда - азот; поэтому в ряду - изменение высшей степени окисления оказывается проходящим через максимум. В общем случае возрастание высшей степени окисления в ряду элементов от щелочного металла до галогена или до благородного газа происходит отнюдь не монотонно, главным образом по причине проявления высоких степеней окисления переходными металлами. Например, возрастание высшей степени окисления в ряду - от +1 до +8 «осложняется» тем, что для молибдена, технеция и рутения известны такие высокие степени окисления, как +6 ( О 3), +7 ( 2 О 7), +8 ( O 4).
Проявления периодического закона в отношении окислительного потенциала
Одной из очень важных характеристик простого вещества является его окислительный потенциал , отражающий принципиальную способность простого вещества к взаимодействию с водными растворами, а также проявляемые им окислительно-восстановительные свойства . Изменение окислительных потенциалов простых веществ в зависимости от порядкового номера элемента также носит периодический характер. Но при этом следует иметь в виду, что на окислительный потенциал простого вещества оказывают влияние различные факторы, которые иногда нужно рассматривать индивидуально. Поэтому периодичность в изменении окислительных потенциалов следует интерпретировать очень осторожно.
| /Na + (aq) | /Mg 2+ (aq) | /Al 3+ (aq) |
| 2,71В | 2,37В | 1,66В |
| /K + (aq) | /Ca 2+ (aq) | /Sc 3+ (aq) |
| 2,93В | 2,87В | 2,08В |
Можно обнаружить некоторые определенные последовательности в изменении окислительных потенциалов простых веществ. В частности, в ряду металлов при переходе от щелочного к следующим за ним элементам происходит уменьшение окислительных потенциалов ( + (aq) и т. д. - гидратированный катион):
Это легко объясняется увеличением энергии ионизации атомов с увеличением числа удаляемых валентных электронов. Поэтому на кривой зависимости окислительных потенциалов простых веществ от порядкового номера элемента имеются максимумы, отвечающие щелочным металлам. Но это не единственная причина изменения окислительных потенциалов простых веществ.
Внутренняя и вторичная периодичность
s - и р -элементы
Выше рассмотрены общие тенденции в характере изменения значений энергии ионизации атомов , энергии сродства атомов к электрону , электроотрицательности , атомных и ионных радиусов, энергии атомизации простых веществ, степени окисления , окислительных потенциалов простых веществ от атомного номера элемента. При более глубоком изучении этих тенденций можно обнаружить, что закономерности в изменении свойств элементов в периодах и группах значительно сложнее. В характере изменения свойств элементов по периоду проявляется внутренняя периодичность, а по группе - вторичная периодичность (открыта Е. В. Бироном в 1915 году).
Так, при переходе от s-элемента I группы к р -элементу VIII группы на кривой энергии ионизации атомов и кривой изменения их радиусов имеются внутренние максимумы и минимумы (см. рис. 1, 2, 4).
Это свидетельствует о внутреннепериодическом характере изменения этих свойств по периоду. Объяснение отмеченных закономерностей можно дать с помощью представления об экранировании ядра.
Эффект экранирования ядра обусловлен электронами внутренних слоев, которые, заслоняя ядро, ослабляют притяжение к нему внешнего электрона. Так, при переходе от бериллия 4 к бору 5 , несмотря на увеличение заряда ядра, энергия ионизации атомов уменьшается:
Рис. 5 Схема строения последних уровней бериллия, 9.32 эВ (слева) и бора, 8,29 эВ (справа)
Это объясняется тем, что притяжение к ядру 2р -электрона атома бора ослаблено за счет экранирующего действия 2s -электронов.
Понятно, что экранирование ядра возрастает с увеличением числа внутренних электронных слоев. Поэтому в подгруппах s - и р -элементов наблюдается тенденция к уменьшению энергии ионизации атомов (см. рис. 1).
Уменьшение энергии ионизации от азота 7 N к кислороду 8 О (см. рис. 1) объясняется взаимным отталкиванием двух электронов одной и той же орбитали:
Рис. 6 Схема строения последних уровней азота, 14,53 эВ (слева) и кислорода, 13,62 эВ (справа)
Эффектом экранирования и взаимного отталкивания электронов одной орбитали объясняется также внутреннепериодический характер изменения по периоду атомных радиусов (см. рис. 4).
Рис. 7 Вторичнопериодическая зависимость радиусов атомов внешних p-орбиталей от атомного номера
Рис. 8 Вторичнопериодическая зависимость первой энергии ионизации атомов от атомного номера
Рис. 9 Радиальное распределение электронной плотности в атоме натрия
В характере изменения свойств s - и р -элементов в подгруппах отчетливо наблюдается вторичная периодичность (рис. 7). Для её объяснения привлекается представление о проникновении электронов к ядру. Как показано на рисунке 9, электрон любой орбитали определенное время находится в области, близкой к ядру. Иными словами, внешние электроны проникают к ядру через слои внутренних электронов. Как видно из рисунка 9, внешний 3s -электрон атома натрия обладает весьма значительной вероятностью находиться вблизи ядра в области внутренних К - и L -электронных слоев.
Концентрация электронной плотности (степень проникновения электронов) при одном и том же главном квантовом числе наибольшая для s -электрона, меньше - для р -электрона, ещё меньше - для d -электрона и т. д. Например, при n = 3 степень проникновения убывает в последовательности 3s >3p >3d (см. рис. 10).
Рис. 10 Радиальное распределение вероятности нахождения электрона (электронной плотности) на расстоянии r от ядра
Понятно, что эффект проникновения увеличивает прочность связи внешних электронов с ядром. Вследствие более глубокого проникновения s -электроны в большей степени экранируют ядро, чем р -электроны, а последние - сильнее, чем d -электроны, и т. д.
Пользуясь представлением о проникновении электронов к ядру, рассмотрим характер изменения радиуса атомов элементов в подгруппе углерода. В ряду - - - - проявляется общая тенденция увеличения радиуса атома (см. рис. 4, 7). Однако это увеличение имеет немонотонный характер. При переходе от Si к Ge внешние р -электроны проникают через экран из десяти 3d -электро-нов и тем самым упрочняют связь с ядром и сжимают электронную оболочку атома. Уменьшение размера 6p -орбитали Pb по сравнению с 5р -орбиталью Sn обусловлено проникновением 6p -электронов под двойной экран десяти 5d -электронов и четырнадцати 4f -электронов. Этим же объясняется немонотонность в изменении энергии ионизации атомов в ряду C-Pb и большее значение её для Pb по сравнению с атомом Sn (см. рис. 1).
d -Элементы
Во внешнем слое у атомов d -элементов (за исключением ) находятся 1-2 электрона (ns -состояние). Остальные валентные электроны расположены в (n-1)d -состоянии, т. е. в предвнешнем слое.
Подобное строение электронных оболочек атомов определяет некоторые общие свойства d -элементов . Так, их атомы характеризуются сравнительно невысокими значениями первой энергии ионизации. Как видно на рисунке 1, при этом характер изменения энергии ионизации атомов по периоду в ряду d -элементов более плавный, чем в ряду s - и p -элементов. При переходе от d -элемента III группы к d -элементу II группы значения энергии ионизации изменяются немонотонно. Так, на участке кривой (рис. 1) видны две площадки, соответствующие энергии ионизации атомов, в которых заполняются Зd -орбитали по одному и по два электрона. Заполнение 3d -орбиталей по одному электрону заканчивается у (3d 5 4s 2), что отмечается некоторым повышением относительной устойчивости 4s 2 -конфигурации за счет проникновения 4s 2 -электронов под экран 3d 5 -конфигурации. Наибольшее значение энергии ионизации имеет (3d 10 4s 2), что находится в соответствии с полным завершением Зd -подслоя и стабилизацией электронной пары за счет проникновения под экран 3d 10 -конфигурации.
В подгруппах d -элементов значения энергии ионизации атомов в общем увеличиваются. Это можно объяснить эффектом проникновения электронов к ядру. Так, если у d -элементов 4-го периода внешние 4s -электроны проникают под экран 3d -электронов, то у элементов 6-го периода внешние 6s -электроны проникают уже под двойной экран 5d - и 4f -электронов. Например:
| 22 Ti …3d 2 4s 2 | I = 6,82 эВ |
| 40 Zr …3d 10 4s 2 4p 6 4d 2 5s 2 | I = 6,84 эВ |
| 72 Hf… 4d 10 4f 14 5s 2 5p 6 5d 2 6s 2 | I = 7,5 эВ |
Поэтому у d -элементов 6-го периода внешние бs -электроны связаны с ядром более прочно и, следовательно, энергия ионизации атомов больше, чем у d -элементов 4-го периода.
Размеры атомов d -элементов являются промежуточными между размерами атомов s - и p -элементов данного периода. Изменение радиусов их атомов по периоду более плавное, чем для s - и p -элементов.
В подгруппах d -элементов радиусы атомов в общем увеличиваются. Важно отметить следующую особенность: увеличение атомных и ионных радиусов в подгруппах d -элементов в основном отвечает переходу от элемента 4-го к элементу 5-го периода. Соответствующие же радиусы атомов d -элементов 5-го и 6-го периодов данной подгруппы примерно одинаковы. Это объясняется тем, что увеличение радиусов за счет возрастания числа электронных слоев при переходе от 5-го к 6-му периоду компенсируется f -сжатием, вызванным заполнением электронами 4f -подслоя у f -элементов 6-го периода. В этом случае f -сжатие называется лантаноидным . При аналогичных электронных конфигурациях внешних слоев и примерно одинаковых размерах атомов и ионов для d -элементов 5-го и 6-го периодов данной подгруппы характерна особая близость свойств.
Отмеченным закономерностям не подчиняются элементы подгруппы скандия. Для этой подгруппы типичны закономерности, характерные для соседних подгрупп s -элементов.
Периодический закон - основа химической систематики
См. также
Примечания
Литература
- Ахметов Н. С. Актуальные вопросы курса неорганической химии. - М.: Просвещение, 1991. - 224 с - ISBN 5-09-002630-0
- Корольков Д. В. Основы неорганической химии. - М.: Просвещение, 1982. - 271 с.
- Менделеев Д. И. Основы химии, т. 2. М.: Госхимиздат, 1947. 389 c.
- Менделеев Д.И. // Энциклопедический словарь Брокгауза и Ефрона : В 86 томах (82 т. и 4 доп.). - СПб. , 1890-1907.