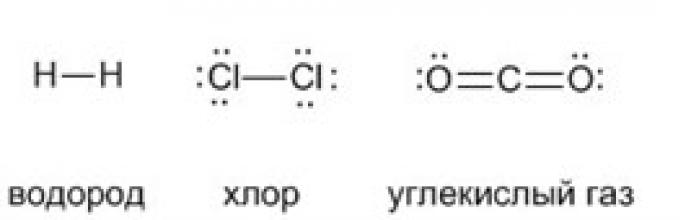На уроках химии вы уже познакомились с понятием валентности химических элементов. Мы собрали в одном месте всю полезную информацию по этому вопросу. Используйте ее, когда будете готовиться к ГИА и ЕГЭ.
Валентность и химический анализ
Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами.
С латыни слово «валентность» переводится как «сила, способность». Очень верное название, правда?
Понятие «валентность» - одно из основных в химии. Было введено еще до того, как ученым стало известно строение атома (в далеком 1853 году). Поэтому по мере изучения строения атома пережило некоторые изменения.
Так, с точки зрения электронной теории валентность напрямую связана с числом внешних электронов атома элемента. Это значит, что под «валентностью» подразумевают число электронных пар, которыми атом связан с другими атомами.
Зная это, ученые смогли описать природу химической связи. Она заключается в том, что пара атомов вещества делит между собой пару валентных электронов.
Вы спросите, как же химики 19 века смогли описать валентность еще тогда, когда считали, что мельче атома частиц не бывает? Нельзя сказать, что это было так уж просто – они опирались на химический анализ.
Путем химического анализа ученые прошлого определяли состав химического соединения: сколько атомов различных элементов содержится в молекуле рассматриваемого вещества. Для этого нужно было определить, какова точная масса каждого элемента в образце чистого (без примесей) вещества.
Правда, метод этот не без изъянов. Потому что определить подобным образом валентность элемента можно только в его простом соединении со всегда одновалентным водородом (гидрид) или всегда двухвалентным кислородом (оксид). К примеру, валентность азота в NH 3 – III, поскольку один атом водорода связан с тремя атомами азота. А валентность углерода в метане (СН 4), по тому же принципу, – IV.
Этот метод для определения валентности годится только для простых веществ. А вот в кислотах таким образом мы можем только определить валентность соединений вроде кислотных остатков, но не всех элементов (кроме известной нам валентности водорода) по отдельности.
Как вы уже обратили внимание, обозначается валентность римскими цифрами.
Валентность и кислоты
Поскольку валентность водорода остается неизменной и хорошо вам известна, вы легко сможете определить и валентность кислотного остатка. Так, к примеру, в H 2 SO 3 валентность SO 3 – I, в HСlO 3 валентность СlO 3 – I.
Аналогчиным образом, если известна валентность кислотного остатка, несложно записать правильную формулу кислоты: NO 2 (I) – HNO 2 , S 4 O 6 (II) – H 2 S 4 O 6 .
Валентность и формулы
Понятие валентности имеет смысл только для веществ молекулярной природы и не слишком подходит для описания химических связей в соединениях кластерной, ионной, кристаллической природы и т.п.
Индексы в молекулярных формулах веществ отражают количество атомов элементов, которые входят в их состав. Правильно расставить индексы помогает знание валентности элементов. Таким же образом, глядя на молекулярную формулу и индексы, вы можете назвать валентности входящих в состав элементов.
Вы выполняете такие задания на уроках химии в школе. Например, имея химическую формулу вещества, в котором известна валентность одного из элементов, можно легко определить валентность другого элемента.
Для этого нужно только запомнить, что в веществе молекулярной природы число валентностей обоих элементов равны. Поэтому используйте наименьшее общее кратное (соответсвует числу свободных валентностей, необходимых для соединения), чтобы определить неизвестную вам валентность элемента.
Чтобы было понятно, возьмем формулу оксида железа Fe 2 O 3 . Здесь в образовании химической связи участвуют два атома железа с валентностью III и 3 атома кислорода с валентностью II. Наименьшим общим кратным для них является 6.
- Пример: у вас есть формулы Mn 2 O 7 . Вам известна валентность кислорода, легко вычислить, что наименьше общее кратное – 14, откуда валентность Mn – VII.
Аналогичным образом можно поступить и наоборот: записать правильную химическую формулу вещества, зная валентности входящих в него элементов.
- Пример: чтобы правильно записать формулу оксида фосфора, учтем валентность кислорода (II) и фосфора (V). Значит, наименьшее общее кратное для Р и О – 10. Следовательно, формула имеет следующий вид: Р 2 О 5 .
Хорошо зная свойства элементов, которые они проявляют в различных соединениях, можно определить их валентность даже по внешнему виду таких соединений.
Например: оксиды меди имеют красную (Cu 2 O) и черную (CuО) окраску. Гидроксиды меди окрашены в желтый (CuОН) и синий (Cu(ОН) 2) цвета.
А чтобы ковалентные связи в веществах стали для вас более наглядными и понятными, напишите их структурные формулы. Черточки между элементами изображают возникающие между их атомами связи (валентности):

Характеристики валентности
Сегодня определение валентности элементов базируется на знаниях о строении внешних электронных оболочек их атомов.
Валентность может быть:
- постоянной (металлы главных подгрупп);
- переменной (неметаллы и металлы побочных групп):
- высшая валентность;
- низшая валентность.
Постоянной в различных химических соединениях остается:
- валентность водорода, натрия, калия, фтора (I);
- валентность кислорода, магния, кальция, цинка (II);
- валентность алюминия (III).
А вот валентность железа и меди, брома и хлора, а также многих других элементов изменяется, когда они образуют различные химические соедения.
Валентность и электронная теория
В рамках электронной теории валентность атома определеяется на основании числа непарных электронов, которые участвуют в образовании электронных пар с электронами других атомов.
В образовании химических связей участвуют только электроны, находящиеся на внешней оболочке атома. Поэтому максимальная валентность химического элемента – это число электронов во внешней электронной оболочке его атома.
Понятие валентности тесно связано с Периодическим законом, открытым Д. И. Менделеевым. Если вы внимательно посмотрите на таблицу Менделеева, легко сможете заметить: положение элемента в перодической системе и его валентность неравзрывно связаны. Высшая валентность элементов, которые относятся к одной и тоже группе, соответсвует порядковому номеру группы в периодичнеской системе.
Низшую валентность вы узнаете, когда от числа групп в таблице Менделеева (их восемь) отнимете номер группы элемента, который вас интересует.
Например, валентность многих металлов совпадает с номерами групп в таблице периодических элементов, к которым они относятся.
Таблица валентности химических элементов
|
Порядковый номер хим. элемента (атомный номер) |
Наименование |
Химический символ |
Валентность |
| 1 | Водород / Hydrogen Гелий / Helium Литий / Lithium Бериллий / Beryllium Углерод / Carbon Азот / Nitrogen Кислород / Oxygen Фтор / Fluorine Неон / Neon Натрий / Sodium Магний / Magnesium Алюминий / Aluminum Кремний / Silicon Фосфор / Phosphorus Сера / Sulfur Хлор / Chlorine Аргон / Argon Калий / Potassium Кальций / Calcium Скандий / Scandium Титан / Titanium Ванадий / Vanadium Хром / Chromium Марганец / Manganese Железо / Iron Кобальт / Cobalt Никель / Nickel Медь / Copper Цинк / Zinc Галлий / Gallium Германий /Germanium Мышьяк / Arsenic Селен / Selenium Бром / Bromine Криптон / Krypton Рубидий / Rubidium Стронций / Strontium Иттрий / Yttrium Цирконий / Zirconium Ниобий / Niobium Молибден / Molybdenum Технеций / Technetium Рутений / Ruthenium Родий / Rhodium Палладий / Palladium Серебро / Silver Кадмий / Cadmium Индий / Indium Олово / Tin Сурьма / Antimony Теллур / Tellurium Иод / Iodine Ксенон / Xenon Цезий / Cesium Барий / Barium Лантан / Lanthanum Церий / Cerium Празеодим / Praseodymium Неодим / Neodymium Прометий / Promethium Самарий / Samarium Европий / Europium Гадолиний / Gadolinium Тербий / Terbium Диспрозий / Dysprosium Гольмий / Holmium Эрбий / Erbium Тулий / Thulium Иттербий / Ytterbium Лютеций / Lutetium Гафний / Hafnium Тантал / Tantalum Вольфрам / Tungsten Рений / Rhenium Осмий / Osmium Иридий / Iridium Платина / Platinum Золото / Gold Ртуть / Mercury Талий / Thallium Свинец / Lead Висмут / Bismuth Полоний / Polonium Астат / Astatine Радон / Radon Франций / Francium Радий / Radium Актиний / Actinium Торий / Thorium Проактиний / Protactinium Уран / Uranium |
H | I (I), II, III, IV, V I, (II), III, (IV), V, VII II, (III), IV, VI, VII II, III, (IV), VI (I), II, (III), (IV) I, (III), (IV), V (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) I, (III), (IV), V, VII (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI (II), III, (IV), (V) Нет данных Нет данных (II), III, IV, (V), VI |
В скобках даны те валентности, которые обладающие ими элементы проявляют редко.
Валентность и степень окисления
Так, говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность – это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю.
Интересно, что для атома одного и того же элемента, в зависимости от элементов, с которыми он образует химическое соединение, валентность и степень окисления могут совпадать (Н 2 О, СН 4 и др.) и различаться (Н 2 О 2 , HNO 3).
Заключение
Углубляя свои знания о строении атомов, вы глубже и подробнее узнаете и валентность. Эта характеристика химических элементов не является исчерпывающей. Но у нее большое прикладное значение. В чем вы сами не раз убедились, решая задачи и проводя химические опыты на уроках.
Эта статья создана, чтобы помочь вам систематизировать свои знания о валентности. А также напомнить, как можно ее определить и где валентность находит применение.
Надеемся, этот материал окажется для вас полезным при подготовке домашних заданий и самоподготовке к контрольным и экзаменам.
blog.сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
На уроках химии вы уже познакомились с понятием валентности химических элементов. Мы собрали в одном месте всю полезную информацию по этому вопросу. Используйте ее, когда будете готовиться к ГИА и ЕГЭ.
Валентность и химический анализ
Валентность – способность атомов химических элементов вступать в химические соединения с атомами других элементов. Другими словами, это способность атома образовывать определенное число химических связей с другими атомами.
С латыни слово «валентность» переводится как «сила, способность». Очень верное название, правда?
Понятие «валентность» - одно из основных в химии. Было введено еще до того, как ученым стало известно строение атома (в далеком 1853 году). Поэтому по мере изучения строения атома пережило некоторые изменения.
Так, с точки зрения электронной теории валентность напрямую связана с числом внешних электронов атома элемента. Это значит, что под «валентностью» подразумевают число электронных пар, которыми атом связан с другими атомами.
Зная это, ученые смогли описать природу химической связи. Она заключается в том, что пара атомов вещества делит между собой пару валентных электронов.
Вы спросите, как же химики 19 века смогли описать валентность еще тогда, когда считали, что мельче атома частиц не бывает? Нельзя сказать, что это было так уж просто – они опирались на химический анализ.
Путем химического анализа ученые прошлого определяли состав химического соединения: сколько атомов различных элементов содержится в молекуле рассматриваемого вещества. Для этого нужно было определить, какова точная масса каждого элемента в образце чистого (без примесей) вещества.
Правда, метод этот не без изъянов. Потому что определить подобным образом валентность элемента можно только в его простом соединении со всегда одновалентным водородом (гидрид) или всегда двухвалентным кислородом (оксид). К примеру, валентность азота в NH 3 – III, поскольку один атом водорода связан с тремя атомами азота. А валентность углерода в метане (СН 4), по тому же принципу, – IV.
Этот метод для определения валентности годится только для простых веществ. А вот в кислотах таким образом мы можем только определить валентность соединений вроде кислотных остатков, но не всех элементов (кроме известной нам валентности водорода) по отдельности.
Как вы уже обратили внимание, обозначается валентность римскими цифрами.
Валентность и кислоты
Поскольку валентность водорода остается неизменной и хорошо вам известна, вы легко сможете определить и валентность кислотного остатка. Так, к примеру, в H 2 SO 3 валентность SO 3 – I, в HСlO 3 валентность СlO 3 – I.
Аналогчиным образом, если известна валентность кислотного остатка, несложно записать правильную формулу кислоты: NO 2 (I) – HNO 2 , S 4 O 6 (II) – H 2 S 4 O 6 .
Валентность и формулы
Понятие валентности имеет смысл только для веществ молекулярной природы и не слишком подходит для описания химических связей в соединениях кластерной, ионной, кристаллической природы и т.п.
Индексы в молекулярных формулах веществ отражают количество атомов элементов, которые входят в их состав. Правильно расставить индексы помогает знание валентности элементов. Таким же образом, глядя на молекулярную формулу и индексы, вы можете назвать валентности входящих в состав элементов.
Вы выполняете такие задания на уроках химии в школе. Например, имея химическую формулу вещества, в котором известна валентность одного из элементов, можно легко определить валентность другого элемента.
Для этого нужно только запомнить, что в веществе молекулярной природы число валентностей обоих элементов равны. Поэтому используйте наименьшее общее кратное (соответсвует числу свободных валентностей, необходимых для соединения), чтобы определить неизвестную вам валентность элемента.
Чтобы было понятно, возьмем формулу оксида железа Fe 2 O 3 . Здесь в образовании химической связи участвуют два атома железа с валентностью III и 3 атома кислорода с валентностью II. Наименьшим общим кратным для них является 6.
- Пример: у вас есть формулы Mn 2 O 7 . Вам известна валентность кислорода, легко вычислить, что наименьше общее кратное – 14, откуда валентность Mn – VII.
Аналогичным образом можно поступить и наоборот: записать правильную химическую формулу вещества, зная валентности входящих в него элементов.
- Пример: чтобы правильно записать формулу оксида фосфора, учтем валентность кислорода (II) и фосфора (V). Значит, наименьшее общее кратное для Р и О – 10. Следовательно, формула имеет следующий вид: Р 2 О 5 .
Хорошо зная свойства элементов, которые они проявляют в различных соединениях, можно определить их валентность даже по внешнему виду таких соединений.
Например: оксиды меди имеют красную (Cu 2 O) и черную (CuО) окраску. Гидроксиды меди окрашены в желтый (CuОН) и синий (Cu(ОН) 2) цвета.
А чтобы ковалентные связи в веществах стали для вас более наглядными и понятными, напишите их структурные формулы. Черточки между элементами изображают возникающие между их атомами связи (валентности):

Характеристики валентности
Сегодня определение валентности элементов базируется на знаниях о строении внешних электронных оболочек их атомов.
Валентность может быть:
- постоянной (металлы главных подгрупп);
- переменной (неметаллы и металлы побочных групп):
- высшая валентность;
- низшая валентность.
Постоянной в различных химических соединениях остается:
- валентность водорода, натрия, калия, фтора (I);
- валентность кислорода, магния, кальция, цинка (II);
- валентность алюминия (III).
А вот валентность железа и меди, брома и хлора, а также многих других элементов изменяется, когда они образуют различные химические соедения.
Валентность и электронная теория
В рамках электронной теории валентность атома определеяется на основании числа непарных электронов, которые участвуют в образовании электронных пар с электронами других атомов.
В образовании химических связей участвуют только электроны, находящиеся на внешней оболочке атома. Поэтому максимальная валентность химического элемента – это число электронов во внешней электронной оболочке его атома.
Понятие валентности тесно связано с Периодическим законом, открытым Д. И. Менделеевым. Если вы внимательно посмотрите на таблицу Менделеева, легко сможете заметить: положение элемента в перодической системе и его валентность неравзрывно связаны. Высшая валентность элементов, которые относятся к одной и тоже группе, соответсвует порядковому номеру группы в периодичнеской системе.
Низшую валентность вы узнаете, когда от числа групп в таблице Менделеева (их восемь) отнимете номер группы элемента, который вас интересует.
Например, валентность многих металлов совпадает с номерами групп в таблице периодических элементов, к которым они относятся.
Таблица валентности химических элементов
|
Порядковый номер хим. элемента (атомный номер) |
Наименование |
Химический символ |
Валентность |
| 1 | Водород / Hydrogen Гелий / Helium Литий / Lithium Бериллий / Beryllium Углерод / Carbon Азот / Nitrogen Кислород / Oxygen Фтор / Fluorine Неон / Neon Натрий / Sodium Магний / Magnesium Алюминий / Aluminum Кремний / Silicon Фосфор / Phosphorus Сера / Sulfur Хлор / Chlorine Аргон / Argon Калий / Potassium Кальций / Calcium Скандий / Scandium Титан / Titanium Ванадий / Vanadium Хром / Chromium Марганец / Manganese Железо / Iron Кобальт / Cobalt Никель / Nickel Медь / Copper Цинк / Zinc Галлий / Gallium Германий /Germanium Мышьяк / Arsenic Селен / Selenium Бром / Bromine Криптон / Krypton Рубидий / Rubidium Стронций / Strontium Иттрий / Yttrium Цирконий / Zirconium Ниобий / Niobium Молибден / Molybdenum Технеций / Technetium Рутений / Ruthenium Родий / Rhodium Палладий / Palladium Серебро / Silver Кадмий / Cadmium Индий / Indium Олово / Tin Сурьма / Antimony Теллур / Tellurium Иод / Iodine Ксенон / Xenon Цезий / Cesium Барий / Barium Лантан / Lanthanum Церий / Cerium Празеодим / Praseodymium Неодим / Neodymium Прометий / Promethium Самарий / Samarium Европий / Europium Гадолиний / Gadolinium Тербий / Terbium Диспрозий / Dysprosium Гольмий / Holmium Эрбий / Erbium Тулий / Thulium Иттербий / Ytterbium Лютеций / Lutetium Гафний / Hafnium Тантал / Tantalum Вольфрам / Tungsten Рений / Rhenium Осмий / Osmium Иридий / Iridium Платина / Platinum Золото / Gold Ртуть / Mercury Талий / Thallium Свинец / Lead Висмут / Bismuth Полоний / Polonium Астат / Astatine Радон / Radon Франций / Francium Радий / Radium Актиний / Actinium Торий / Thorium Проактиний / Protactinium Уран / Uranium |
H | I (I), II, III, IV, V I, (II), III, (IV), V, VII II, (III), IV, VI, VII II, III, (IV), VI (I), II, (III), (IV) I, (III), (IV), V (II), (III), IV (II), III, (IV), V (II), III, (IV), (V), VI (II), III, IV, (VI), (VII), VIII (II), (III), IV, (VI) I, (III), (IV), V, VII (II), (III), (IV), (V), VI (I), II, (III), IV, (V), VI, VII (II), III, IV, VI, VIII (I), (II), III, IV, VI (I), II, (III), IV, VI (II), III, (IV), (V) Нет данных Нет данных (II), III, IV, (V), VI |
В скобках даны те валентности, которые обладающие ими элементы проявляют редко.
Валентность и степень окисления
Так, говоря о степени окисления, подразумевают, что атом в веществе ионной (что важно) природы имеет некий условный заряд. И если валентность – это нейтральная характеристика, то степень окисления может быть отрицательной, положительной или равной нулю.
Интересно, что для атома одного и того же элемента, в зависимости от элементов, с которыми он образует химическое соединение, валентность и степень окисления могут совпадать (Н 2 О, СН 4 и др.) и различаться (Н 2 О 2 , HNO 3).
Заключение
Углубляя свои знания о строении атомов, вы глубже и подробнее узнаете и валентность. Эта характеристика химических элементов не является исчерпывающей. Но у нее большое прикладное значение. В чем вы сами не раз убедились, решая задачи и проводя химические опыты на уроках.
Эта статья создана, чтобы помочь вам систематизировать свои знания о валентности. А также напомнить, как можно ее определить и где валентность находит применение.
Надеемся, этот материал окажется для вас полезным при подготовке домашних заданий и самоподготовке к контрольным и экзаменам.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Рассматривая формулы различных соединений, нетрудно заметить, что число атомов одного и того же элемента в молекулах различных веществ не одинаково. Например, HCl, NH 4 Cl, H 2 S, H 3 PO 4 и т.д. Число атомов водорода в этих соединениях изменяется от 1 до 4. Это характерно не только для водорода.
Как же угадать, какой индекс поставить рядом с обозначением химического элемента? Как составляются формулы вещества? Это легко сделать, когда знаешь валентность элементов, входящих в состав молекулы данного вещества.
– это свойство атома данного элемента присоединять, удерживать или замещать в химических реакциях определённое количество атомов другого элемента. За единицу валентности принята валентность атома водорода. Поэтому иногда определение валентности формулируют так: валентность – это свойство атома данного элемента присоединять или замещать определённое количество атомов водорода.
Если к одному атому данного элемента прикрепляется один атом водорода, то элемент одновалентен, если два – двухвалентен и т.д. Водородные соединения известны не для всех элементов, но почти все элементы образуют соединения с кислородом О. Кислород считается постоянно двухвалентным.
Постоянная валентность:
I –
H, Na, Li, K, Rb, Cs
II –
O, Be, Mg, Ca, Sr, Ba, Ra, Zn, Cd
III –
B, Al, Ga, In
Но как поступить в том случае, если элемент не соединяется с водородом? Тогда валентность необходимого элемента определяют по валентности известного элемента. Чаще всего её находят, используя валентность кислорода, потому что в соединениях его валентность всегда равно 2. Например, не составит труда найти валентность элементов в следующих соединениях: Na 2 O (валентность Na – 1, O – 2), Al 2 O 3 (валентность Al – 3, O – 2).
Химическую формулу данного вещества можно составить, только зная валентность элементов. Например, составить формулы таких соединений, как CaO, BaO, CO, просто, потому что число атомов в молекулах одинаково, так как валентности элементов равны.
А если валентности разные? Когда мы действуем в таком случае? Необходимо запомнить следующее правило: в формуле любого химического соединения произведение валентности одного элемента на число его атомов в молекуле равно произведению валентности на число атомов другого элемента. Например, если известно, что валентность Mn в соединении равна 7, а O – 2, тогда формула соединения будет выглядеть так Mn 2 O 7.
 Как же мы получили формулу?
Как же мы получили формулу?
Рассмотрим алгоритм составления формул по валентности для состоящих из двух химических элементов.
Существует правило, что число валентностей у одного химического элемента равно числу валентностей у другого
. Рассмотрим на примере образования молекулы, состоящей из марганца и кислорода.
Будем составлять в соответствии с алгоритмом:
1. Записываем рядом символы химических элементов:
2.
Ставим над химическими элементами цифрами их валентности (валентность химического элемента можно найти в таблице периодической системы Менделева, у марганца –
7, у кислорода –
2.
3. Находим наименьшее общее кратное (наименьшее число, которое делится без остатка на 7 и на 2). Это число 14. Делим его на валентности элементов 14: 7 = 2, 14: 2 = 7, 2 и 7 будут индексами, соответственно у фосфора и кислорода. Подставляем индексы.
Зная валентность одного химического элемента, следуя правилу: валентность одного элемента × число его атомов в молекуле = валентность другого элемента × число атомов этого (другого) элемента, можно определить валентность другого.
Mn 2 O 7 (7 · 2 = 2 · 7).
Понятие о валентности было введено в химию до того, как стало известно строение атома. Сейчас установлено, что это свойство элемента связано с числом внешних электронов. Для многих элементов максимальная валентность вытекает из положения этих элементов в периодической системе.
Остались вопросы? Хотите знать больше о валентности?
Чтобы получить помощь репетитора – зарегистрируйтесь .
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Как определять валентность химических элементов? С этим вопросом сталкивается каждый, кто только начинает знакомиться с химией. Сначала выясним, что же это такое. Валентность можно рассматривать как свойство атомов одного элемента удерживать определенное количество атомов другого элемента.
Элементы с постоянной и переменной валентностью
Например, из формулы Н-О-Н видно, что каждый атом Н соединен только с одним атомом (в данном случае с кислородом). Отсюда следует, что его валентность равна 1. Атом О в молекуле воды связан с двумя одновалентными атомами Н, значит он двухвалентен. Значения валентностей записывают римскими цифрами над символами элементов:
Валентности водорода и кислорода постоянны. Впрочем, для кислорода существуют и исключения. Например, в ионе гидроксония Н3О+ кислород трехвалентен. Существуют и другие элементы с постоянной валентностью.
- Li, Na, K, F – одновалентны;
- Be, Mg, Ca, Sr, Ba, Cd, Zn – обладают валентностью, равной II;
- Al, B – трехвалентны.
Теперь определим валентность серы в соединениях H2S, SO2 и SO3.
В первом случае один атом серы связан с двумя одновалентными атомами Н, значит его валентность равна двум. Во втором примере на один атом серы приходится два атома кислорода, который, как известно, двухвалентен. Получаем валентность серы, равную IV. В третьем случае один атом S присоединяет три атома О, значит, валентность серы равна VI (валентность атомов одного элемента помноженная на их количество).
Как видим, сера может быть двух-, четырёх- и шестивалентной:

Про такие элементы говорят, что они обладают переменной валентностью.
Правила определения валентностей
- Максимальная валентность для атомов данного элемента совпадает с номером группы, в которой он находится в Периодической системе. Например, для Са это 2, для серы – 6, для хлора – 7. Исключений из этого правила тоже немало:
-элемент 6 группы, О, имеет валентность II (в H3O+ – III);
-одновалентен F (вместо 7);
-двух- и трехвалентно обычно железо, элемент VIII группы;
-N может удержать возле себя только 4 атома, а не 5, как следует из номера группы;
-одно- и двухвалентна медь, расположенная в I группе. - Минимальное значение валентности для элементов, у которых она переменная, определяется по формуле: № группы в ПС – 8. Так, низшая валентность серы 8 – 6 = 2, фтора и других галогенов – (8 – 7) = 1, азота и фосфора – (8 – 5)= 3 и так далее.
- В соединении сумма единиц валентности атомов одного элемента должна соответствовать суммарной валентности другого.
- В молекуле воды Н-О-Н валентность Н равна I, таких атомов 2, значит, всего единиц валентности у водорода 2 (1×2=2). Такое же значение имеет и валентность кислорода.
- В соединении, состоящем из атомов двух видов, элемент, расположенный на втором месте, обладает низшей валентностью.
- Валентность кислотного остатка совпадает с количеством атомов Н в формуле кислоты, валентность группы OH равна I.
- В соединении, образованном атомами трех элементов, тот атом, который находится в середине формулы, называют центральным. Непосредственно с ним связаны атомы О, а с кислородом образуют связи остальные атомы.
Используем эти правила для выполнения заданий.
», «препарат ». Использование в рамках современного определения зафиксировано в 1884 году (нем. Valenz ). В 1789 году Уильям Хиггинс опубликовал работу, в которой высказал предположение о существовании связей между мельчайшими частицами вещества.
Однако точное и позже полностью подтверждённое понимание феномена валентности было предложено в 1852 году химиком Эдуардом Франклендом в работе, в которой он собрал и переосмыслил все существовавшие на тот момент теории и предположения на этот счёт. . Наблюдая способность к насыщению разных металлов и сравнивая состав органических производных металлов с составом неорганических соединений, Франкленд ввёл понятие о «соединительной силе », положив этим основание учению о валентности. Хотя Франкленд и установил некоторые частные закономерности, его идеи не получили развития.
Решающую роль в создании теории валентности сыграл Фридрих Август Кекуле . В 1857 г. он показал, что углерод является четырёхосновным (четырёхатомным) элементом, и его простейшим соединением является метан СН 4 . Уверенный в истинности своих представлений о валентности атомов, Кекуле ввёл их в свой учебник органической химии: основность, по мнению автора - фундаментальное свойство атома, свойство такое же постоянное и неизменяемое, как и атомный вес . В 1858 г. взгляды, почти совпадающие с идеями Кекуле, высказал в статье «О новой химической теории » Арчибальд Скотт Купер .
Уже три года спустя, в сентябре 1861 г. А. М. Бутлеров внёс в теорию валентности важнейшие дополнения. Он провёл чёткое различие между свободным атомом и атомом, вступившим в соединение с другим, когда его сродство «связывается и переходит в новую форму ». Бутлеров ввёл представление о полноте использования сил сродства и о «напряжении сродства », то есть энергетической неэквивалентности связей, которая обусловлена взаимным влиянием атомов в молекуле. В результате этого взаимного влияния атомы в зависимости от их структурного окружения приобретают различное «химическое значение ». Теория Бутлерова позволила дать объяснение многим экспериментальным фактам, касавшимся изомерии органических соединений и их реакционной способности.
Огромным достоинством теории валентности явилась возможность наглядного изображения молекулы. В 1860-х гг. появились первые молекулярные модели. Уже в 1864 г. А. Браун предложил использовать структурные формулы в виде окружностей с помещёнными в них символами элементов, соединённых линиями, обозначающими химическую связь между атомами; количество линий соответствовало валентности атома. В 1865 г. А. фон Гофман продемонстрировал первые шаростержневые модели, в которых роль атомов играли крокетные шары. В 1866 г. в учебнике Кекуле появились рисунки стереохимических моделей , в которых атом углерода имел тетраэдрическую конфигурацию.
Современные представления о валентности
С момента возникновения теории химической связи понятие «валентность» претерпело существенную эволюцию. В настоящее время оно не имеет строгого научного толкования, поэтому практически полностью вытеснено из научной лексики и используется, преимущественно, в методических целях.
В основном, под валентностью химических элементов понимается способность свободных его атомов к образованию определённого числа ковалентных связей . В соединениях с ковалентными связями валентность атомов определяется числом образовавшихся двухэлектронных двухцентровых связей. Именно такой подход принят в теории локализованных валентных связей , предложенной в 1927 году В. Гайтлером и Ф. Лондоном в 1927 г. Очевидно, что если в атоме имеется n неспаренных электронов и m неподелённых электронных пар, то этот атом может образовывать n + m ковалентных связей с другими атомами . При оценке максимальной валентности следует исходить из электронной конфигурации гипотетического, т. н. «возбуждённого» (валентного) состояния. Например, максимальная валентность атома бериллия, бора и азота равна 4 (например, в Be(OH) 4 2- , BF 4 - и NH 4 +), фосфора - 5 (PCl 5), серы - 6 (H 2 SO 4), хлора - 7 (Cl 2 O 7).
В ряде случаев, с валентностью отождествляются такие характеристики молекулярной системы как степень окисления элемента, эффективный заряд на атоме, координационное число атома и т. д. Эти характеристики могут быть близки и даже совпадать количественно, но ни коим образом не тождественны друг другу . Например, в изоэлектронных молекулах азота N 2 , монооксида углерода CO и цианид-ионе CN - реализуется тройная связь (то есть валентность каждого атома равна 3), однако степень окисления элементов равна, соответственно, 0, +2, −2, +2 и −3. В молекуле этана (см. рис.) углерод четырёхвалентен, как и в большинстве органических соединений, тогда как степень окисления формально равна −3.
Особенно это справедливо для молекул с делокализованными химическими связями, например в азотной кислоте степень окисления азота равна +5, тогда как азот не может иметь валентность выше 4. Известное из многих школьных учебников правило - «Максимальная валентность элемента численно равна номеру группы в Периодической таблице» - относится исключительно к степени окисления. Понятия «постоянной валентности» и «переменной валентности» также преимущественно относятся к степени окисления.
См. также
Примечания
Ссылки
- Угай Я. А. Валентность, химическая связь и степень окисления - важнейшие понятия химии // Соросовский образовательный журнал . - 1997. - № 3. - С. 53-57.
- / Левченков С. И. Краткий очерк истории химии
Литература
- Л. Паулинг Природа химической связи. М., Л.: Гос. НТИ хим. литературы, 1947.
- Картмелл, Фоулс. Валентность и строение молекул. М.: Химия, 1979. 360 с.]
- Коулсон Ч. Валентность. М.: Мир, 1965.
- Маррел Дж., Кеттл С., Теддер Дж. Теория валентности. Пер. с англ. М.: Мир. 1968.
- Развитие учения о валентности. Под ред. Кузнецова В. И. М.: Химия, 1977. 248с.
- Валентность атомов в молекулах / Корольков Д. В. Основы неорганической химии. - М.: Просвещение, 1982. - С. 126.
Wikimedia Foundation . 2010 .
Синонимы :Смотреть что такое "Валентность" в других словарях:
ВАЛЕНТНОСТЬ, мера «соединительной способности» химического элемента, равная числу индивидуальных ХИМИЧЕСКИХ СВЯЗЕЙ, которые может образовать один АТОМ. Валентность атома определяется числом ЭЛЕКТРОНОВ на самом верхнем (валентном) уровне (внешней… … Научно-технический энциклопедический словарь
ВАЛЕНТНОСТЬ - (от лат. valere иметь значение), или атомность, число атомов водорода или эквивалентных ему атомов или радикалов, к рое может присоединить данный атом или радикал. В. является одной из основ распределения элементов в периодической системе Д. И.… … Большая медицинская энциклопедия
Валентность - * валентнасць * valence термин происходит от лат. имеющий силу. 1. В химии это способность атомов химических элементов образовывать определенное число химических связей с атомами др. элементов. В свете строения атома В. это способность атомов… … Генетика. Энциклопедический словарь
- (от лат. valentia сила) в физике число, показывающее, со сколькими атомами водорода может соединяться данный атом или замещать их. В психологии валентность есть идущее из Англии обозначение для побуждающей способности. Философский… … Философская энциклопедия
Атомность Словарь русских синонимов. валентность сущ., кол во синонимов: 1 атомность (1) Словарь синонимов ASIS. В.Н. Тришин … Словарь синонимов
ВАЛЕНТНОСТЬ - (от лат. valentia – крепкий, прочный, влиятельный). Способность слова к грамматическому сочетанию с другими словами в предложении (например, у глаголов валентность определяет способность сочетаться с подлежащим, прямым или косвенным дополнением) … Новый словарь методических терминов и понятий (теория и практика обучения языкам)
- (от латинского valentia сила), способность атома химического элемента присоединять или замещать определенное число других атомов или атомных групп с образованием химической связи … Современная энциклопедия
- (от лат. valentia сила) способность атома химического элемента (или атомной группы) образовывать определенное число химических связей с другими атомами (или атомными группами). Вместо валентности часто пользуются более узкими понятиями, напр.… … Большой Энциклопедический словарь