Для того чтобы составить схему гальванического элемента, необходимо понять принцип его действий, особенности строения.
Потребители редко обращают внимание на аккумуляторы и батарейки, при этом именно эти источники тока являются самыми востребованными.
Химические источники тока
Что собой представляет гальванический элемент? Схема его основывается на электролите. В устройство входит небольшой контейнер, где располагается электролит, адсорбируемый материалом сепаратора. Кроме того, схема двух гальванических элементов предполагает наличие Как называется такой гальванический элемент? Схема, связывающая между собой два металла, предполагает наличие окислительно-восстановительной реакции.

Простейший гальванический элемент
Он подразумевает наличие двух пластин либо стержней, выполненных из разных металлов, которые погружены в раствор сильного электролита. В процессе работы данного гальванического элемента, на аноде осуществляется процесс окисления, связанный с отдачей электронов.
На катоде - восстановление, сопровождающееся принятием отрицательных частиц. Происходит передача электронов по внешней цепи к окислителю от восстановителя.
Пример гальванического элемента
Для того чтобы составить электронные схемы гальванических элементов, необходимо знать величину их стандартного электродного потенциала. Проанализируем вариант медно-цинкового гальванического элемента, функционирующего на основе энергии, выделяющейся при взаимодействии сульфата меди с цинком.
Этот гальванический элемент, схема которого будет приведена ниже, называют элементом Якоби-Даниэля. Он включает в себя которая погружена в раствор медного купороса (медный электрод), а также он состоит из цинковой пластины, находящейся в растворе его сульфата (цинковый электрод). Растворы соприкасаются между собой, но для того, чтобы не допускать их смешивания, в элементе используется перегородка, выполненная из пористого материала.

Принцип действия
Как функционирует гальванический элемент, схема которого имеет вид Zn ½ ZnSO4 ½½ CuSO4 ½ Cu? Во время его работы, когда замкнута электрическая цепь, происходит процесс окисления металлического цинка.
На его поверхности соприкосновения с раствором соли наблюдается превращение атомов в катионы Zn2+. Процесс сопровождается выделением «свободных» электронов, которые передвигаются по внешней цепи.
Реакцию, протекающую на цинковом электроде, можно представить в следующем виде:
Восстановление катионов металла осуществляется на медном электроде. Отрицательные частицы, которые попадают сюда с цинкового электрода, объединяются с катионами меди, осаждая их в виде металла. Данный процесс имеет следующий вид:
Если сложить две реакции, рассмотренные выше, получается суммарное уравнение, описывающее работы цинково-медного гальванического элемента.
В качестве анода выступает цинковый электрод, катодом служит медь. Современные гальванические элементы и аккумуляторы предполагают применение одного раствора электролита, что расширяет сферы их применения, делает их эксплуатацию более комфортной и удобной.

Разновидности гальванических элементов
Самыми распространенными считают угольно-цинковые элементы. В них применяется пассивный угольный коллектор тока, контактирующий с анодом, в качестве которого выступает оксид марганца (4). Электролитом является хлорид аммония, применяемый в пастообразном виде.
Он не растекается, поэтому сам гальванический элемент называют сухим. Его особенностью является возможность «восстанавливаться» на протяжении работы, что позитивно отражается на продолжительности их эксплуатационного периода. Такие гальванические элементы имеют невысокую стоимость, но невысокую мощность. При понижении температуры они снижают свою эффективность, а при ее повышении происходит постепенное высыхание электролита.
Щелочные элементы предполагают использование раствора щелочи, поэтому имеют довольно много областей применения.
В литиевых элементах в качестве анода выступает активный металл, что позитивно отражается на сроке эксплуатации. Литий имеет отрицательный поэтому при небольших габаритах подобные элементы имеют максимальное номинальное напряжение. Среди недостатков подобных систем можно выделить высокую цену. Вскрытие литиевых источников тока является взрывоопасным.
Заключение
Принцип работы любого гальванического элемента основывается на окислительно-восстановительных процессах, протекающих на катоде и аноде. В зависимости от используемого металла, выбранного раствора электролита, меняется срок службы элемента, а также величина номинального напряжения. В настоящее время востребованы литиевые, кадмиевые гальванические элементы, имеющие достаточно продолжительный срок своей службы.
Министерство образования и науки Российской Федерации
Национальный исследовательский ядерный университет «МИФИ»
Балаковский инженерно-технологический институт
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Методические указания
по курсу « Химия»
всех форм обучения
Балаково 2014
Цель работы: изучить принцип работы гальванических элементов.
ОСНОВНЫЕ ПОНЯТИЯ
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ НА ГРАНИЦЕ РАЗДЕЛА ФАЗ
В узлах кристаллических решеток металлов расположены ионы атомов. При погружении металла в раствор начинается сложное взаимодействие поверхностных ионов металла с полярными молекулами растворителя. В результате происходит окисление металла, и его гидратированные (сольватированные) ионы переходят в раствор, оставляя в металле электроны:
Ме + m H 2 O
Me(H 2 O) +
ne -
+
ne -
Металл заряжается отрицательно, а раствор - положительно. Возникает электростатическое притяжение между перешедшими в жидкость гидратированными катионами и поверхностью металла и на границе металл-раствор образуется двойной электрический слой, характеризующийся определенной разностью потенциалов -электродным потенциалом.

Рис. 1 Двойной электрический слой на границе раздела металл - раствор
Наряду с этой реакцией протекает обратная реакция - восстановление ионов металла до атомов.
Me(H 2 O) +
ne
+
ne Ме
+ m H 2 O
-
Ме
+ m H 2 O
-
При некотором значении электродного потенциала устанавливается равновесие:
Ме + m H 2 O
 Me(H 2 O)
Me(H 2 O) +
ne -
+
ne -
Для упрощения воду в уравнение реакции не включают:
Ме
 Me 2+
+ne -
Me 2+
+ne -
Потенциал, устанавливающийся в условиях равновесия электродной реакции, называется равновесным электродным потенциалом.
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Гальванические элементы – химические источники электрической энергии. Они представляют собой системы, состоящие из двух электродов (проводниковIрода), погруженных в растворы электролитов (проводниковIIрода).
Электрическая энергия в гальванических элементах получается за счет окислительно-восстановительного процесса при условии раздельного проведения реакции окисления на одном электроде и реакции восстановления на другом. Например, при погружении цинка в раствор сульфата меди цинк окисляется, а медь восстанавливается
Zn + CuSO 4 = Cu + ZnSO 4
Zn 0 +Cu 2+ =Cu 0 +Zn 2+
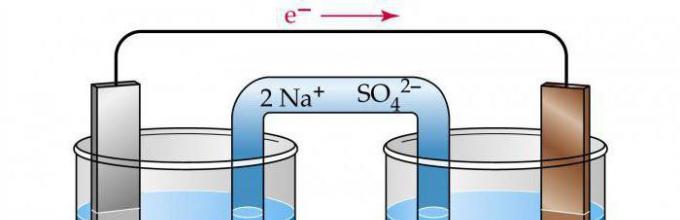
Можно провести эту реакцию так, чтобы процессы окисления и восстановления были пространственно разделены; тогда переход электронов от восстановителя к окислителю будет происходить не непосредственно, а через электрическую цепь. На рис. 2 представлена схема гальванического элемента Даниэля-Якоби, электроды погружены в растворы солей и находятся в состоянии электрического равновесия с растворами. Цинк, как более активный металл, посылает в раствор больше ионов, чем медь, в результате чего цинковый электрод за счет остающихся на нем электронов заряжается более отрицательно, чем медный. Растворы разделены перегородкой, проницаемой только для ионов, находящихся в электрическом поле. Если электроды соединить между собой проводником (медной проволокой), то электроны с цинкового электрода, где их больше, будут по внешней цепи перетекать на медный. Возникает непрерывный поток электронов - электрический ток. В результате ухода электронов с цинкового электрода Znцинк начинает переходить в раствор в виде ионов, восполняя убыль электронов и стремясь тем самым восстановить равновесие.
Электрод, на котором протекает окисление, называется анодом. Электрод, на котором протекает восстановление, называется катодом.
Анод (-) Катод (+)

Рис. 2. Схема гальванического элемента
При работе медно-цинкового элемента протекают следующие процессы:
1) анодный – процесс окисления цинка Zn 0 – 2e→Zn 2+ ;
2) катодный – процесс восстановления ионов меди Cu 2+ + 2e→Cu 0 ;
3) движение электронов по внешней цепи;
4) движение ионов в растворе.
В левом стакане - недостаток анионов SO 4 2- , а в правом – избыток. Поэтому во внутренней цепи работающего гальванического элемента наблюдается перемещение ионов SO 4 2- из правого стакана в левый через мембрану.
Суммируя электродные реакции, получаем:
Zn + Cu 2+ = Cu + Zn 2+
На электродах протекают реакции:
Zn+SO 4 2- →Zn 2+ +SO 4 2- + 2e(анод)
Cu 2+ + 2e + SO 4 2- → Cu + SO 4 2- (катод)
Zn + CuSO 4 → Cu + ZnSO 4 (суммарная реакция)
Схема гальванического элемента: (-) Zn/ZnSO 4 | |CuSO 4 /Cu(+)
или в ионном виде: (-) Zn/Zn 2+ | |Cu 2+ /Cu(+), где вертикальная черта обозначает поверхность раздела между металлом и раствором, а две черты - границу раздела двух жидких фаз - пористую перегородку (или соединительную трубку, заполненную раствором электролита).
Максимальная электрическая работа (W) при превращении одного моля вещества:
W=nF
 E,
(1)
E,
(1)
где ∆E- ЭДС гальванического элемента;
F- число Фарадея, равное 96500 Кл;
n- заряд иона металла.
Электродвижущая сила гальванического элемента, может быть рассчитана как разность потенциалов электродов, составляющих гальванический элемент:
ЭДС= Е окис. – Е восст = Е к – Е а,
где ЭДС- электродвижущая сила;
Е окисл. – электродный потенциал менее активного металла;
Е восст - электродный потенциал более активного металла.
СТАНДАРТНЫЕ ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ МЕТАЛЛОВ
Абсолютные значения электродных потенциалов металлов непосредственно определить невозможно, но можно определить разность электродных потенциалов. Для этого находят разность потенциалов измеряемого электрода и электрода, потенциал которого известен. Наиболее часто в качестве электрода сравнения принято использовать водородный электрод. Поэтому измеряют ЭДС гальванического элемента, составленного из исследуемого и стандартного водородного электрода, электродный потенциал которого принимают равным нулю. Схемы гальванических элементов для измерения потенциала металла таковы:
Н 2, Pt|H + || Мe n + |Me
Т. к. потенциал водородного электрода, условно равен нулю, то ЭДС измеряемого элемента будет равна электродному потенциалу металла.
Стандартным электродным потенциалом металла называют его электродный потенциал, возникающий при погружении металла в раствор собственного иона с концентрацией (или активностью) , равной 1 моль/л, при стандартных условиях, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 25 0 С условно принимается равным нулю. Располагая металлы в ряд по мере возрастания их стандартных электродных потенциалов (Е°), получаем так называемый ряд напряжений.
Чем более отрицательное значение имеет потенциал системы Ме/Ме n+ , тем активнее металл.
Электродный потенциал металла, опущенного в раствор собственной соли при комнатной температуре, зависит от концентрации одноименных ионов и определяется по формуле Нернста:
 ,
(2)
,
(2)
где E 0 – нормальный (стандартный) потенциал, В;
R – универсальная газовая постоянная, равная 8,31Дж(моль.К);
F– число Фарадея;
Т - абсолютная температура, К;
С - концентрация ионов металла в растворе, моль/л.
Подставляя значения R, F, стандартное температуры Т=298 0 К и множитель перехода от натуральных логарифмов (2,303)к десятичным, получают удобную для применения формулу:
 (3)
(3)
КОНЦЕНТРАЦИОННЫЕ ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Гальванические элементы могут быть составлены из двух совершенно одинаковых по природе электродов, погруженных в растворы одного и того же электролита, но различной концентрации. Такие элементы называются концентрационными, например:
(-) Ag | AgNO 3 || AgNO 3 | Ag (+)
В концентрационных цепях для обоих электродов величины n и E 0 одинаковы, поэтому для расчета ЭДС такого элемента можно использовать
 , (4)
, (4)
где С 1 – концентрация электролита в более разбавленном растворе;
С 2 - концентрация электролита в более концентрированном растворе
ПОЛЯРИЗАЦИЯ ЭЛЕКТРОДОВ
Равновесные потенциалы электродов могут быть определены в условиях отсутствия в цепи тока. Поляризация - изменение потенциала электрода при прохождении электрического тока.
Е = Е i - Е p , (5)
где Е - поляризация;
Е i - потенциал электрода при прохождении электрического тока;
Е p - равновесный потенциал. Поляризация может быть катодной Е К (на катоде) и анодной Е A (на аноде).
Поляризация может быть:1) электрохимическая; 2) химическая.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ТРУДА
1. Опыты с неприятно пахнущими и ядовитыми веществами проводятся обязательно в вытяжном шкафу.
2. При распознавании выделяющегося газа по запаху следует направлять струю движениями руки от сосуда к себе.
3. Выполняя опыт, необходимо следить за тем, чтобы реактивы не попали на лицо, одежду и рядом стоящего товарища.
4. При нагревании жидкости, особенно кислот и щелочей, держать пробирку отверстием в сторону от себя.
5. При разбавлении серной кислоты нельзя приливать воду к кислоте, следует вливать кислоту осторожно, небольшими порциями в холодную воду, перемешивая раствор.
6. По окончании работы следует тщательно вымыть руки.
7. Отработанные растворы кислот и щелочей рекомендуется сливать в специально приготовленную посуду.
8. Все склянки с реактивами необходимо закрывать соответствующими пробками.
9. Оставшиеся после работы реактивы не следует выливать или высыпать в реактивные склянки (во избежание загрязнения).
Порядок выполнения работы
Задание 1
ИССЛЕДОВАНИЕ АКТИВНОСТИ МЕТАЛЛОВ
Приборы и реактивы: цинк, гранулированный; сульфат меди CuSO 4 , 0,1 н раствор; пробирки.
Кусочек гранулированного цинка опустите в 0,1 н раствор сульфата меди. Оставьте стоять спокойно в штативе и наблюдайте происходящее. Составьте уравнение реакции. Сделайте вывод, какой металл можно взять в качестве анода и какой - в качестве катода для следующего опыта.
Задание 2
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Приборы и реактивы: Zn, Cu –металлы; сульфат цинка,ZnSO 4 , 1 М раствор; сульфат меди CuSO 4 , 1 М раствор; хлорид калия КCl, концентрированный раствор; гальванометр; стаканы; U- образная трубка, вата.
В один стакан налейте до ¾ объема 1М раствора соли металла, являющегося анодом, а в другой - такой же объем 1 М раствора соли металла, являющегося катодом. Заполните U- образную трубку концентрированным раствором КCl. Концы трубки закройте плотными кусочками ваты и опустите в оба стакана так, чтобы они погрузились в приготовленные растворы. В один стакан опустите пластинку металл- анод, в другую- пластинку металл- катод; смонтируйте гальванический элемент с гальванометром. Замкните цепь и отметьте по гальванометру направление тока.
Составьте схему гальванического элемента.
Напишите электронные уравнения реакций, протекающих на аноде и катоде данного гальванического элемента. Вычислите ЭДС.
Задание 3
ОПРЕДЕЛЕНИЕ АНОДА ИЗ УКАЗАННОГО НАБОРА ПЛАСТИНОК
Приборы и реактивы: Zn, Cu, Fe, Al –металлы; сульфат цинка,ZnSO 4 , 1 М раствор; сульфат меди CuSO 4 , 1 М раствор; сульфат алюминияAl 2 (SO 4) 3 1 М раствор; сульфат железаFeSO 4 , 1 М раствор; хлорид калия КCl, концентрированный раствор; стаканы; U- образная трубка, вата.
Составьте гальванические пары:
Zn/ZnSO 4 ||FeSO 4 /Fe
Zn / ZnSO 4 || CuSO 4 / Cu
Al/Al 2 (SO 4) 3 || ZnSO 4 /Zn
Из указанного набора пластинок и растворов солей этих металлов соберите гальванический элемент, в котором цинк являлся бы катодом (задание 2).
Составьте электронные уравнения реакций, протекающих на аноде и катоде собранного гальванического элемента.
Напишите окислительно-восстановительную реакцию, которая лежит в основе работы данного гальванического элемента. Вычислите ЭДС.
ОФОРМЛЕНИЕ ОТЧЕТА
Лабораторный журнал заполняется в ходе лабораторных занятий по мере выполнения работы и содержит:
дату выполнения работы;
название лабораторной работы и ее номер;
название опыта и цель его проведения;
наблюдения, уравнения реакций, схему прибора;
контрольные вопросы и задачи по теме.
КОНТРОЛЬНЫЕ ЗАДАНИЯ
1.Какие из указанных ниже реакций возможны? Написать уравнения реакций в молекулярном виде, составить для них электронные уравнения:
Zn(NO 3) 2 + Cu →
Zn(NO 3) 2 + Mg →
2. Составьте схемы гальванических элементов для определения нормальных электродных потенциалов Al/Al 3+ ,Cu/Cu 2+ в паре с нормальным водородным электродом.
3. Вычислите ЭДС гальванического элемента
Zn/ZnSO 4 (1M)| |CuSO 4 (2M)
Какие химические процессы протекают при работе этого элемента?
4. Химически чистый цинк почти не реагирует с соляной кислотой. При добавлении к кислоте нитрата свинца происходит частичное выделение водорода. Объясните эти явления. Составьте уравнения происходящих реакций.
5. Медь находится в контакте с никелем и опущена в разбавленный раствор серной кислоты, какой процесс происходит на аноде?
6. Составьте схему гальванического элемента, в основе которого лежит реакция, протекающая по уравнению: Ni+Pb(NO 3) 2 =Ni(NO 3) 2 +Pb
7. Марганцевый электрод в растворе его соли имеет потенциал 1,2313 В. Вычислите концентрацию ионов Mn 2+ в моль/л.
Время, отведенное на лабораторную работу
Литература
Основная
1. Глинка. Н.А. Общая химия: учеб. пособие для вузов. – М.:Интеграл – Пресс, 2005. – 728 с.
2. Коржуков Н. Г. Общая и неорганическая химия. – М.: МИСИС;
ИНФРА–М, 2004. – 512 с.
Дополнительная
3.Фролов В.В. Химия: учеб. пособие для втузов. – М.: Высш. шк., 2002. –
4. Коровин Н.В.. Общая химия: учебник для техн. направл. и спец. вузов. – М.: Высш. шк., 2002.–559с.: ил..
4. Ахматов Н.С. Общая и неорганическая химия: учебник для вузов. – 4-е изд., исправл.- М.: Высш. шк., 2002. –743 с.
5. Глинка Н.А. Задания и упражнения по общей химии. – М.: Интеграл –Пресс, 2001. – 240 с.
6. Метельский А. В. Химия в вопросах и ответах: справочник. – Мн.: Бел.Эн., 2003. – 544 с
гальванические элементы
Методические указания
к выполнению лабораторной работы
по курсу « Химия»
для студентов технических направлений и специальностей,
«Общая и неорганическая химия»
для студентов направления «Химическая технология»
всех форм обучения
Составили: Синицына Ирина Николаевна
Тимошина Нина Михайловна
Гальванический элемент
Схема гальванического элемента Даниэля-Якоби
Гальвани́ческий элеме́нт - , основанный на взаимодействии двух металлов и (или) их оксидов в электролите , приводящем к возникновению в замкнутой цепи электрического тока. Назван в честь Луиджи Гальвани .
Явление возникновения электрического тока при контакте разных металлов было открыто итальянским физиологом , профессором медицины Болонского университета Луиджи Гальвани в 1786 году. Гальвани описал сокращения мышц задних лапок свежепрепарированной лягушки, закрепленных на медных крючках, при прикосновении стального скальпеля . Наблюдения были истолкованы первооткрывателем как проявление «животного электричества».
Электрохимические генераторы (топливные элементы) - это элементы, в которых происходит превращение химической энергии в электрическую. Окислитель и восстановитель хранятся вне элемента, в процессе работы непрерывно и раздельно подаются к электродам. В процессе работы топливного элемента электродые не расходуются. Восстановителем является водород (H 2), метанол (CH 3 OH), метан (CH 4) в жидком или газообразном состоянии. Окислителем обычно является кислород воздуха или чистый. В кислородно-водородном топливном элементе со щелочным электролитом происходит превращение химической энергии в электрическую. Энергоустановки применяются на космических кораблях, они обеспечивают энергией космический корабль и космонавтов.
Применение
- Батарейки используются в системе сигнализации, фонарях, часах, калькуляторах, аудиосистемах, игрушках, радио, автооборудовании, пультах дистанционного управления.
- Аккумуляторы используются для запуска двигателей машин, возможно так же и применение в качестве временных источников электроэнергии в местах, удаленных от населенных пунктов.
- Топливные элементы применяются в производстве электрической энергии (на электрических станциях), аварийных источниках энергии, автономном электроснабжении, транспорте, бортовом питании, мобильных устройствах.
См. также
Литература
- Ахметов Н.С. Общая и неорганическая химия
- Аксенович Л. А. Физика в средней школе: Теория. Задания.
Ссылки
| Гальванический элемент | Гальванический элемент Даниеля | Щелочной элемент | | Сухой элемент | Концентрационный элемент | Воздушно-цинковый элемент | Нормальный элемент Вестона |
|---|---|
| Электрические аккумуляторы | Свинцово-кислотный | Серебряно-цинковый | Никель-кадмиевый | Никель-металл-гидридный | Никель-цинковый аккумулятор | Литий-ионный | Литий-полимерный | Литий-железо-сульфидный | Литий-железо-фосфатный | Литий-титанатный | Ванадиевый | Железо-никелевый |
| Топливные элементы | Прямой метанольный | Твердооксидный | Щелочной |
| Модели | Батарея | Электрический аккумулятор | Топливный элемент |
| Устройство | Анод | Катод | Электролит |
Гальванический элемент — это химический источник электрического тока, в котором происходит непосредственное преобразование химической энергии в электрическую. Поэтому он является . Внешний вид наиболее распространенных элементов питания приведен на рисунке 1.
Рисунок 1. Внешний вид пальчиковых гальванических элементов
Существуют солевые (сухие), щелочные и литиевые элементы. Гальванические элементы часто называют батарейками, однако это название неверно, т.к. батареей является соединение нескольких одинаковых устройств. Например, при последовательном соединении трех гальванических элементов образуется широко используемая 4,5 вольтовая батарейка.
Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. Напряжение зависит от использованных металлов. Некоторые из этих химических источников тока приведены в таблице 1.
| Тип источников тока | Катод | Электролит | Анод | Напряжение, В |
|---|---|---|---|---|
| Марганцево-цинковый | MnO 2 | KOH | Zn | 1,56 |
| Марганцево-оловянный | MnO 2 | KOH | Sn | 1,65 |
| Марганцево-магниевый | MnO 2 | MgBr 2 | Mg | 2,00 |
| Свинцово-цинковый | PbO 2 | H 2 SO 4 | Zn | 2,55 |
| Свинцово-кадмиевый | PbO 2 | H 2 SO 4 | Cd | 2,42 |
| Свинцово-хлорный | PbO 2 | HClO 4 | Pb | 1,92 |
| Ртутно-цинковый | HgO | KOH | Zn | 1,36 |
| Ртутно-кадмиевый | HgO 2 | KOH | Cd | 1,92 |
| Окисно-ртутно-оловянный | HgO 2 | KOH | Sn | 1,30 |
| Хром-цинковый | K 2 Cr 2 O 7 | H 2 SO 4 | Zn | 1,8-1,9 |
В продаже в основном представлены Марганцево-цинковые элементы, которые называют солевыми. Производители батареек обычно не указывают их химический состав. Это самые дешевые гальванические элементы, которые можно применять только в устройствах с низким потреблением, таких как часы, электронные термометры или пульты дистанционного управления. На рисунке 2 приведены внешний вид и внутреннее устройство солевого элемента питания.

Рисунок 2. Внешний вид и устройство "сухого" гальванического элемента
Не менее распространенным элементом питания являются щелочные марганцевые батарейки. В продаже их называют алкалиновыми, не утруждая себя переводом названия на русский язык. Внутреннее устройство алкалинового гальванического элемента показано на рисунке 2.

Рисунок 3. Внутреннее и устройство щелочного гальванического элемента
Эти химические источники тока обладают большей емкостью (2...3 A/ч) и они могут обеспечивать больший ток в течение длительного времени.Больший ток стал возможным, т.к. цинк используется не в виде стакана, а в виде порошка, обладающего большей площадью соприкосновения с электролитом. В качестве электролита применяется гидрооксид калия. Именно благодаря способности данного вида гальванических элементов в течение длительного времени отдавать значительный ток (до 1 A), наиболее распространен в настоящее время.
Еще одним достаточно распространенным видом гальванических элементов являются литиевые барарейки. Благодаря использованию щелочного металла они обладают высокой разностью потенциалов. Напряжение литиевых элементов равно 3 В. Однако на рынке представлены и 1,5 В литиевые батарейки. Эти элементы питания обладают наивысшей емкостью на единицу массы и длительным временем хранения. Применяются в основном для питания часов на материнских платах компьютеров и фототехнике. В качестве недостатка можно назвать высокую стоимость. Внешний вид литиевых батареек приведен на рисунке 4.

Рисунок 4. Внешний вид литиевых элементов питания
Следует отметить, что практически все гальванические элементы способны подзаряжаться от сетевых источников питания. Исключение составляют литиевые батарейки, которые при попытке подзаряда могут взорваться .
Для применения в различных устройствах батарейки были стандартизированы. Наиболее распространенные виды корпусов гальванических элементов приведены в таблице 2.
Для крепления батареек внутри корпуса радиоэлектронных устройств в настоящее время предлагаются готовые батарейные отсеки. Применение их позволяет значительно упростить разработку корпуса радиоэлектронного устройства и удешевить его производство. Внешний вид некоторых из них приведен на рисунке 5.

Рисунок 5. Внешний вид отсеков для крепления гальванических элементов питания
Первый вопрос, который волнует покупателей батареек — это время их работы. Оно зависит от технологии производства гальванического элемента. График типовой зависимости выходного напряжения от технологии производства элемента питания приведен на рисунке 5.

Рисунок 6. График времени работы элемента питания в зависимости от технологии производства при токе разряда 1 А
Результаты тестов батареек различных фирм, проведенные на сайте http://www.batteryshowdown.com/ приведены на рисунке 7.

Рисунок 7. График времени работы батареек различных фирм при токе разряда 1 А
И, наконец, давайте сделаем выводы где какой тип батареек имеет смыст применять, так как при приобретении батареек мы всегда стараемся получить максимум полезного эффекта при минимуме затрат.
- Не стоит покупать батарейки в киосках или на рынке. Обычно они там достаточно долго лежат и поэтому за счет саморазряда практически теряют свою емкость. Это может быть даже опасно для аппаратуры, т.к. при использовании дешевых гальванических элементов (батареек) из них может протечь электролит. Это приведет к выходу аппаратуры из строя! Покупать лучше в магазинах с хорошим оборотом товара.
- щелочные (алкалиновые) батарейки следует применять в устройствах, потребляющих достаточно большой ток, таких как фонарики, плееры или фотоаппараты. В малопотребляющих устройствах их срок работы не отличается от солевых батареек.
- Солевые («обычные», угольно-цинковые гальванические элементы), будут отлично работать в часах, ИК пультах и прочих устройствах, рассчитанных на работу от одного комплекта батарей в течении года и более. При этом они не могут работать на морозе.
- Самые экономически выгодные батарейки на сегодня — пальчиковые АА. Как мизинчиковые (АAА), так и большие (R20), при одной и той же емкости стоят дороже. Ёмкость современных батареек R20 почти такая же как и пальчиковых батареек АА, и это при в три раза больших размерах!
- Не стоит обращать внимание на раскрученные бренды. Гальванические элементы фирм Duracell и Energizer стоят в полтора-два раза дороже батареек остальных фирм и при этом работают примерно столько-же
1. Гальванический элемент
Гальванический элемент - химический источник электрического тока, названный в честь Луиджи Гальвани. Принцип действия гальванического элемента основан на взаимодействии двух металлов через электролит, приводящем к возникновению в замкнутой цепи электрического тока. ЭДС гальванического элемента зависит от материала электродов и состава электролита. Это первичные ХИТ, которые из-за необратимости протекающих в них реакций, невозможно перезарядить.
Гальванические элементы являются источниками электрической энергии одноразового действия. Реагенты (окислитель и восстановитель) входят непосредственно в состав гальванического элемента и расходуются в процессе его работы. Гальванический элемент характеризуется ЭДС, напряжением, мощностью, емкостью и энергией, отдаваемой во внешнюю цепь, а также сохраняемостью и экологической безопасностью.
ЭДС определяется природой протекающих в гальваническом элементе процессов. Напряжение гальванического элемента U всегда меньше его ЭДС в силу поляризации электродов и потерь сопротивления:
U = Eэ – I(r1–r2) – ΔE,
где Еэ – ЭДС элемента; I – сила тока в режиме работы элемента; r1 и r2 – сопротивление проводников I и II рода внутри гальванического элемента; ΔЕ – поляризация гальванического элемента, складывающаяся из поляризаций его электродов (анода и катода). Поляризация возрастает с увеличением плотности тока (i), определяемой по формуле i = I/S, где S – площадь поперечного сечения электрода, и ростом сопротивления системы.
В процессе работы гальванического элемента его ЭДС и, соответственно, напряжение постепенно снижаются в связи с уменьшением концентрации реагентов и увеличением концентрации продуктов окислительно-восстановительных процессов на электродах (вспомним уравнение Нернста). Однако чем медленнее снижается напряжение при разряде гальванического элемента, тем больше возможностей его применения на практике. Емкостью элемента называют общее количество электричества Q, которое гальванический элемент способен отдать в процессе работы (при разрядке). Емкость определяется массой запасенных в гальваническом элементе реагентов и степенью их превращения. При увеличении тока разряда и снижении температуры работы элемента, особенно ниже 00С, степень превращения реагентов и емкость элемента снижаются.
Энергия гальванического элемента равна произведению его емкости на напряжение: ΔН = Q.U. Наибольшей энергией обладают элементы с большим значением ЭДС, малой массой и высокой степенью превращения реагентов.
Сохраняемостью называют продолжительность срока хранения элемента, в течение которого его характеристики остаются в заданных параметрах. С ростом температуры хранения и эксплуатации элемента, его сохраняемость уменьшается.
Состав гальванического элемента: восстановителями (анодами) в портативных гальванических элементах, как правило, служат цинк Zn, литий Li, магний Mg; окислителями (катодами) – оксиды марганца MnO2, меди CuO, серебра Ag2O, серы SO2, а также соли CuCl2, PbCl2, FeS и кислород О2.
Самым массовым в мире остается производство марганец–цинковых элементов Mn–Zn, широко применяемых для питания радиоаппаратуры, аппаратов связи, магнитофонов, карманных фонариков и т.п. Конструкция такого гальванического элемента представлена на рисунке
Токообразующими реакциями в этом элементе являются:
На аноде (–): Zn – 2ē → Zn2+ (на практике происходит постепенное растворение цинковой оболочки корпуса элемента);
На катоде (+): 2MnO2 + 2NH4+ + 2ē → Mn2O3 + 2NH3 + H2O.
В электролитическом пространстве также идут процессы:
У анода Zn2+ + 2NH3 →2+;
У катода Mn2O3 + H2O → или 2.
В молекулярном виде химическую сторону работы гальванического элемента можно представить суммарной реакцией:
Zn + 2MnO2 + 2NH4Cl → Cl2 + 2.
Схема гальванического элемента:
(–) Zn|Zn(NH3)2]2+|||MnO2 (С) (+).
ЭДС такой системы составляет Е= 1,25 ÷ 1,50В.
Гальванические элементы с подобным составом реагентов в щелочном электролите (КОН) имеют лучшие выходные характеристики, но они неприменимы в портативных устройствах в силу экологической опасности. Еще более выгодными характеристиками обладают серебряно-цинковые элементы Ag-Zn, но они чрезвычайно дороги, а значит, экономически неэффективны. В настоящее время известно более 40 различных типов портативных гальванических элементов, называемых в быту «сухими батарейками».
2. Электрические аккумуляторы
Электрические аккумуляторы (вторичные ХИТ)- перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить.
Аккумуляторы – это устройства, в которых под воздействием внешнего источника тока в системе накапливается (аккумулируется) химическая энергия (процесс зарядки аккумулятора), а затем при работе устройства (разрядка) химическая энергия снова превращается в электрическую. Таким образом, при зарядке аккумулятор работает как электролизер, а при разрядке – как гальванический элемент.
В упрощенном виде аккумулятор представляет собой два электрода (анод и катод) и ионный проводник между ними – электролит. На аноде как при разряде, так и при заряде протекают ре6акции окисления, а на катоде – реакции восстановления.
До последнего времени по-прежнему наиболее распространенными в России, да и в Приднестровье, остаются кислотные свинцовые и щелочные никель-кадмиевые и никель-железные аккумуляторы.

Электроды в нем представляют собой свинцовые решетки, из которых одна заполняется в порах порошком оксида свинца IV – PbO2. Электроды соединены с электролитом через пористый сепаратор. Всеь аккумулятор помещается в бак из эбонита или полипропилена.
При работе такого устройства в нем происходят следующие электродные процессы:
А). Разрядка или работа аккумулятора как источника электрической энергии.
На аноде: (–) Pb – 2ē → Pb2+;
на катоде: (+) PbO2 + 4H+ + 2ē → Pb2+ + 2H2O.
Образующиеся на электродах катионы свинца взаимодействуют с анионами электролита с выделением белого осадка сульфата свинца
Pb2+ + SO42– = ↓PbSO4.
Суммарная токообразующая реакция процесса разрядки аккумулятора:
Pb + PbO2 + 2H2SO4 = 2PbSO4↓ + 2H2O,
а схема работающего аккумулятора как гальванического элемента имеет вид (–) Pb|PbSO4||PbO2 (+).
Напряжение на клеммах работающего аккумулятора достигает величины 2,0÷2,5В. В процессе эксплуатации устройства электролит расходуется, а в системе накапливается осадок. Когда концентрация активных ионов водорода [Н+] становится критической для реакции на катоде, аккумулятор прекращает свою работу.
Б). Зарядка или восстановление химического потенциала аккумулятора для последующего его преобразования в электрическую энергию. Для этого аккумулятор подсоединяют к внешнему источнику тока таким образом, что к клемме «анод» подается отрицательный полюс, а к клемме «катод» - положительный. В этом случае на электродах под действием внешнего напряжения возникают обратные процессы, восстанавливающие их до первоначального состояния.
Металлический свинец восстанавливает поверхность электрода (–): PbSO4 + 2ē → Pb + SO42;
Образующийся оксид свинца IV заполняет поры свинцовой решетки (+): PbSO4 + 2H2O – 2ē → ↓PbO2 + 4H+ + SO42.
Суммарная восстановительная реакция: 2PbSO4 + 2H2O = Pb + PbO2 +2H2SO4.
Определить момент окончания процесса зарядки аккумулятора можно по появлению пузырьков газа над его клеммами («кипение»). Это связано с возникновением побочных процессов восстановления катионов водорода и окисления воды с ростом напряжения при восстановлении электролита:
2Н+ + 2ē → Н2; 2Н2О – 4ē → О2 + 2Н2.
Коэффициент полезного действия аккумулятора достигает 80% и рабочее напряжение длительное время сохраняет свое значение.
ЭДС аккумулятора может быть рассчитана по уравнению:
RT α4(H+)·α2(SO42–)
EЭ = EЭ0 + –––– ℓn –––––––––––––– (твердые фазы в Сравн. не
2F α2(H2O) учитываются).
Надо заметить, что в аккумуляторе нельзя использовать концентрированную серную кислоту (ω(H2SO4) > 30%), т.к. при этом уменьшается ее электрическая проводимость и увеличивается растворимость металлического свинца. Свинцовые аккумуляторы широко используются в автомобильном транспорте всех типов, на телефонных и электрических станциях. Однако из-за высокой токсичности свинца и его продуктов, свинцовые аккумуляторы требуют герметичной упаковки и полной автоматизации процессов их эксплуатации.
А) В щелочных аккумуляторах положительный электрод изготавливается из никелевой решетки, пропитанной гелеобразным гидрооксидом никеля II Ni(OH)2; а отрицательный – из кадмия или железа. Ионным проводником служит 20%-ый раствор гидрооксида калия КОН. Суммарные токообразующие и генерирующие реакции в таких аккумуляторах имеют вид:
2NiOOH + Cd + 2H2O ◄====== 2Ni(OH)2 + Cd(OH)2; ЕЭ0 = 1,45В.
2NiOOH + Fe + 2H2O ◄====== 2Ni(OH)2 + Fe(OH)2; ЕЭ0 = 1,48В.
К достоинствам этих аккумуляторов относят большой срок их службы (до 10 лет) и высокую механическую прочность, а к недостаткам – невысокие КПД и рабочее напряжение. Щелочные аккумуляторы используются для питания электрокар, погрузчиков, рудничных электровозов, аппаратуры связи и электронной аппаратуры, радиоприемников. Вспомним также, что кадмий является высокотоксичным металлом, что требует соблюдения правил безопасности при утилизации отработанных устройств.
ЭДС и тока. Необходимо помнить, что в батарею должны соединятся элементы с одинаковыми характеристиками. План работы Начертить схемы замещения: Схемы включения реостата Схемы включения потенциометра Схемы соединения гальванических элементов. Вывод Из построенных схем и условий каждая цепь имеет своё значение ЭДС на каждой схеме она определяется по разному. Ответы на...
Развития гальванотехники в XIX – XX вв. в значительной степени остаётся открытым. Представляется, что его можно решить на основании реконструкции процесса создания гальванического производства; прослеживания, каким областям науки и техники, их конкретным достижениям обязано оно своим становлением; рассмотрения социально-экономических предпосылок возникновения и становления гальванотехники. ...
Тока ниже, чем в гальваностегии; в железных гальванопластических ваннах она не превышает 10-30 а/м2, в то время как при железнении (гальваностегия) плотность тока достигает 2000-4000 а/м2. Гальванические покрытия должны иметь мелкокристаллическую структуру и равномерную толщину на различных участках покрываемых изделий - выступах и углублениях. Это требование имеет в гальваностегии особенно важное...