В этой статье рассмотрим способы и поймем, как определить валентность элементов таблицы Менделеева.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева . В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность.
За единицу валентности принята валентность атома водорода, равная 1, то есть водород одновалентен. Поэтому валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например, HCl, где хлор - одновалентен; H2O, где кислород - двухвалентен; NH3, где азот - трёхвалентен.
Как определить валентность по таблице Менделеева.
Таблица Менделеева содержит в себе химические элементы, которые размещены в ней по определенным принципам и законам. Каждый элемент стоит на месте, который определяется его характеристиками и свойствами и каждый элемент имеет свой номер. Горизонтальные линии называются периодами, которые возрастают от первой строки вниз. Если период состоит из двух рядов (что указано сбоку нумерацией), то такой период называется большим. Если он имеет только один ряд, то называется малым.
Кроме того, в таблице есть группы, которых всего восемь. Элементы размещаются в столбцах по вертикали. Здесь их размещение неравномерно - с одной стороны больше элементов (главная группа), с другой - меньше (побочная группа).
Валентностью называют способность атома образовывать некоторое количество химических связей с атомами других элементов. по таблице Менделеева поможет понять знание видов валентности.
Для элементов побочных подгрупп (а к ним относятся только металлы) валентность нужно запоминать, тем более что в большинстве случае она равна I, II, реже III. Также придется заучить валентности химических элементов, которые имеют более двух значений. Или постоянно держать под рукой таблицу валентности элементов .
Алгоритм определения валентности по формулам химических элементов.
1. Записать формулу химического соединения.
2. Обозначить известную валентность элементов.
3. Найти наименьшее общее кратное валентности и индекса.
4. Найти соотношение наименьшего общего кратного к количеству атомов второго элемента. Это и есть искомая валентность.
5. Сделать проверку путём перемножения валентности и индекса каждого элемента. Их произведения должны быть равны.
Пример: определим валентность элементов сульфида водорода.
1. Запишем формулу:
2. Обозначим известную валентность:
3. Найдём наименьшее общее кратное:
4. Найдём соотношение наименьшего общего кратного к количеству атомов серы :
5. Сделаем проверку:
Таблица характерных значений валентностей некоторых атомов химических соединений.
|
Элементы |
Валентность |
Примеры соединений |
|
H 2 , HF, Li 2 O, NaCl, KBr |
||
|
O, Mg, Ca, Sr, Ba, Zn |
H 2 O, MgCl 2 , CaH 2 , SrBr 2 , BaO, ZnCl 2 |
|
|
CO 2 , CH4, SiO 2 , SiCl 4 |
||
|
CrCl 2 , CrCl 3 , CrO 3 |
||
|
H 2 S, SO 2 , SO3 |
||
|
NH 3 , NH 4 Cl, HNO 3 |
||
|
PH 3 , P 2 O 5 , H 3 PO 4 |
||
|
SnCl 2 , SnCl 4 , PbO, PbO 2 |
||
|
HCl, ClF 3 , BrF 5 , IF 7 |
Из материалов урока вы узнаете, что постоянство состава вещества объясняется наличием у атомов химических элементов определенных валентных возможностей; познакомитесь с понятием «валентность атомов химических элементов»; научитесь определять валентность элемента по формуле вещества, если известна валентность другого элемента.
Тема: Первоначальные химические представления
Урок: Валентность химических элементов
Состав большинства веществ постоянен. Например, молекула воды всегда содержит 2 атома водорода и 1 атом кислорода – Н 2 О. Возникает вопрос: почему вещества имеют постоянный состав?
Проанализируем состав предложенных веществ: Н 2 О, NaH, NH 3 , CH 4 , HCl. Все они состоят из атомов двух химических элементов, один из которых водород. На один атом химического элемента может приходиться 1,2,3,4 атома водорода. Но ни в одном веществе не будет на один атом водорода приходиться несколько атомов другого химического элемента. Таким образом, атом водорода может присоединять к себе минимальное количество атомов другого элемента, а точнее, только один.
Свойство атомов химического элемента присоединять к себе определенное число атомов других элементов называется валентностью.
Некоторые химические элементы имеют постоянные значения валентности (например, водород(I) и кислород(II)), другие могут проявлять несколько значений валентности (например, железо(II,III), сера(II,IV,VI), углерод(II,IV)), их называют элементами с переменной валентностью . Значения валентности некоторых химических элементов приведены в учебнике.
Зная валентности химических элементов, можно объяснить, почему вещество имеет именно такую химическую формулу. Например, формула воды H 2 O. Обозначим валентные возможности химического элемента с помощью черточек. Водород имеет валентность I, а кислород – II: Н- и -О-. Каждый атом может полностью использовать свои валентные возможности, если на один атом кислорода будет приходиться два атома водорода. Последовательность соединения атомов в молекуле воды можно представить в виде формулы: Н-О-Н.
Формула, в которой показана последовательность соединения атомов в молекуле, называется графической (или структурной ).
Рис. 1. Графическая формула воды
Зная формулу вещества, состоящего из атомов двух химических элементов, и валентность одного из них, можно определить валентность другого элемента.
Пример 1. Определим валентность углерода в веществе СН 4 . Зная, что валентность водорода всегда равна I, а углерод присоединил к себе 4 атома водорода, можно утверждать, что валентность углерода равна IV. Валентность атомов обозначается римской цифрой над знаком элемента: .
Пример 2. Определим валентность фосфорав соединении Р 2 О 5 . Для этого необходимо выполнить следующие действия:
1. над знаком кислорода записать значение его валентности – II (кислород имеет постоянное значение валентности);
2. умножив валентность кислорода на число атомов кислорода в молекуле, найти общее число единиц валентности – 2·5=10;
3. разделить полученное общее число единиц валентностей на число атомов фосфора в молекуле – 10:2=5.
Таким образом, валентность фосфора в данном соединении равна V – .
1. Емельянова Е.О., Иодко А.Г. Организация познавательной деятельности учащихся на уроках химии в 8-9 классах. Опорные конспекты с практическими заданиями, тестами: Часть I. – М.: Школьная Пресса, 2002. (с.33)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006. (с. 36-38)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§16)
4. Химия: неорг. химия: учеб. для 8 кл. общеобразоват. учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§11,12)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
1. с.84 № 2 из учебника «Химия: 8-й класс» (П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005).
2. с. 37-38 №№ 2,4,5,6 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006.
Одной из важных в изучении школьных тем является курс, касающийся валентности. Об этом пойдет речь в статье.
Валентность – что это такое?
Валентность в химии означает свойство атомов химического элемента привязывать к себе атомы другого элемента. В переводе с латыни – сила. Выражается она в числах. Например, валентность водорода всегда будет равняться единице. Если взять формулу воды – Н2О, ее можно представить в виде Н – О – Н. Один атом кислорода смог связать с собой два атома водорода. Значит, количество связей, которые создает кислород, равно двум. И валентность этого элемента будет равняться двум.
В свою очередь, водород будет двухвалентным. Его атом может быть соединен только с одним атомом химического элемента. В данном случае с кислородом. Говоря точнее, атомы в зависимости от валентности элемента, образуют пары электронов. Сколько таких пар образовано – таковой и будет валентность. Числовое значение именуется индексом. У кислорода индекс 2.
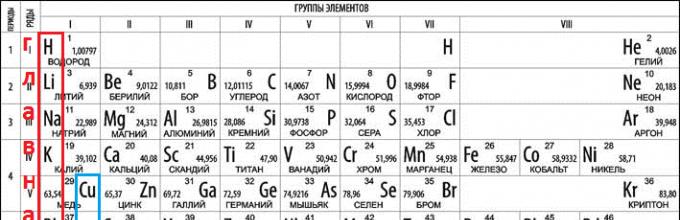
Как определить валентность химических элементов по таблице Дмитрия Менделеева
Посмотрев на таблицу элементов Менделеева, можно заметить вертикальные ряды. Их называют группами элементов. От группы зависит и валентность. Элементы первой группы имеют первую валентность. Второй – вторую. Третьей – третью. И так далее.
Есть также элементы с постоянным индексом валентности. Например, водород, группа галогенов, серебро и так далее. Их необходимо выучить обязательно.


Как определить валентность химических элементов по формулам?
Иногда сложно определить по таблице Менделеева валентность. Тогда нужно смотреть конкретную химическую формулу. Возьмем оксид FeO. Здесь и у железа, как у кислорода, индекс валентности будет равняться двум. А вот в оксиде Fe2O3 – по-другому. Железо будет трехвалентным.


Нужно помнить всегда разные способы определения валентности и не забывать их. Знать постоянные ее числовые значения. У каких элементов они есть. И, конечно, пользоваться таблицей химических элементов. А также изучать отдельные химические формулы. Лучше представлять их в схематическом виде: Н – О – Н, например. Тогда видны связи. И количество черточек (тире) будет числовым значением валентности.
Из материалов урока вы узнаете, что постоянство состава вещества объясняется наличием у атомов химических элементов определенных валентных возможностей; познакомитесь с понятием «валентность атомов химических элементов»; научитесь определять валентность элемента по формуле вещества, если известна валентность другого элемента.
Тема: Первоначальные химические представления
Урок: Валентность химических элементов
Состав большинства веществ постоянен. Например, молекула воды всегда содержит 2 атома водорода и 1 атом кислорода – Н 2 О. Возникает вопрос: почему вещества имеют постоянный состав?
Проанализируем состав предложенных веществ: Н 2 О, NaH, NH 3 , CH 4 , HCl. Все они состоят из атомов двух химических элементов, один из которых водород. На один атом химического элемента может приходиться 1,2,3,4 атома водорода. Но ни в одном веществе не будет на один атом водорода приходиться несколько атомов другого химического элемента. Таким образом, атом водорода может присоединять к себе минимальное количество атомов другого элемента, а точнее, только один.
Свойство атомов химического элемента присоединять к себе определенное число атомов других элементов называется валентностью.
Некоторые химические элементы имеют постоянные значения валентности (например, водород(I) и кислород(II)), другие могут проявлять несколько значений валентности (например, железо(II,III), сера(II,IV,VI), углерод(II,IV)), их называют элементами с переменной валентностью . Значения валентности некоторых химических элементов приведены в учебнике.
Зная валентности химических элементов, можно объяснить, почему вещество имеет именно такую химическую формулу. Например, формула воды H 2 O. Обозначим валентные возможности химического элемента с помощью черточек. Водород имеет валентность I, а кислород – II: Н- и -О-. Каждый атом может полностью использовать свои валентные возможности, если на один атом кислорода будет приходиться два атома водорода. Последовательность соединения атомов в молекуле воды можно представить в виде формулы: Н-О-Н.
Формула, в которой показана последовательность соединения атомов в молекуле, называется графической (или структурной ).
Рис. 1. Графическая формула воды
Зная формулу вещества, состоящего из атомов двух химических элементов, и валентность одного из них, можно определить валентность другого элемента.
Пример 1. Определим валентность углерода в веществе СН 4 . Зная, что валентность водорода всегда равна I, а углерод присоединил к себе 4 атома водорода, можно утверждать, что валентность углерода равна IV. Валентность атомов обозначается римской цифрой над знаком элемента: .
Пример 2. Определим валентность фосфорав соединении Р 2 О 5 . Для этого необходимо выполнить следующие действия:
1. над знаком кислорода записать значение его валентности – II (кислород имеет постоянное значение валентности);
2. умножив валентность кислорода на число атомов кислорода в молекуле, найти общее число единиц валентности – 2·5=10;
3. разделить полученное общее число единиц валентностей на число атомов фосфора в молекуле – 10:2=5.
Таким образом, валентность фосфора в данном соединении равна V – .
1. Емельянова Е.О., Иодко А.Г. Организация познавательной деятельности учащихся на уроках химии в 8-9 классах. Опорные конспекты с практическими заданиями, тестами: Часть I. – М.: Школьная Пресса, 2002. (с.33)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006. (с. 36-38)
3. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005.(§16)
4. Химия: неорг. химия: учеб. для 8 кл. общеобразоват. учреждений / Г.Е. Рудзитис, Ф.Г. Фельдман. – М.: Просвещение, ОАО «Московские учебники», 2009. (§§11,12)
5. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. – М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Единая коллекция цифровых образовательных ресурсов ().
2. Электронная версия журнала «Химия и жизнь» ().
Домашнее задание
1. с.84 № 2 из учебника «Химия: 8-й класс» (П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005).
2. с. 37-38 №№ 2,4,5,6 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006.
При рассмотрении химических элементов можно заметить, что количество атомов у одного и того же элемента в разных веществах разнится. Каким же образом правильно записать формулу и не ошибиться в индексе химического элемента? Это легко сделать, если иметь представление, что такое валентность.
Для чего нужна валентность?
Валентность химических элементов – это способность атомов элемента образовывать химические связи, то есть присоединять к себе другие атомы. Количественной мерой валентности является число связей, которые образует данный атом с другими атомами или атомными группами.
В настоящее время валентность представляет собой число ковалентных связей (в том числе возникших и по донорно-акцепторному механизму), которыми данный атом соединен с другими. При этом не учитывается полярность связей, а значит, валентность не имеет знака и не может быть равной нулю.
Ковалентная химическая связь – это связь, осуществляемая за счет образования общих (связывающих) электронных пар. Если между двумя атомами имеется одна общая электронная пара, то такая связь называется одинарной, если две – двойной, если три – тройной.
Как находить валентность?
Первый вопрос, который волнует учеников 8 класса, начавших изучать химию – как определить валентность химических элементов? Валентность химического элемента можно посмотреть в специальной таблице валентности химических элементов

Рис. 1. Таблица валентности химических элементов
Валентность водорода принята за единицу, так как атом водорода может образовывать с другими атомами одну связь. Валентность других элементов выражаем числом, которое показывает, сколько атомов водорода может присоединить к себе атом данного элемента. Например, валентность хлора в молекуле хлористого водорода равна единице. Следовательно формула хлористого водорода будет выглядеть так: HCl. Так как и у хлора и у водорода валентность равна единице, никакой индекс не используется. И хлор и водород являются одновалентными, так как одному атому водорода соответствует один атом хлора.
Рассмотрим другой пример: валентность углерода в метане равна четырем, валентность водорода – всегда единица. Следовательно, рядом с водородом следует поставить индекс 4. Таким образом формула метана выглядит так: CH 4 .
Очень многие элементы образуют соединения с кислородом. Кислород всегда является двухвалентным. Поэтому в формуле воды H 2 O, где встречаются всегда одновалентный водород и двухвалентный кислород, рядом с водородом ставится индекс 2. Это значит, что молекула воды состоит из двух атомов водорода и одного атома кислорода.

Рис. 2. Графическая формула воды
Не все химические элементы имеют постоянную валентность, у некоторых она может изменяться в зависимости от соединений, где используется данный элемент. К элементам с постоянной валентностью относятся водород и кислород, к элементам с переменной валентностью относятся, например, железо, сера, углерод.
Как определить валентность по формуле?
Если у вас перед глазами нет таблицы валентности, но есть формула химического соединения, то возможно определение валентности по формуле. Возьмем для примера формулу оксид марганца – Mn 2 O 7

Рис. 3. Оксид марганца
Как известно, кислород является двухвалентным. Чтобы выяснить, какой валентностью обладает марганец, необходимо валентность кислорода умножить на число атомов газа в этом соединении:
Получившееся число делим на количество атомов марганца в соединении. Получается:
Средняя оценка: 4.5 . Всего получено оценок: 923.