Свойства аммиака NН 3 (газ) при атмосферном давлении
Аммиак (NН 3) – токсичное горючее газообразное вещество, обладающее свойством образовывать при контакте с воздухом взрывоопасную смесь.
При нормальном давлении и комнатной температуре существует в виде газа. Для использования в производстве и при транспортировании аммиак (нитрид ) сжижают.
Технический аммиак используется как основное сырьё при производстве большого количества веществ, содержащих и используемых в разных отраслях промышленности: минеральных удобрений, и синильной кислот, в общем органическом синтезе и т.д.
В таблице представлены плотность и теплофизические свойства аммиака в газообразном состоянии в зависимости от температуры при давлении 760 мм.рт.ст. Свойства аммиака указаны при температуре от -23 до 627 °С.
В таблице даны следующие свойства аммиака :
- плотность аммиака, кг/м 3 ;
- коэффициент теплопроводности, Вт/(м·град);
- динамическая вязкость, ;
- число Прандтля.
По данным таблицы видно, что свойства аммиака существенно зависят от температуры. Так, с ростом температуры уменьшается плотность аммиака , и число Прандтля; остальные характеристики этого газа увеличивают свои значения.
Например, при температуре 27°С (300 К) аммиак имеет плотность, равную 0,715 кг/м 3 , а при нагревании до 627°С (900 К) плотность аммиака снижается до величины 0,233 кг/м 3 .
Плотность аммиака при комнатной температуре и нормальном атмосферном давлении существенно ниже при этих условиях.
Примечание: Будьте внимательны! Теплопроводность аммиака в таблице указана в степени 10 3 . Не забудьте разделить на 1000.
Свойства аммиака (сухой насыщенный пар)
В таблице даны теплофизические свойства сухого насыщенного аммиака в зависимости от температуры.
Свойства приведены в интервале температуры от -70 до 70 °С.
В таблице указаны следующие свойства пара аммиака :
- плотность аммиака, кг/м 3 ;
- теплота фазового перехода, кДж/кг;
- удельная теплоемкость, кДж/(кг·град);
- температуропроводность, м 2 /с;
- динамическая вязкость, Па·с;
- кинематическая вязкость, м 2 /с;
- число Прандтля.
Свойства аммиака сильно зависят от температуры. Имеет место прямая зависимость между температурой и давлением насыщенных паров аммиака.
Плотность насыщенного пара аммиака при этом значительно увеличивается. Снижаются значения температуропроводности и вязкости. Теплопроводность насыщенного пара аммиака в таблице указана в степени 10 4 . Не забудьте разделить на 10000.
Свойства жидкого аммиака в состоянии насыщения
В таблице даны теплофизические свойства насыщенной жидкости аммиака в зависимости от температуры.
Свойства аммиака в состоянии насыщенной жидкости даны в интервале температуры от -70 до 70 °С.
В таблице приведены следующие свойства жидкого аммиака :
- давление насыщенных паров, МПа;
- плотность аммиака, кг/м 3 ;
- удельная теплоемкость, кДж/(кг·град);
- теплопроводность, Вт/(м·град);
- температуропроводность, м 2 /с;
- динамическая вязкость, Па·с;
- кинематическая вязкость, м 2 /с;
- коэффициент поверхностного натяжения, Н/м;
- число Прандтля.
Плотность аммиака в жидком состоянии менее зависима от температуры, чем плотность его пара. Только динамическая вязкость существенно снижается при росте температуры жидкого аммиака.
Теплопроводность аммиака в жидком и газообразном состояниях
В таблице приведены значения теплопроводности аммиака в жидком и газообразном состояниях в зависимости от температуры и давления.
Теплопроводность аммиака (размерность Вт/(м·град)) указана в диапазоне температуры от 27 до 327 °С и давления от 1 до 1000 атмосфер.
Теплопроводность аммиака в таблице указана в степени 10 3 . Не забудьте разделить на 1000.
Значения теплопроводности выше черты указаны для жидкого аммиака, теплопроводность которого с ростом температуры снижается.
Теплопроводность газообразного аммиака увеличивается при нагревании . Увеличение давления приводит к росту значения теплопроводности, как для жидкого, так и для газообразного аммиака.
В следующей таблице приведена теплопроводность аммиака при низких температурах и атмосферном давлении.
на линии насыщения в зависимости от температуры приведена в таблице ниже. Следует отметить, что теплопроводность жидкого аммиака при нагревании уменьшается.
Примечание: Будьте внимательны! Теплопроводность аммиака в таблицах указана в степени 10 3 . Не забудьте разделить на 1000.
АММИАК [сокращенно от греческого?μμωνιακ?ς; латинский sal ammoniacus; так назывался нашатырь (хлорид аммония), который получали путём сжигания верблюжьего навоза в оазисе Аммониум в Ливийской пустыне], простейшее химическое соединение азота с водородом, NH 3 ; многотоннажный продукт химической промышленности.
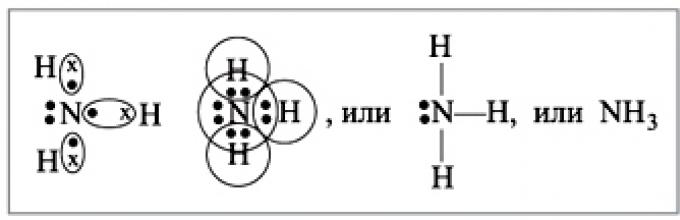
Свойства . Молекула NH 3 имеет форму правильной пирамиды с атомом азота в вершине; связи N—Н полярны, энергия связи N—Н 389,4 кДж/моль. У атома N имеется неподелённая пара электронов, которая обусловливает способность аммиака к образованию донорно-акцепторной и водородной связей. Молекула NH 3 способна к инверсии - «выворачиванию наизнанку» путём прохождения атома азота сквозь образованную атомами водорода плоскость основания пирамиды.
Аммиак - бесцветный газ с резким запахом; t пл -77,7°С; t кип -33,35°С; плотность газообразного NH 3 (при 0°С, 0,1 МПа) 0,7714 кг/м 3 ; теплота образования аммиака из элементов ΔН обр -45,94 кДж/моль. Сухая смесь аммиака с воздухом (15,5-28% по массе NH 3) способна взрываться. Жидкий NH 3 - бесцветная, сильно преломляющая свет жидкость, хороший растворитель для многих органических и неорганических соединений. Аммиак легко растворим в воде (33,1% по массе при 20°С), несколько хуже в спирте, ацетоне, бензоле, хлороформе. Раствор аммиака в воде аммиачная вода - бесцветная жидкость с запахом аммиака; раствор, содержащий 10% по массе NH 3 , имеет торговое название нашатырный спирт. В водном растворе аммиака частично ионизирован на NH + 4 и ОН - , что обусловливает щелочную реакцию раствора (рК 9,247).
Разложение аммиака на водород и азот становится заметным при температуре выше 1200°С, в присутствии катализаторов (Fe, Ni) - выше 400°С. Аммиак весьма реакционно-способное соединение. Для него типичны реакции присоединения, в частности протона при взаимодействии с кислотами. В результате образуются соли аммония, которые по многим свойствам подобны солям щелочных металлов. Аммиак - основание Льюиса, присоединяет не только Н + , но и другие акцепторы электронов, например BF 3 с образованием BF 3 ?NH 3 . Действием NH 3 на простые или комплексные соли металлов получают аммиакаты, например цис-. Для аммиака характерны также реакции замещения. Щелочные и щёлочноземельные металлы образуют с NH 3 амиды (например, NaNH 2). При нагревании в атмосфере аммиака многие металлы и неметаллы (Zn, Cd, Fe, Cr, В, Si и др.) образуют нитриды (например, BN). При температуре около 1000°С NH 3 реагирует с углеродом, образуя циановодород HCN и частично разлагаясь на N 2 и Н 2 . Образует с СО 2 карбамат аммония NH 2 COONH 4 , который при температуре 160-200°С и давлении до 40 МПа распадается на воду и мочевину. Водород в аммиаке может быть замещён галогенами. Аммиак горит в атмосфере О 2 , образуя воду и N 2 . Каталитическим окислением аммиака (катализатор Pt) получают NO (реакцию используют в производстве азотной кислоты), окислением аммиака в смеси с метаном - HCN.
Получение и применение . В природе аммиак образуется при разложении азотсодержащих соединений. В 1774 Дж. Пристли впервые собрал в ртутной ванне аммиак, образующийся при действии извести на хлорид аммония. Старейший промышленный способ получения NH 3 - выделение аммиака из отходящих газов при коксовании угля.
Основной современный способ получения аммиака - синтез его из азота и водорода, предложенный в 1908 Ф. Габером. Синтез аммиака в промышленности осуществляют по реакции N 2 + ЗН 2 →←2NH 3 . Сдвигу равновесия вправо способствуют повышение давления и понижение температуры. Процесс проводят при давлении около 30 МПа и температуре 450-500°С в присутствии катализатора - Fe, активированного оксидами К 2 О, Al 2 О 3 , СаО и др. При однократном прохождении через массу катализатора возможно превращение в аммиак лишь 20-25% исходной газовой смеси; для полного превращения необходима многократная циркуляция. Основное сырьё для получения Н 2 в производстве аммиака - природный горючий газ, перерабатываемый методом двухступенчатой парогазовой конверсии метана.
Производство аммиака включает следующие стадии: очистку природного газа от сернистых соединений каталитическим гидрированием их до Н 2 S с последующим поглощением аммиака ZnO; паровую конверсию природного газа под давлением 3.8 МПа при температуре 860°С на катализаторе Ni-Al в трубчатой печи (первичный риформинг); паровоздушную конверсию остаточного метана в шахтном конвертере (вторичный риформинг) при 990-1000°С и 3,3 МПа на катализаторе Ni-Al; на этом этапе водород обогащается азотом из атмосферного воздуха для получения смеси азота с водородом (соотношение по объёму 1:3), поступающей на синтез NH 3 ; конверсию СО до СО 2 и Н 2 сначала при 450°С и 3,1 МПа на катализаторе Fe-Cr, затем при 200-260°С и 3,0 МПа на катализаторе Zn-Cr-Сu; очистку Н 2 от СО 2 абсорбцией раствором моноэтаноламина или горячим раствором К 2 СО 3 при 2,8 МПа; очистку смеси Н 2 и N 2 путём гидрирования от остаточных СО и СО 2 в присутствии катализатора Ni-Al при 280°С и 2,6 МПа; компримирование (сжатие) очищенного газа до 15-30 МПа и синтез аммиака на железном промотированном катализаторе при 400-500°С в реакторе синтеза с насадкой с радиальным или аксиальным ходом газа. Поставляемый в промышленность жидкий аммиак содержит не менее 99,96% по массе NH 3 . В аммиак, транспортируемый по трубопроводу, добавляется до 0,2-0,4% Н 2 О для ингибирования коррозии стали.
Аммиак применяют в производстве азотной кислоты, мочевины, солей аммония, аммофоса, уротропина, соды (по аммиачному методу), как жидкое удобрение, в качестве хладагента и пр. Пучок молекул NH 3 был использован в качестве рабочего вещества в первом квантовом генераторе - мазере (1954).
Аммиак токсичен. При содержании в воздухе 0,02% аммиака по объёму раздражает слизистые оболочки. Жидкий аммиак вызывает сильные ожоги кожи.
Мировое производство аммиака (в пересчёте на N) около 125,7 миллион тонн/год (2001), в том числе в Российской Федерации - 11 миллион т/год.
Лит.: Теплофизические свойства аммиака. М., 1978; Синтез аммиака. М., 1982.
А. И. Михайличенко, Л. Д. Кузнецов.
Аммиак (NH 3) — один из наиболее распространенных промышленных химикатов, используется в промышленности и торговле.
Аммиак, для чего нужен он нашему организму? Оказывается, он постоянно образуется во всех органах и тканях и является незаменимым веществом во многих биологических процессах, служит предшественником для образования аминокислот и синтеза нуклеотидов. В природе аммиак образуется при разложении азотсодержащих органических соединений.
Химические и физические свойства аммиака
- При комнатной температуре аммиак — раздражающий газ без цвета с острым удушающим запахом;
- в чистом виде известен как безводный аммиак;
- гигроскопичен (легко впитывает влагу);
- обладает щелочными свойствами, едкий легко растворяется в воде;
- легко сжимается и образует прозрачную жидкость под давлением.
Где используется аммиак?
Около 80% аммиака используется для изготовления промышленных товаров.
Аммиак используется в сельском хозяйстве как удобрение.
Присутствует в холодильных установках для очистки водного состава.
Применяется в производстве пластика, взрывчатых веществ, текстиля, пестицидов, красителей и других химических веществ.
Содержится во многих бытовых и промышленных моющих растворах. Бытовые средства, содержащие аммиак, изготавливаются с добавлением 5-10% аммиака, концентрация аммиака в промышленных растворах выше — 25%, что делает их более едкими.
Как аммиак влияет на человеческий организм?
Большинство людей контактируют с аммиаком, вдыхая его как газ или испарения. Поскольку аммиак существует в природе и имеется в моющих средствах, они могут быть его источниками.
Широкое использование аммиака в сельскохозяйственных и промышленных районах также означает, что повышение его концентрации в воздухе может произойти во время случайных выбросов или преднамеренных терактов.
Безводный газообразный аммиак легче воздуха и поэтому высоко поднимается, поэтому в целом он рассеивается и не накапливается в низинах. Однако при наличии сырости (повышенная относительная влажность) сжиженный безводный аммиак формирует испарения тяжелее воздуха. Эти пары могут разноситься над поверхностью земли или над низинами.
Как действует аммиак?
Аммиак начинает взаимодействовать сразу после контакта с влагой на поверхности кожи, глаз, рта, дыхательных путей и частично слизистых поверхностей и формирует очень едкий гидроксид аммония . Гидроксид аммония вызывает некроз тканей из-за нарушения клеточных мембран, ведет к разрушению клеток. Как только протеин и клетки распадаются, вода извлекается в результате воспалительной реакции, что приводит к дальнейшему повреждению.
Каковы симптомы отравления аммиаком?
Дыхание . Запах аммиака в носу раздражающий и едкий. Контакт с аммиаком высокой концентрации в воздухе приводит к жжению в носу, горле и дыхательных путях. Это может привести к бронхиолярному и альвеолярному отеку и поражению дыхательных путей в результате дыхательной недостаточности. Вдыхание низкой концентрации может вызвать кашель, раздражение носа и горла. Запах аммиака достаточно рано предупреждает о его присутствии, но аммиак также ведет к ослаблению обоняния, что снижает возможность заметить его в воздухе при низкой концентрации.
Дети, подвергающиеся воздействию такого же количества аммиака, как и взрослые, получают бОльшую дозу, так как поверхность их легких относительно тела гораздо больше. К тому же, они могут сильнее подвергаться воздействию аммиака из-за низкого роста — они находятся ближе к земле, где концентрация паров выше.
Контакт с кожей или глазами . Контакт с аммиаком низкой концентрации в воздухе или жидкостях может вызвать быстрое раздражение глаз или кожи. Более высокие концентрации аммиака могут привести к серьезным травмам и ожогам . Контакт с концентрированными аммиачными жидкостями, такими как промышленные моющие средства, может вызвать коррозионные повреждения, включая ожоги кожи, поражение глаз или слепоту . Высшая степень поражения глаза может не быть видимой в течение недели после контакта. Контакт со сжиженным аммиаком может также вызвать отморожения .
Употребление с пищей . Получение высокой концентрации аммиака через глотание раствора с аммиаком может привести к повреждениям рта, горла и желудка.
Аммиак – NH 3
Аммиак
(в европейских языках его название звучит как «аммониак») своим
названием обязан оазису Аммона в Северной Африке, расположенному на
перекрестке караванных путей. В жарком климате мочевина (NH 2) 2 CO,
содержащаяся в продуктах жизнедеятельности животных, разлагается
особенно быстро. Одним из продуктов разложения и является аммиак. По
другим сведениям, аммиак получил своё название от древнеегипетского
слова амониан
. Так называли людей, поклоняющихся богу Амону. Они во время своих ритуальных обрядов нюхали нашатырь NH 4 Cl, который при нагревании испаряет аммиак.
1. Строение молекулы


Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине . Три неспаренныхp-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH 4 + .
Вид химической связи: ковалентная полярная, три одинарные σ - сигма связи N-H
2. Физические свойства аммиака
При нормальных условиях - бесцветный газ с резким характерным запахом (запах нашатырного спирта), почти вдвое легче воздуха, ядовит. По физиологическому действию на организм относится к группе веществ удушающего и нейротропного действия, способных при ингаляционном поражении вызвать токсический отёк лёгких и тяжёлое поражение нервной системы. Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это мы и воспринимаем как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. Растворимость NH 3 в воде чрезвычайно велика - около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
3.
|
В лаборатории |
В промышленности |
|
Для получения аммиака в лаборатории используют действие сильных щелочей на соли аммония: NH 4 Cl + NaOH = NH 3 + NaCl + H 2 O (NH 4) 2 SO 4 + Ca(OH) 2 = 2NH 3 + CaSO 4 + 2H 2 O Внимание ! Гидроксид аммония неустойчивое основание, разлагается: NH 4 OH ↔ NH 3 + H 2 O При получении аммиака держите пробирку - приёмник дном кверху, так как аммиак легче воздуха: |
Промышленный способ получения аммиака основан на прямом взаимодействии водорода и азота: N 2(г) + 3H 2(г) ↔ 2NH 3(г) + 45,9к Дж Условия: катализатор – пористое железо температура – 450 – 500 ˚С давление – 25 – 30 МПа Это так называемый процесс Габера (немецкий физик, разработал физико-химические основы метода). |
4. Химические свойства аммиака
Для аммиака характерны реакции:
- с изменением степени окисления атома азота (реакции окисления)
- без изменения степени окисления атома азота (присоединение)
|
Реакции с изменением степени окисления атома азота (реакции окисления) N -3 → N 0 → N +2 NH 3 – сильный восстановитель. |
|
с кислородом 1. Горение аммиака (при нагревании) 4 NH 3 + 3 O 2 → 2 N 2 + 6 H 2 0 2. Каталитическое окисление амииака (катализатор Pt – Rh , температура) 4NH 3 + 5O 2 → 4NO + 6H 2 O Видео - Эксперимент " Окисление аммиака в присутствии оксида хрома" |
|
с оксидами металлов 2 NH 3 + 3CuO = 3Cu + N 2 + 3 H 2 O |
|
с сильными окислителями 2 NH 3 + 3 Cl 2 = N 2 + 6 HCl (при нагревании) |
|
аммиак – непрочное соединение, при нагревании разлагается 2NH 3 ↔ N 2 + 3H 2 |
|
Реакции без изменения степени окисления атома азота (присоединение - Образование иона аммония NH 4 + по донорно-акцепторному механизму) Видео - Эксперимент "Качественная реакция на аммиак" Видео - Эксперимент "Дым без огня" Видео - Эксперимент "Взаимодействие аммиака с концентрированными кислотами" Видео - Эксперимент "Фонтан" Видео - Эксперимент "Растворение аммиака в воде" |
5. Применение аммиака
По объемам производства аммиак занимает одно из первых мест; ежегодно во всем мире получают около 100 миллионов тонн этого соединения. Аммиак выпускается в жидком виде или в виде водного раствора – аммиачной воды, которая обычно содержит 25% NH 3 . Огромные количества аммиака далее используются для получения азотной кислоты , которая идет на производство удобрений и множества других продуктов. Аммиачную воду применяют также непосредственно в виде удобрения, а иногда поля поливают из цистерн непосредственно жидким аммиаком. Из аммиака получают различные соли аммония, мочевину, уротропин . Его применяют также в качестве дешевого хладагента в промышленных холодильных установках.
Аммиак используется также для получения синтетических волокон , например, найлона и капрона. В легкой промышленности он используется при очистке и крашении хлопка, шерсти и шелка . В нефтехимической промышленности аммиак используют для нейтрализации кислотных отходов, а в производстве природного каучука аммиак помогает сохранить латекс в процессе его перевозки от плантации до завода. Аммиак используется также при производстве соды по методу Сольве. В сталелитейной промышленности аммиак используют для азотирования – насыщения поверхностных слоев стали азотом, что значительно увеличивает ее твердость.
Медики используют водные растворы аммиака (нашатырный спирт) в повседневной практике: ватка, смоченная в нашатырном спирте, выводит человека из обморочного состояния. Для человека аммиак в такой дозе не опасен.
ТРЕНАЖЁРЫ
Тренажёр №1 "Горение аммиака"
Тренажёр №2 "Химические свойства аммиака"
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Осуществить превращения по схеме:
а) Азот→ Аммиак → Оксид азота (II)
б) Нитрат аммония → Аммиак → Азот
в) Аммиак → Хлорид аммония → Аммиак → Сульфат аммония
Для ОВР составить е-баланс, для РИО полные, ионные уравнения.№2. Напишите четыре уравнения химических реакций, в результате которых образуется аммиак.
Многие медицинские средства могут использоваться как для лечебных, так и для хозяйственных целей, например, раствор нашатырного спирта часто применяют, чтобы уничтожить вредителей или для очистки мебельной обивки из кожи. Кроме того, таким веществом можно обрабатывать садовые растения, использовать для подкормки огурцов, а также при чистке серебра, золота, предметов сантехники.
Что такое нашатырный спирт
Водный раствор аммиака или нашатырный спирт (NH4OH, гидроксид или моногидрат аммиака) – это прозрачная бесцветная жидкость с резким запахом, которая применяется как лекарственное средство и для бытовых нужд. В большом количестве NH4OH ядовит, но малую дозу препарата можно использовать как возбуждающее и раздражающее средство. Основное применение спирта – это медицина. С его помощью можно привести в чувства человека при обмороке, хирурги обрабатывают им руки перед операцией. Кроме того, этот препарат нашел широкое применение в косметологии.
Состав
Часто людей интересует вопрос, в каких ситуациях применяется нашатырный спирт и что такое аммиак. Химическое соединение нитрид водорода или аммиак представляет собой бесцветный газ с резким запахом. Получают его при высокой температуре с помощью катализатора из азота воздуха и водорода. При добавлении воды получается раствор нашатырного спирта. Гидроксид аммония или аммиачная настойка имеет острый запах, обладает щелочной сильной реакцией. Состав нашатырного спирта включает 10 % водного раствора аммиака.
Формула
Многие люди ошибочно считают, что нашатырный спирт, аммиак, нашатырь, перекись водорода – это похожие вещества, но это не так. Некоторые из препаратов могут иметь одинаковый запах, хотя при этом химическая формула, способ получения разные. Рассматриваемый спирт в отличие от газа аммиака, является бесцветной жидкостью с резким запахом. Данное вещество имеет формулу: NH4OH. Редко можно встретить еще такую – NH3∙H2O. Такая запись используется для 10% раствора.
Чем отличается аммиак от нашатырного спирта
Основным отличием NH4OH от нитрида водорода является их агрегатное первоначальное состояние. Аммиак – бесцветный газ, который сжижается при -33 градусах Цельсия. Нашатырный спирт – это жидкость, которую часто называют раствором аммиака. Различием веществ является и область их применения. Аммиак – основной продукт, используемый в химической промышленности. Этот газ часто берут:
- при производстве спирта;
- как хладагент для поддержания работы промышленных, бытовых систем;
- для производства удобрений, полимеров, азотной кислоты, соды;
- при строительстве;
- для изготовления взрывчатых веществ.
Моногидрат аммиака имеет более узкое использование, преимущественно как медицинский антисептик. Кроме того, раствор часто применяют домохозяйки для выведения пятен с одежды, для очищения золота и серебра, как подкорму для садовых и комнатных растений. Основным сходством этих средств считается то, что они способны неприятно пахнуть из-за большого содержания аммиачных солей.
Свойства нашатырного спирта
Во время процесса дыхания пары гидроксида аммиака попадают внутрь организма, при этом вещество активно начинает взаимодействовать с тройничным нервом, при этом рефлекторно возбуждая дыхательный центр. Концентрированный раствор способен вызывать колликвацию (растворение, размягчение) белков микробных клеток. Средство еще часто применяется как скорая помощь для возбуждения дыхания и выведения человека из обморочного состояния. Кроме того, аммиачный раствор:
- при наружном применении улучшает регенерацию тканей, расширяет сосуды, стимулирует отток метаболитов;
- обладает антисептическим действием;
- оказывает раздражающее воздействие на экстерорецепторы кожи;
- блокируют поток болевых импульсов из патологических очагов;
- провоцирует местное высвобождение кининов, простагландинов;
- влияет на деятельность сердца и тонус сосудистых стенок;
- снижает гипералгезию, напряжение мышц, спазмы, оказывая отвлекающее действие;
- при вдыхании препарата происходит увеличение кровяного давления;
- подавляет очаги возбуждения;
- способствует быстрому выходу мокроты;
- воздействуя на рвотный центр, повышает возбудимость;
- прием внутрь в малых дозах стимулирует секрецию желез.

Применение
Раствор аммиака часто используется как лекарство и для бытовых нужд. В медицине средство применяют для выведения из обморока, возбуждения дыхания. При укусах насекомых делают примочки со средством, при невралгиях растирают больное место. Наружно используется спирт для обеззараживания рук врачей перед операцией. Инструкция по применению препарата указывает, что доза вещества должна подбираться индивидуально, исходя из показаний.
Применение в быту
Аммиачная вода полезна при выведении пятен с мягкой мебели, одежды. Чтобы очистить любимую вещь, текстильную обувь или обивку, необходимо пару чайных ложек средства соединить со стаканом воды и залить получившимся раствором пятно на несколько минут. Затем прополоскать прохладной водой. Запах быстро выветрится, пятна моментально исчезнут.
При выведении тараканов тоже хорошо помогает моногидрат аммиака. Для этого следует немного средства добавить в ведро с водой при мытье пола, мебели и стен (на литр воды примерно 1 ч. л.). Резкий запах прогонит незваных гостей, особенно если процедуру делать раз в неделю. Чтобы отдых на природе не был испорчен укусами комаров и мошки, необходимо взять с собой раствор аммиака и разбрызгать его вокруг. После данной обработки насекомые уже не побеспокоят.
Для очистки серебряных, золотых изделий, предметов сантехники тоже подходит раствор аммиака. Чтобы избавиться от неприятного черного налета, необходимо взять воду, зубной порошок, моногидрат аммиака в соотношении 5:2:1. Далее изделие следует протереть мягкой тканью или марлей, смоченной в растворе. После этого ополоснуть водой, вытереть насухо. Украшения с драгоценными камнями и жемчугом не стоит чистить таким способом.
Для комнатных цветов
Применение раствора аммиака для растений основано на большом содержании в нем азота и отсутствии балластных веществ. Препарат в разбавленном виде – это идеальная подкормка для домашних цветов. Чтобы приготовить самое простое удобрение с NH4OH, необходимо растворить одну столовую ложку вещества в трех литрах воды. Полученным раствором необходимо поливать растения под корень. Если домашние цветы поразила тля, необходимо их вынести на балкон и опрыскать раствором из пятнадцати миллилитров спирта, трех литров воды и двух капель шампуня.
В огороде
Раствор аммиака является незаменимым помощником на дачном участке. Часто препарат используют для восполнения недостатка азота и в качестве профилактики болезней деревьев, растений, кустарников, ягод. Для подкормки понадобиться 4 л воды и 50 мл раствора. Проводить полив растений таким составом следует с момента посадки и до конца июня. Средство еще отлично отпугивает комаров, тлю, мошку. В хозяйстве применяется лишь технический раствор спирта 25%.
Аммиак для растений – это отличная подкормка. Хорошим урожаем отзовутся на раствор кустарники: слива, вишня, ежевика, малина. Вещество необходимо использовать для увеличения роста, в период цветения. Больше всего азота потребляет капуста, кабачки, лук, тыква, перец, картофель, баклажаны. Существуют культуры, которым в умеренном количестве нужен азот: огурцы, томаты, свекла, чеснок, кукуруза, кусты крыжовника и смородины.

Применение в медицине
Аммиачный раствор часто используют для приведения человека в чувства и при обмороке. Кроме того, применение нашатырного спирта в медицине возможно при:
- отравлениях (пищевых, алкогольных, токсических);
- невралгии;
- укусах насекомых;
- головной, зубной боли;
- похмелье;
- миозите;
- суставной боли;
- отите;
- грибке ногтей.
В косметологии моногидрат аммиака тоже нашел широкое применение. Если использовать вещество вместе с глицерином, то это будет отличное средство для сухой кожи ног, локтей, рук. Лосьон на основе данных ингредиентов помогает быстро вернуть мягкость, избавиться от трещин. Средство отлично подходит и для лечения волос, его можно применять в качестве ополаскивателя после использования шампуня. Для этого надо чайную ложку спирта растворить в стакане теплой воды.
Инструкция по применению
Чтобы привести в чувства человека, упавшего в обморок, нужно на ватку налить немного аммиачного раствора и поднести ее к носу на расстояние 5 см. Близкое вдыхание средства запрещено, т.к. это может вызвать ожог слизистой носа. При укусе насекомых нужно делать примочки. Чтобы с помощью препарата вызвать рвоту, следует взять аммиак в ампулах, налить 10 капель средства в 100 мл теплой воды и дать выпить внутрь больному. При мокром кашле врач может назначить ингаляции, но лишь через специальный прибор.

Правила применения
Раствор аммиака – это токсическое вещество, поэтому при его неправильном использовании может возникнуть рефлекторная остановка дыхания, ожог желудка (при приеме неразведенного препарата). Как правило, средство применяют ингаляционно, местно и внутрь. В хирургической практике им моют руки. При продолжительном воздействии препарата на организм, могут появиться некробиотические и воспалительные изменения в тканях.
Перед использованием вещества, следует тщательно ознакомиться с инструкцией или проконсультироваться со специалистом. При случайном повреждении емкости с препаратом следует быстро открыть окно и проветрить помещение. При попадании на слизистые оболочки и в глаза нужно промыть пораженные участки большим количеством проточной воды и обратиться за помощью к врачу.
Аммиак от прыщей
Раствор аммиака – отличное средство при жирной коже лица, которая склонна к возникновению прыщей и черных точек. Он может использоваться для умывания. При этом необходимо половину чайной ложки вещества развести стаканом теплой воды. Кроме того, проблемные участки можно протирать раствором гидроксида аммиака с концентрацией 1-2 % с помощью ватного тампона.
Меры предосторожности
Используя гидроксид аммиака в медицине или для дома, необходимо соблюдать осторожность и применять индивидуальные средства защиты. Кроме того, надо следовать правилам:
- по возможности нанесение вещества на растения необходимо осуществлять в маске и резиновых перчатках;
- спирт нельзя смешивать с другими активными веществами;
- нельзя работать с препаратом людям, страдающим вегетососудистой дистонией;
- если неразведенный раствор попал внутрь, необходимо срочно выпить много воды, вызвать рвотный рефлекс и обратиться за помощью к врачу;
- хранить препарат нужно в закрытых местах;
- следует избегать попадания гидроксида аммиака на кожу лица;
- разводить состав следует на воздухе или на территории хорошо проветриваемого помещения.
Цена
Многих людей часто интересует, сколько стоит нашатырный спирт в аптеке? Как правило, средняя стоимость препарата колеблется от 13 до 60 рублей. Его разливают по флаконам объемом 40 миллилитров. Нашатырный спирт можно найти в продаже под названием раствор аммиака 10 процентный. Продаваться вещество может оптом и в розницу. Крупные поставки осуществляют тоннами. Хранить средство рекомендуется в прохладном месте. На полках аптек в Москве можно найти раствор по таким ценам:
Видео