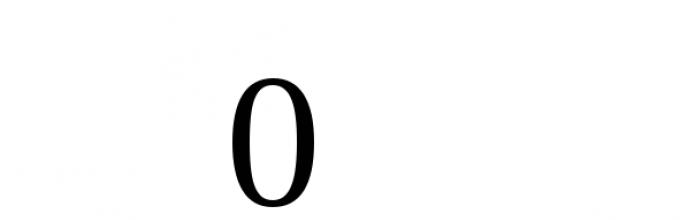Для характеристики окислительно-восстановительной способности частиц важное значение имеет такое понятие, как степень окисления. СТЕПЕНЬ ОКИСЛЕНИЯ – это заряд, который мог бы возникнуть у атома в молекуле или ионе, если бы все его связи с другими атомами оказались разорваны, а общие электронные пары ушли с более электроотрицательными элементами.
В отличие от
реально существующих зарядов у ионов,
степень окисления показывает лишь
условный заряд атома в молекуле. Она
может быть отрицательной, положительной
и нулевой. Например, степень окисления
атомов в простых веществах равна «0»
(, ,
, ,
, ).
В химических соединениях атомы могут
иметь постоянную степень окисления или
переменную. У металлов главных подгруппI,
II
и III
групп Периодической системы в химических
соединениях степень окисления, как
правило, постоянна и равна соответственно
Ме +1 ,
Ме +2
и Ме +3
(Li + ,
Ca +2 ,
Al +3).
У атома фтора всегда -1. У хлора в
соединениях с металлами всегда -1. В
подавляющем числе соединений кислород
имеет степень окисления -2 (кроме
пероксидов, где его степень окисления
-1), а водород +1(кроме гидридов металлов,
где его степень окисления -1).
).
В химических соединениях атомы могут
иметь постоянную степень окисления или
переменную. У металлов главных подгруппI,
II
и III
групп Периодической системы в химических
соединениях степень окисления, как
правило, постоянна и равна соответственно
Ме +1 ,
Ме +2
и Ме +3
(Li + ,
Ca +2 ,
Al +3).
У атома фтора всегда -1. У хлора в
соединениях с металлами всегда -1. В
подавляющем числе соединений кислород
имеет степень окисления -2 (кроме
пероксидов, где его степень окисления
-1), а водород +1(кроме гидридов металлов,
где его степень окисления -1).
Алгебраическая сумма степеней окисления всех атомов в нейтральной молекуле равна нулю, а в ионе – заряду иона. Эта взаимосвязь позволяет рассчитывать степени окисления атомов в сложных соединениях.
В молекуле серной
кислоты H 2 SO 4
атом водорода имеет степень окисления
+1, а атом кислорода -2. Так как атомов
водорода два, а атомов кислорода четыре,
то мы имеем два «+» и восемь «-». До
нейтральности не хватает шесть «+».
Именно это число и является степенью
окисления серы -
 .
Молекула дихромата калияK 2 Cr 2 O 7
состоит из двух атомов калия, двух атомов
хрома и семи атомов кислорода. У калия
степень окисления всегда +1, у кислорода
-2. Значит, мы имеем два «+» и четырнадцать
«-». Оставшиеся двенадцать «+» приходятся
на два атома хрома, у каждого из которых
степень окисления равна +6 (
.
Молекула дихромата калияK 2 Cr 2 O 7
состоит из двух атомов калия, двух атомов
хрома и семи атомов кислорода. У калия
степень окисления всегда +1, у кислорода
-2. Значит, мы имеем два «+» и четырнадцать
«-». Оставшиеся двенадцать «+» приходятся
на два атома хрома, у каждого из которых
степень окисления равна +6 ( ).
).
Типичные окислители и восстановители
Из определения процессов восстановления и окисления следует, что, в принципе, в роли окислителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в низшей степени окисления и поэтому могут понижать свою степень окисления. Аналогично в роли восстановителей могут выступать простые и сложные вещества, содержащие атомы, которые находятся не в высшей степени окисления и поэтому могут повышать свою степень окисления.
К наиболее сильным окислителям относятся:
1) простые вещества, образуемые атомами, имеющими большую электроотрицательность, т.е. типичные неметаллы, расположенные в главных подгруппах шестой и седьмой групп периодической системы: F, O, Cl, S (соответственно F 2 , O 2 , Cl 2 , S);
2) вещества, содержащие элементы в высших и промежуточных
положительных степенях окисления, в том числе в виде ионов, как простых, элементарных (Fe 3+), так и кислородосодержащих, оксоанионов (перманганат-ион - MnO 4 -);
3) перекисные соединения.
Конкретными
веществами, применяемыми на практике
в качестве окислителей, являются кислород
и озон, хлор, бром, перманганаты, дихроматы,
кислородные кислоты хлора и их соли
(например,
 ,
, ,
, ),
азотная кислота (
),
азотная кислота ( ),
концентрированная серная кислота
(
),
концентрированная серная кислота
( ),
диоксид марганца (
),
диоксид марганца ( ),
пероксид водорода и пероксиды металлов
(
),
пероксид водорода и пероксиды металлов
( ,
, ).
).
К наиболее сильным восстановителям относятся:
1)простые вещества, атомы которых имеют низкую электроотрицательность («активные металлы»);
2) катионы металлов в низжих степенях окисления (Fe 2+);
3) простые элементарные анионы, например, сульфид-ион S 2- ;
4) кислородосодержащие
анионы (оксоанионы), соответствующие
низшим положительным степеням окисления
элемента (нитрит
 ,
сульфит
,
сульфит ).
).
Конкретными
веществами, применяемыми на практике
в качестве восстановителей, являются,
например, щелочные и щелочноземельные
металлы, сульфиды, сульфиты, галогенводороды
(кроме HF),
органические вещества – спирты,
альдегиды, формальдегид, глюкоза,
щавелевая кислота, а также водород,
углерод, моноксид углерода ( )
и алюминий при высоких температурах.
)
и алюминий при высоких температурах.
В принципе, если в состав вещества входит элемент в промежуточной степени окисления, то эти вещества могут проявлять как окислительные, так и восстановительные свойства. Все зависит от
«партнера» по реакции: с достаточно сильным окислителем оно может реагировать как восстановитель, а с достаточно сильным восстановителем – как окислитель. Так, например, нитрит-ион NO 2 - в кислой среде выступает в роли окислителя по отношению к иону I - :
2 +
2
+
2 + 4HCl→
+ 4HCl→
 +
2
+
2 + 4KCl
+ 2H 2 O
+ 4KCl
+ 2H 2 O
и в роли восстановителя по отношению к перманганат-иону MnO 4 -
5 +
2
+
2 + 3H 2 SO 4
→ 2
+ 3H 2 SO 4
→ 2 +
5
+
5 +K 2 SO 4
+ 3H 2 O
+K 2 SO 4
+ 3H 2 O
Как определить степень окисления? Таблица Менделеева позволяет записывать данную количественную величину для любого химического элемента.
Определение
Для начала попробуем понять, что представляет собой данный термин. Степень окисления по таблице Менделеева представляет собой количество электронов, которые приняты либо отданы элементом в процессе химического взаимодействия. Она может принимать отрицательное и положительное значение.
Связь с таблицей
Как определяется степень окисления? Таблица Менделеева состоит из восьми групп, расположенных вертикально. В каждой из них есть две подгруппы: главная и побочная. Для того чтобы установить показатели для элементов, необходимо использовать определенные правила.

Инструкция
Как рассчитать степени окисления элементов? Таблица позволяет в полной мере справиться с подобной проблемой. Щелочные металлы, которые располагаются в первой группе (главной подгруппе), степень окисления проявляют в соединениях, она соответствует +, равна их высшей валентности. У металлов второй группы (подгруппы А) +2 степень окисления.
Таблица позволяет определить данную величину не только у элементов, проявляющих металлические свойства, но и у неметаллов. Их максимальная величина будет соответствовать высшей валентности. Например, для серы она составит +6, для азота +5. Как вычисляется у них минимальная (низшая) цифра? Таблица отвечает и на этот вопрос. Необходимо вычесть номер группы из восьми. Например, у кислорода она составит -2, у азота -3.
Для простых веществ, которые не вступали в химическое взаимодействие с другими веществами, определяемый показатель считается равным нулю.
Попробуем выявить основные действия, касающиеся расстановки в бинарных соединениях. Как поставить в них степень окисления? Таблица Менделеева помогает решить проблему.
Для примера возьмем оксид кальция СаО. Для кальция, расположенного в главной подгруппе второй группы, величина будет являться постоянной, равной +2. У кислорода, имеющего неметаллические свойства, данный показатель будет являться отрицательной величиной, и он соответствует -2. Для того чтобы проверить правильность определения, суммируем полученные цифры. В итоге мы получим ноль, следовательно, вычисления верны.
Определим подобные показатели еще в одном бинарном соединении CuO. Так как медь располагается в побочной подгруппе (первой группе), следовательно, изучаемый показатель может проявлять разные значения. Поэтому для его определения необходимо сначала выявить показатель для кислорода.
У неметалла, располагающегося в конце бинарной формулы, степень окисления имеет отрицательное значение. Так как этот элемент располагается в шестой группе, при вычитании из восьми шести получаем, что степень окисления у кислорода соответствует -2. Так как в соединении отсутствуют индексы, следовательно, показатель степени окисления у меди будет положительным, равным +2.
Как еще используется химическая таблица? Степени окисления элементов в формулах, состоящих из трех элементов, также вычисляются по определенному алгоритму. Сначала расставляют эти показатели у первого и последнего элемента. Для первого этот показатель будет иметь положительное значение, соответствовать валентности. У крайнего элемента, в качестве которого выступает неметалл, данный показатель имеет отрицательное значение, он определяется в виде разности (от восьми отнимают номер группы). При вычислении степени окисления у центрального элемента используют математическое уравнение. При расчетах учитывают индексы, имеющиеся у каждого элемента. Сумма всех степеней окисления должна быть равна нулю.

Пример определения в серной кислоте
Формула данного соединения имеет вид H 2 SO 4 . У водорода степень окисления составит +1, у кислорода она равна -2. Для определения степени окисления у серы, составим математическое уравнение: + 1 * 2 + Х + 4 * (-2) = 0. Получаем, что степень окисления у серы соответствует +6.

Заключение
При использовании правил можно расставлять коэффициенты в окислительно-восстановительных реакциях. Данный вопрос рассматривается в курсе химии девятого класса школьной программы. Кроме того, информация о степенях окисления позволяет выполнять задания ОГЭ и ЕГЭ.
Валентность является сложным понятием. Этот термин претерпел значительную трансформацию одновременно с развитием теории химической связи. Первоначально валентностью называли способность атома присоединять или замещать определённое число других атомов или атомных групп с образованием химической связи.
Количественной мерой валентности атома элемента считали число атомов водорода или кислорода (данные элементы считали соответственно одно- и двухвалентными), которые элемент присоединяет, образуя гидрид формулы ЭH x или оксид формулы Э n O m .
Так, валентность атома азота в молекуле аммиака NH 3 равна трём, а атома серы в молекуле H 2 S равна двум, поскольку валентность атома водорода равна одному.
В соединениях Na 2 O, BaO, Al 2 O 3 , SiO 2 валентности натрия, бария и кремния соответственно равны 1, 2, 3 и 4.
Понятие о валентности было введено в химию до того, как стало известно строение атома, а именно в 1853 году английским химиком Франклендом. В настоящее время установлено, что валентность элемента тесно связана с числом внешних электронов атомов, поскольку электроны внутренних оболочек атомов не участвуют в образовании химических связей.
В электронной теории ковалентной связи считают, что валентность атома определяется числом его неспаренных электронов в основном или возбуждённом состоянии, участвующих в образовании общих электронных пар с электронами других атомов.
Для некоторых элементов валентность является величиной постоянной. Так, натрий или калий во всех соединениях одновалентны, кальций, магний и цинк - двухвалентны, алюминий - трёхвалентен и т. д. Но большинство химических элементов проявляют переменную валентность, которая зависит от природы элемента - партнёра и условий протекания процесса. Так, железо может образовывать с хлором два соединения - FeCl 2 и FeCl 3 , в которых валентность железа равна соответственно 2 и 3.
Степень окисления - понятие, характеризующее состояние элемента в химическом соединении и его поведение в окислительно-восстановительных реакциях; численно степень окисления равна формальному заряду, который можно приписать элементу, исходя из предположения, что все электроны каждой его связи перешли к более электроотрицательному атому.
Электроотрицательность - мера способности атома к приобретению отрицательного заряда при образовании химической связи или способность атома в молекуле притягивать к себе валентные электроны, участвующие в образовании химической связи. Электроотрицательность не является абсолютной величиной и рассчитывается различными методами. Поэтому приводимые в разных учебниках и справочниках значения электроотрицательности могут отличаться.
В таблице 2 приведена электроотрицательность некоторых химических элементов по шкале Сандерсона, а в таблице 3 - электроотрицательность элементов по шкале Полинга.
Значение электроотрицательности приведено под символом соответствующего элемента. Чем больше численное значение электроотрицательности атома, тем более электроотрицательным является элемент. Наиболее электроотрицательным является атом фтора, наименее электроотрицательным - атом рубидия. В молекуле, образованной атомами двух разных химических элементов, формальный отрицательный заряд будет у атома, численное значение электроотрицательности у которого будет выше. Так, в молекуле диоксида серы SO 2 электроотрицательность атома серы равна 2,5, а значение электроотрицательности атома кислорода больше - 3,5. Следовательно, отрицательный заряд будет на атоме кислорода, а положительный - на атоме серы.
В молекуле аммиака NH 3 значение электроотрицательности атома азота равно 3,0, а водорода - 2,1. Поэтому отрицательный заряд будет у атома азота, а положительный - у атома водорода.
Следует чётко знать общие тенденции изменения электроотрицательности. Поскольку атом любого химического элемента стремится приобрести устойчивую конфигурацию внешнего электронного слоя - октетную оболочку инертного газа, то электроотрицательность элементов в периоде увеличивается, а в группе электроотрицательность в общем случае уменьшается с увеличением атомного номера элемента. Поэтому, например, сера более электроотрицательна по сравнению с фосфором и кремнием, а углерод более электроотрицателен по сравнению с кремнием.
При составлении формул соединений, состоящих из двух неметаллов, более электроотрицательный из них всегда ставят правее: PCl 3 , NO 2 . Из этого правила есть некоторые исторически сложившиеся исключения, например NH 3 , PH 3 и т.д.
Степень окисления обычно обозначают арабской цифрой (со знаком перед цифрой), расположенной над символом элемента, например:
Для определения степени окисления атомов в химических соединениях руководствуются следующими правилами:
- Степень окисления элементов в простых веществах равна нулю.
- Алгебраическая сумма степеней окисления атомов в молекуле равна нулю.
- Кислород в соединениях проявляет главным образом степень окисления, равную –2 (во фториде кислорода OF 2 + 2, в пероксидах металлов типа M 2 O 2 –1).
- Водород в соединениях проявляет степень окисления + 1, за исключением гидридов активных металлов, например, щелочных или щёлочноземельных, в которых степень окисления водорода равна – 1.
- У одноатомных ионов степень окисления равна заряду иона, например: K + - +1, Ba 2+ - +2, Br – - –1, S 2– - –2 и т. д.
- В соединениях с ковалентной полярной связью степень окисления более электроотрицательного атома имеет знак минус, а менее электроотрицательного - знак плюс.
- В органических соединениях степень окисления водорода равна +1.
Проиллюстрируем вышеприведённые правила несколькими примерами.
Пример 1. Определить степень окисления элементов в оксидах калия K 2 O, селена SeO 3 и железа Fe 3 O 4 .
Оксид калия K 2 O. Алгебраическая сумма степеней окисления атомов в молекуле равна нулю. Степень окисления кислорода в оксидах равна –2. Обозначим степень окисления калия в его оксиде за n, тогда 2n + (–2) = 0 или 2n = 2, отсюда n = +1, т. е. степень окисления калия равна +1.
Оксид селена SeO 3 . Молекула SeO 3 электронейтральна. Суммарный отрицательный заряд трёх атомов кислорода составляет –2 × 3 = –6. Следовательно, чтобы уравнять этот отрицательный заряд до ноля, степень окисления селена должна быть равна +6.
Молекула Fe 3 O 4 электронейтральна. Суммарный отрицательный заряд четырёх атомов кислорода составляет –2 × 4 = –8. Чтобы уравнять этот отрицательный заряд, суммарный положительный заряд на трёх атомах железа должен быть равен +8. Следовательно, на одном атоме железа должен быть заряд 8/3 = +8/3.
Следует подчеркнуть, что степень окисления элемента в соединении может быть дробным числом. Такие дробные степени окисления не имеют смысла при объяснении связи в химическом соединении, но могут быть использованы для составления уравнений окислительно-восстановительных реакций.
Пример 2. Определить степень окисления элементов в соединениях NaClO 3 , K 2 Cr 2 O 7 .
Молекула NaClO 3 электронейтральна. Степень окисления натрия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хлора за n, тогда +1 + n + 3 × (–2) = 0, или +1 + n – 6 = 0, или n – 5 = 0, отсюда n = +5. Таким образом, степень окисления хлора равна +5.
Молекула K 2 Cr 2 O 7 электронейтральна. Степень окисления калия равна +1, степень окисления кислорода равна –2. Обозначим степень окисления хрома за n, тогда 2 × 1 + 2n + 7 × (–2) = 0, или +2 + 2n – 14 = 0, или 2n – 12 = 0, 2n = 12, отсюда n = +6. Таким образом, степень окисления хрома равна +6.
Пример 3. Определим степени окисления серы в сульфат-ионе SO 4 2– . Ион SO 4 2– имеет заряд –2. Степень окисления кислорода равна –2. Обозначим степень окисления серы за n, тогда n + 4 × (–2) = –2, или n – 8 = –2, или n = –2 – (–8), отсюда n = +6. Таким образом, степень окисления серы равна +6.
Следует помнить, что степень окисления иногда не равна валентности данного элемента.
Например, степени окисления атома азота в молекуле аммиака NH 3 или в молекуле гидразина N 2 H 4 равны –3 и –2 соответственно, тогда как валентность азота в этих соединениях равна трём.
Максимальная положительная степень окисления для элементов главных подгрупп, как правило, равна номеру группы (исключения: кислород, фтор и некоторые другие элементы).
Максимальная отрицательная степень окисления равна 8 - номер группы.
Тренировочные задания
1. В каком соединении степень окисления фосфора равна +5?
1) HPO 3
2) H 3 PO 3
3) Li 3 P
4) AlP
2. В каком соединении степень окисления фосфора равна –3?
1) HPO 3
2) H 3 PO 3
3) Li 3 PO 4
4) AlP
3. В каком соединении степень окисления азота равна +4?
1) HNO 2
2) N 2 O 4
3) N 2 O
4) HNO 3
4. В каком соединении степень окисления азота равна –2?
1) NH 3
2) N 2 H 4
3) N 2 O 5
4) HNO 2
5. В каком соединении степень окисления серы равна +2?
1) Na 2 SO 3
2) SO 2
3) SCl 2
4) H 2 SO 4
6. В каком соединении степень окисления серы равна +6?
1) Na 2 SO 3
2) SO 3
3) SCl 2
4) H 2 SO 3
7. В веществах, формулы которых CrBr 2 , K 2 Cr 2 O 7 , Na 2 CrO 4 , степень окисления хрома соответственно равна
1) +2, +3, +6
2) +3, +6, +6
3) +2, +6, +5
4) +2, +6, +6
8. Минимальная отрицательная степень окисления химического элемента, как правило, равна
1) номеру периода
3) числу электронов, недостающих до завершения внешнего электронного слоя
9. Максимальная положительная степень окисления химических элементов, расположенных в главных подгруппах, как правило, равна
1) номеру периода
2) порядковому номеру химического элемента
3) номеру группы
4) общему числу электронов в элементе
10. Фосфор проявляет максимальную положительную степень окисления в соединении
1) HPO 3
2) H 3 PO 3
3) Na 3 P
4) Ca 3 P 2
11. Фосфор проявляет минимальную степень окисления в соединении
1) HPO 3
2) H 3 PO 3
3) Na 3 PO 4
4) Ca 3 P 2
12. Атомы азота в нитрите аммония, находящиеся в составе катиона и аниона, проявляют степени окисления соответственно
1) –3, +3
2) –3, +5
3) +3, –3
4) +3, +5
13. Валентность и степень окисления кислорода в перекиси водорода соответственно равны
1) II, –2
2) II, –1
3) I, +4
4) III, –2
14. Валентность и степень окисления серы в пирите FeS2 соответственно равны
1) IV, +5
2) II, –1
3) II, +6
4) III, +4
15. Валентность и степень окисления атома азота в бромиде аммония соответственно равны
1) IV, –3
2) III, +3
3) IV, –2
4) III, +4
16. Атом углерода проявляет отрицательную степень окисления в соединении с
1) кислородом
2) натрием
3) фтором
4) хлором
17. Постоянную степень окисления в своих соединениях проявляет
1) стронций
2) железо
3) сера
4) хлор
18. Степень окисления +3 в своих соединениях могут проявлять
1) хлор и фтор
2) фосфор и хлор
3) углерод и сера
4) кислород и водород
19. Степень окисления +4 в своих соединениях могут проявлять
1) углерод и водород
2) углерод и фосфор
3) углерод и кальций
4) азот и сера
20. Степень окисления, равную номеру группы, в своих соединениях проявляет
1) хлор
2) железо
3) кислород
4) фтор
Чтобы правильно расставлять степени окисления , необходимо держать в голове четыре правила.
1) В простом веществе степень окисления любого элемента равна 0. Примеры: Na 0 , H 0 2 , P 0 4 .
2) Следует запомнить элементы, для которых характерны постоянные степени окисления . Все они перечислены в таблице.
3) Высшая степень окисления элемента, как правило, совпадает с номером группы, в которой находится данный элемент (например, фосфор находится в V группе, высшая с. о. фосфора равна +5). Важные исключения: F, O.
4) Поиск степеней окисления остальных элементов основан на простом правиле:
В нейтральной молекуле сумма степеней окисления всех элементов равна нулю, а в ионе - заряду иона.
Несколько простых примеров на определение степеней окисления
Пример 1 . Необходимо найти степени окисления элементов в аммиаке (NH 3).
Решение . Мы уже знаем (см. 2), что ст. ок. водорода равна +1. Осталось найти эту характеристику для азота. Пусть х - искомая степень окисления. Составляем простейшее уравнение: х + 3 (+1) = 0. Решение очевидно: х = -3. Ответ: N -3 H 3 +1 .
Пример 2 . Укажите степени окисления всех атомов в молекуле H 2 SO 4 .
Решение . Степени окисления водорода и кислорода уже известны: H(+1) и O(-2). Составляем уравнение для определения степени окисления серы: 2 (+1) + х + 4 (-2) = 0. Решая данное уравнение, находим: х = +6. Ответ: H +1 2 S +6 O -2 4 .
Пример 3 . Рассчитайте степени окисления всех элементов в молекуле Al(NO 3) 3 .
Решение . Алгоритм остается неизменным. В состав "молекулы" нитрата алюминия входит один атом Al(+3), 9 атомов кислорода (-2) и 3 атома азота, степень окисления которого нам и предстоит вычислить. Соответствующее уравнение: 1 (+3) + 3х + 9 (-2) = 0. Ответ: Al +3 (N +5 O -2 3) 3 .
Пример 4 . Определите степени окисления всех атомов в ионе (AsO 4) 3- .
Решение . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е., -3. Уравнение: х + 4 (-2) = -3. Ответ: As(+5), O(-2).
Что делать, если неизвестны степени окисления двух элементов
А можно ли определить степени окисления сразу нескольких элементов, пользуясь похожим уравнением? Если рассматривать данную задачу с точки зрения математики, ответ будет отрицательным. Линейное уравнение с двумя переменными не может иметь однозначного решения. Но ведь мы решаем не просто уравнение!
Пример 5 . Определите степени окисления всех элементов в (NH 4) 2 SO 4 .
Решение . Степени окисления водорода и кислорода известны, серы и азота - нет. Классический пример задачи с двумя неизвестными! Будем рассматривать сульфат аммония не как единую "молекулу", а как объединение двух ионов: NH 4 + и SO 4 2- . Заряды ионов нам известны, в каждом из них содержится лишь один атом с неизвестной степенью окисления. Пользуясь опытом, приобретенным при решении предыдущих задач, легко находим степени окисления азота и серы. Ответ: (N -3 H 4 +1) 2 S +6 O 4 -2 .
Вывод: если в молекуле содержится несколько атомов с неизвестными степенями окисления, попробуйте "разделить" молекулу на несколько частей.
Как расставлять степени окисления в органических соединениях
Пример 6 . Укажите степени окисления всех элементов в CH 3 CH 2 OH.
Решение . Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы. Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность С превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН 2 ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3 C -1 H +1 2 O -2 H +1 .
Не смешивайте понятия "валентность" и "степень окисления"!
Степень окисления часто путают с валентностью . Не совершайте подобной ошибки. Перечислю основные отличия:
- степень окисления имеет знак (+ или -), валентность - нет;
- степень окисления может быть равна нулю даже в сложном веществе, равенство валентности нулю означает, как правило, что атом данного элемента не соединен с другими атомами (всякого рода соединения включения и прочую "экзотику" здесь обсуждать не будем);
- степень окисления - формальное понятие, которое приобретает реальный смысл лишь в соединениях с ионными связями, понятие "валентность", наоборот, наиболее удобно применять по отношению к ковалентным соединениям.
Степень окисления (точнее, ее модуль) часто численно равен валентности, но еще чаще эти величины НЕ совпадают. Например, степень окисления углерода в CO 2 равна +4; валентность С также равна IV. А вот в метаноле (CH 3 OH) валентность углерода остается той же, а степень окисления С равна -1.
Небольшой тест на тему "Степень окисления"
Потратьте несколько минут, проверьте, как вы усвоили эту тему. Вам необходимо ответить на пять несложных вопросов. Успехов!
Химического элемента в соединении, вычисленный из предположения, что все связи имеют ионный тип.
Степени окисления могут иметь положительное, отрицательное или нулевое значение, поэтому алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, а в ионе - заряду иона .
1. Степени окисления металлов в соединениях всегда положительные.
2. Высшая степень окисления соответствует номеру группы периодической системы, где находится данный элемент (исключение составляют: Au +3 (I группа), Cu +2 (II), из VIII группы степень окисления +8 может быть только у осмия Os и рутения Ru .
3. Степени окисления неметаллов зависят от того, с каким атомом он соединён:
- если с атомом металла, то степень окисления отрицательная;
- если с атомом неметалла то степень окисления может быть и положительная, и отрицательная. Это зависит от электроотрицательности атомов элементов.
4. Высшую отрицательную степень окисления неметаллов можно определить вычитанием из 8 номера группы, в которой находится данный элемент, т.е. высшая положительная степень окисления равна числу электронов на внешнем слое, которое соответствует номеру группы.
5. Степени окисления простых веществ равны 0, независимо от того металл это или неметалл.
Элементы с неизменными степенями окисления.
|
Элемент |
Характерная степень окисления |
Исключения |
|
Гидриды металлов: LIH -1 |
||
|
Степенью окисления называют условный заряд частицы в предположении, что связь полностью разорвана (имеет ионных характер). H - Cl = H + + Cl - , Связь в соляной кислоте ковалентная полярная. Электронная пара в большей степени смещена в сторону атома Cl - , т.к. он более электроотрицацельный элемент. Как определить степень окисления?Электроотрицательность - это способность атомов притягивать к себе электроны других элементов. Степень окисления указывается над элементом: Br 2 0 , Na 0 , O +2 F 2 -1 , K + Cl - и т.д. Она может быть отрицательной и положительной. Степень окисления простого вещества (несвязанное, свободное состояние) равна нулю. Степень окисления кислорода у большинстве соединений равна -2 (исключение составляют пероксиды Н 2 О 2 , где она равна -1 и соединения с фтором - O +2 F 2 -1 , O 2 +1 F 2 -1 ). - Степень окисления простого одноатомного иона равна его заряду: Na + , Ca +2 . Водород в своих соединениях имеет степень окисления равную +1 (исключения составляют гидриды - Na + H - и соединения типа C +4 H 4 -1 ). В связях «металл-неметалл» отрицательную степень окисления имеет тот атом, который обладает большей электрооприцательностью (данные об элеткроотрицательности приведены в шкале Полинга): H + F - , Cu + Br - , Ca +2 (NO 3 ) - и т.д. Правила определения степени окисления в химических соединениях.Возьмем соединение KMnO 4 , необходимо определить степень окисления у атома марганца. Рассуждения:
К + Mn X O 4 -2 Пусть Х - неизвестная нам степень окисления марганца. Количество атомов калия - 1, марганца - 1, кислорода - 4. Доказано, что молекула в целом электронейтральна, поэтому ее общий заряд должен быть равен нулю. 1*(+1) + 1*(X ) + 4(-2) = 0, Х = +7, Значит, степень окисления марганца в перманганате калия = +7. Возьмем другой пример оксида Fe 2 O 3 . Необходимо определить степень окисления атома железа. Рассуждение:
2*(Х) + 3*(-2) = 0, Вывод: степень окисления железа в данном оксиде равна +3. Примеры. Определить степени окисления всех атомов в молекуле. 1. K 2 Cr 2 O 7 . Степень окисления К +1 , кислорода О -2 . Учитывая индексы: О=(-2)×7=(-14), К=(+1)×2=(+2). Т.к. алгебраическая сумма степеней окисления элементов в молекуле с учётом числа их атомов равна 0, то число положительных степеней окисления равно числу отрицательных. Степени окисления К+О=(-14)+(+2)=(-12). Из этого следует, что у атома хрома число положительных степеней равно 12, но атомов в молекуле 2, значит на один атом приходится (+12):2=(+6). Ответ: К 2 + Cr 2 +6 O 7 -2 . 2. (AsO 4) 3- . В данном случае сумма степеней окисления будет равна уже не нулю, а заряду иона, т. е. - 3. Составим уравнение: х+4×(- 2)= - 3 . Ответ: (As +5 O 4 -2) 3- . |